重症中暑大鼠肠系膜淋巴微循环变化
2014-03-02童华生段鹏凯张兴钦万鹏唐柚青唐丽群苏磊
童华生,段鹏凯,张兴钦,万鹏,唐柚青,唐丽群,苏磊
有研究认为,在多种重症疾患应激早期,肠源性毒性物质即可通过肠系膜淋巴途径直接诱导全身炎症反应并引起内脏器官损害[1-2]。我们的前期研究亦发现重症中暑时肠淋巴可激活血管内皮细胞损伤[3]。不同重症疾病状态下,肠系膜淋巴微循环的改变与其病理生理学效应具有一定相关性。因此,观察重症中暑状态下肠系膜淋巴微循环的变化规律有助于了解其可能的发病机制。
1 材料与方法
1.1 重症中暑大鼠模型制备及分组 由于雌激素对热损伤具有保护作用[4],本实验采用雄性Wistar大鼠共31只,由广州军区广州总医院实验动物中心提供,体重220~250g。以3%戊巴比妥钠(1ml/kg)经腹腔注射麻醉,固定于手术台;于左侧腹股沟中点分离股动、静脉,股动脉置入24G套管针连接压力转换器,监测有创动脉血压及脉搏。肛门插入内置式温度探头(向心方向约4cm)记录深部直肠温度。将大鼠置于仿真气候舱内,舱内温度40.0±0.5℃,湿度60%±5%,持续热暴露状态下,动物中心体温达42℃以上,平均动脉压(mean arterial pressure,MAP)从峰值下降25mmHg即为重症中暑[3,5],作为热暴露组。对照组动物则始终置于常温25.0±0.5℃,湿度35%±5%的环境中。
1.2 肠系膜淋巴微循环测定 11只大鼠用于肠系膜淋巴微循环相关参数检测(其中3只在制模和参数检测过程中死亡)。动态测定存活的8只大鼠在热暴露前、中心体温42℃时点、重症中暑发生时点的肠系膜淋巴微循环参数。按文献[3,6-7]的方法制备大鼠活体肠系膜标本,以37±1℃ K-H(Krebs-Henseleit)灌流液滴流,维持标本环境恒定。通过微循环显微电视观察测量回肠下段肠系膜淋巴管最大舒张口径、最大收缩口径及静态口径,计算肠系膜淋巴管相关参数。收缩活性指数(Index-Ⅰ)=(b2-c2)/b2,总收缩活性指数(Index-Ⅱ)=(b2-c2)a2/b2,淋巴动力学指数(L.D-Index)=(b-c)100a/d2,其中a为自主收缩频率,b为最大舒张口径,c为最大收缩口径,d为静态口径。用录像机记录分析肠系膜淋巴管自主收缩频率,记录4次收缩周期时相的平均值。参照文献[1,7]的方法,动态测定肠系膜淋巴管压力的变化。
1.3 肠系膜淋巴动力学测定 20只大鼠用于肠系膜淋巴动力学参数的检测,分为对照组和热暴露组,每组8只(其中4只在制模和淋巴引流过程中死亡)。行肠系膜淋巴插管引流淋巴液[3],从热暴露前30min开始,每隔30min动态记录肠系膜淋巴引流量,记录至热暴露后90min。
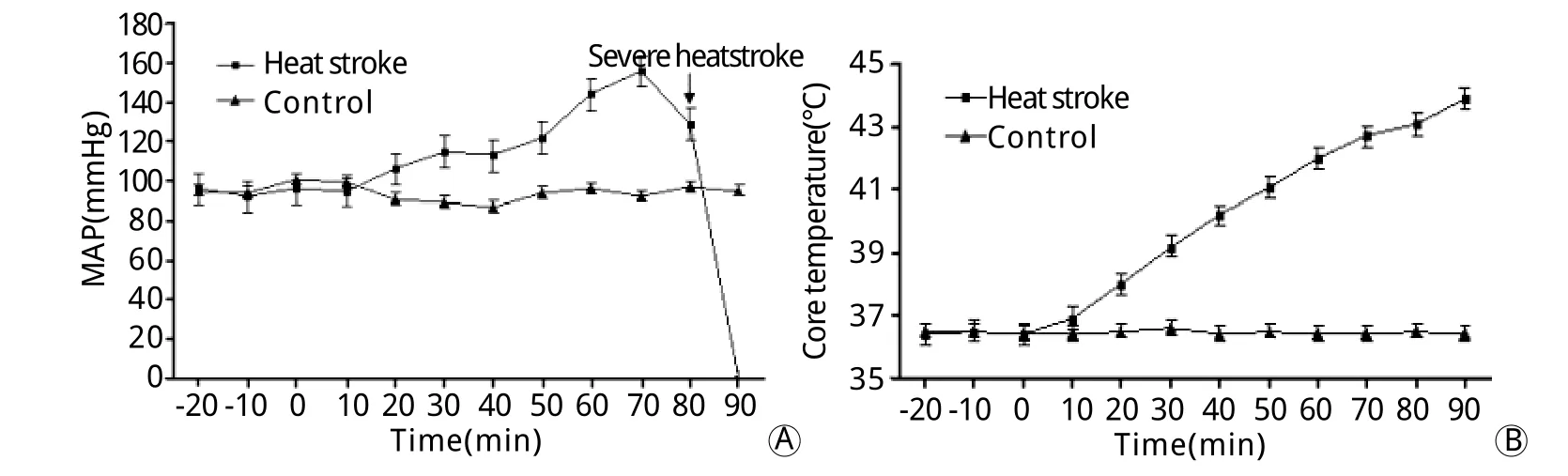
图1 热暴露大鼠平均动脉压(A)和中心体温(B)的变化Fig.1Kinetic changes of mean arterial pressure(A) and core temperature(B) of rats exposed to heat
1.4 统计学处理 采用SPSS 15.0软件进行分析,计量数据以x±s表示,组间比较采用One-way ANOVA分析,P<0.05为差异有统计学意义。
2 结 果
2.1 热暴露大鼠血压和中心体温变化 大鼠热暴露20min内MAP呈小幅度上升,随后25min血压变化不明显,45~70min MAP迅速升至160mmHg左右,此后7min MAP呈下降趋势,在约77min时降低了25mmHg,此时即为重症中暑发生时间。如不脱离高温高湿环境,MAP呈持续进行性下降,约13min后大鼠MAP降至0mmHg,动物死亡。大鼠热暴露后10min内中心体温变化不明显,从10min开始中心体温呈上升趋势,约60min达到42℃。发生重症中暑时,中心体温达43.1℃,死亡时中心体温高达43.9℃(图1)。
2.2 热暴露大鼠肠系膜淋巴微循环变化 大鼠热暴露后60min,肠系膜淋巴管自主收缩频率、收缩活性指数Index-Ⅰ、Index-Ⅱ、L.D-Index和淋巴压力呈下降趋势(P<0.05),而在重症中暑发生时肠系膜淋巴管自主收缩频率、收缩活性指数Index-Ⅰ、Index-Ⅱ、L.D-Index和淋巴压力较中心体温为42℃时有所上升(P<0.05),但未达到热暴露前水平(P<0.05,表1)。
2.3 热暴露大鼠肠系膜淋巴引流量变化 热暴露30min后,热暴露大鼠肠系膜淋巴生成量逐渐减少,其后30min进一步减少,而热暴露60min后,肠系膜淋巴生成量又逐渐增加,与对照组比较,差异有统计学意义(P<0.05,图2)。
3 讨 论
肠淋巴循环是微循环的重要组成部分,对维持机体正常的血液循环具有重要影响。近年研究发现,多种重症疾患应激早期肠系膜淋巴即可发挥毒性效应,启动全身炎症反应和多脏器功能损害[1-2]。我们前期研究发现,重症中暑肠淋巴可激活血管内皮细胞损伤,这可能构成了其发病的重要基础[3]。然而,目前尚不清楚重症中暑动态病程中肠系膜淋巴微循环发生了何种变化。
表1 热暴露大鼠肠系膜淋巴管微循环指数变化,n=8)Tab.1Changes of mesenteric lymph micro-circulation index in rats exposed to heat (, n=8)
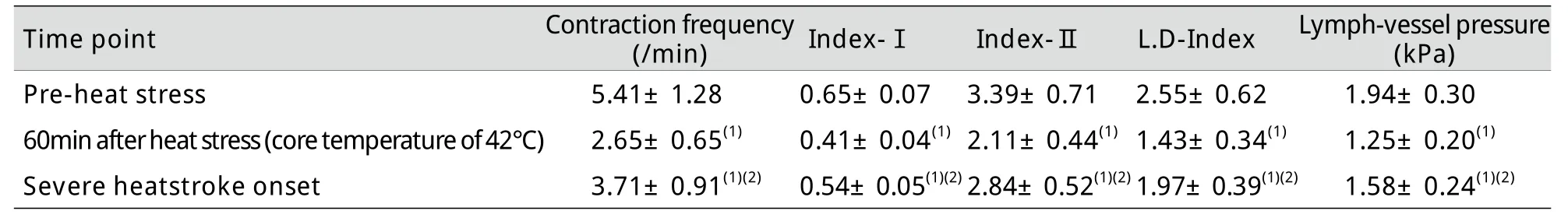
表1 热暴露大鼠肠系膜淋巴管微循环指数变化,n=8)Tab.1Changes of mesenteric lymph micro-circulation index in rats exposed to heat (, n=8)
(1)P<0.05compared with pre-heat stress; (2)P<0.05compared with 60min after heat stress
Time point Contraction frequency(/min) Index-Ⅰ Index-Ⅱ L.D-Index Lymph-vessel pressure(kPa)Pre-heat stress 5.41±1.28 0.65±0.07 3.39±0.71 2.55±0.62 1.94±0.3060min after heat stress (core temperature of 42℃) 2.65±0.65(1) 0.41±0.04(1)2.11±0.44(1)1.43±0.34(1) 1.25±0.20(1)Severe heatstroke onset 3.71±0.91(1)(2) 0.54±0.05(1)(2)2.84±0.52(1)(2)1.97±0.39(1)(2) 1.58±0.24(1)(2)
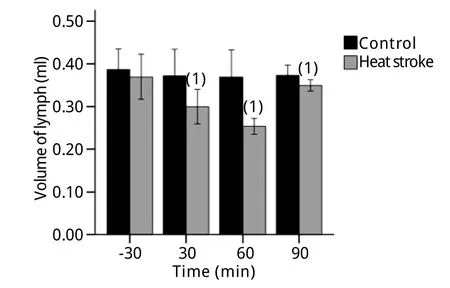
图2 热暴露大鼠肠系膜淋巴生成量比较Fig.2Comparison of the amount of mesenteric lymph in rats exposed to heat
本研究成功建立了重症中暑大鼠模型,实验动物经历了中心体温渐进上升随即出现休克的过程,此过程可能伴随肠道早期缺血缺氧、后期缺血再灌注损伤、肠黏膜通透性增加等,导致肠源性毒性物质进入循环系统,从而启动全身炎症反应综合征(SIRS)和多脏器功能障碍综合征(MODS)[8-12]。由于肠系膜淋巴循环是构成肠道血液微循环的重要组成部分,本研究探讨了重症中暑病程中肠系膜淋巴循环的动态变化特点。研究发现,热暴露60min时(大鼠中心体温达到42℃),大鼠肠系膜淋巴微循环参数包括自主收缩频率、Index-Ⅰ、Index-Ⅱ和L.DIndex均明显下降(P<0.05);且肠系膜淋巴压力和肠系膜淋巴生成量亦同时下降(P<0.05)。这种早期的肠系膜淋巴微循环障碍,一方面可能是热暴露下肠道缺血在肠系膜淋巴微循环的具体体现;另一方面则是肠系膜淋巴生成、回流减少,部分缓解了肠源性毒性物质进入血液循环发挥毒性效应,对机体发挥了一定的保护作用。随着大鼠热暴露时间的延长,大鼠血压发生顽固性下降,呈休克状态,即重症中暑[3-4]。此时,大鼠肠系膜淋巴微循环参数自主收缩频率、Index-Ⅰ、Index-Ⅱ和L.D-Index表现出一定程度的上升(P<0.05);肠系膜淋巴压力和肠系膜淋巴生成量亦呈增加趋势(P<0.05),但较热暴露前仍明显减少(P<0.05)。由于肠道后期发生了缺血再灌注的病理生理过程[8-10],肠系膜淋巴亦可能经历了后期回流相对增加的过程,对重症中暑病程进展呈现出双刃剑作用。淋巴微循环系统可回流组织液、蛋白质,参与机体免疫反应并维持恒定的细胞微循环,对休克的形成和转归具有重要意义[13-14]。由于淋巴管的自主性、节律性收缩是淋巴液转运的动力和淋巴回流量的基本保证,因此肠系膜淋巴管的自主收缩频率、Index-Ⅰ、Index-Ⅱ、L.D-Index和淋巴管压力的上升,淋巴液生成的增多可能是机体的代偿反应,从而部分缓解重症中暑休克的进展。然而,由于此时肠道损伤致肠源性毒性物质大量存在,肠系膜淋巴生成、回流的增加亦可能导致更多的肠源性毒性物质入血,进一步启动并加重SIRS和MODS,加重重症中暑病情。
综上所述,本研究结果显示,重症中暑发生了特征性的肠系膜淋巴微循环功能障碍,这可能是重症肠道微循环障碍的肠系膜淋巴循环的具体反映,同时可能对重症中暑病情的进展具有重要意义。基于肠系膜淋巴微循环动态变化规律的认识,挖掘其相应的阶段性调控干预措施可能是重症中暑救治的有效方法。
[1]Gabriela C, Helori VD, Alexandre LS, et al. Lymphatic system as a path underlying the spread of lung and gut injury after iniestinal isehemia/reperfusion in rats[J]. Shock, 2005, 23(4):330-336.
[2]Spindler-Vesel A, Wraber B, Vovk I, et al. Intestinal permeability and cytokine inflammatory response in multiply injured patients[J]. J Interferon Cytokine Res, 2006, 26(10): 771-776.[3]Tong H, Wan P, Zhang X, et al. Vascular endothelial cell injury partly induced by mesenteric lymph in heat stroke[J].Inflammation, 2014, 37(1): 27-34.
[4]Chen SH, Chang FM, Niu KC, et al. Resuscitation from experimental heatstroke by estrogen therapy[J]. Crit Care Med,2006, 34(4): 1113-1118.
[5]Chen SH, Chang FM, Chang HK, et al. Human umbilical cord blood-derived CD34+cells cause attenuation of multiorgan dysfunction during experimental heat stroke[J]. Shock, 2007,27(6): 663-671.
[6]Yasuda A, Ohshima N. In situ observations of spontaneous contractions of the peripheral lymphatic vessels in the rat mesentery: effects of temperature [J]. Experientia, 1984, 40(4):342-343.
[7]Liu YK, Niu CY, Zhao ZG. Study on intestinal lymph circulation in anesthetized rats[J]. Chin J Microcirc, 2000, 10(1): 4-6. [刘艳凯, 牛春雨, 赵自刚, 等. 麻醉大鼠肠淋巴循环的研究[J].微循环学杂志, 2000, 10(1): 4-6.]
[8]Lambert GP. Role of gastrointestinal permeability on exertional heatstroke[J]. Exerc Sport Sci Rev, 2004, 32(4): 185-190.
[9]Hall DM, Buettner GR, Oberley LW, et al. Mechanisms of circulatory and intestinal barrier dysfunction during whole body hyperthermia[J]. Am J Physiol Heart Circ Physiol, 2001,280(2): 509-521.
[10]Crispe IN, Giannandrea M, Klein I, et al. Cellular and molecular mechanisms of liver tolerance[J]. Immunol Rev, 2006, 213(1):101-118.
[11]Liu YN, Geng Y, Fu W, et al. Relationship between core temperature change during recovery and prognosis in classic heat stroke rat models[J]. Med J Chin PLA, 2013, 38(10): 818-821. [刘亚楠, 耿焱, 付炜, 等. 经典型热射病大鼠恢复期体温变化与预后的关系[J]. 解放军医学杂志, 2013, 38(10): 818-821.]
[12]Geng Y, Fu W, Liu YN, et al. Comparison of classical heat stroke between conscious and unconscious rat models[J]. Med J Chin PLA, 2013, 38(8): 615-619. [耿焱, 付炜, 刘亚楠, 等. 清醒与麻醉状态经典型热射病大鼠模型比较[J]. 解放军医学杂志,2013, 38(8): 615-619.]
[13]Mayall RC, Mayall AC, Mayall JC, et al. Lymphatic dysfunction in conjunction with dysregulated hyperdynamic blood flow ( the hyperstomy syndrome)[J]. Lymphology, 1997, 30(2): 98-102.
[14]Akira S, Tsuneyasu K, Minako O, et al. Critical roles of PTEN in B cell homeostasis and immunoglobulin class switch recombination [J]. Exp Med, 2003, 197(5): 657-667.
