S-KIR基因组合型与肝移植术后急性排斥发生率的关
2014-03-02陈小平李雪松骆利敏陈世洪王忠罗敏肖露露
陈小平,李雪松,骆利敏,陈世洪,王忠,罗敏,肖露露
自然杀伤(nature killer,NK)细胞表面的免疫蛋白样多态性家族受体(killer immunoglobulin-like receptor,KIR)对其发挥细胞毒样自然杀伤作用具有重要意义。KIR可调节NK细胞在感染反应、肿瘤免疫、移植免疫和自身免疫性疾病中的杀伤功能,研究其多态性有助于理解NK细胞作为先天性免疫细胞发挥有益或有害免疫作用的机制[1-2]。近年有关KIR与肾移植和肝移植急性排斥反应(acute rejection,AR)的研究主要集中在供受者NK细胞的KIR与人类主要组织相容性复合物Ⅰ(human leukocyte antigenⅠ,HLA-Ⅰ)类分子的错配分析[3-5]。这些错配分析表明,HLA-C是抑制型NK细胞受体(L-KIR)最主要的配体,调节HLA-C与KIR的相互作用可能是改善移植物及患者长期存活的重要途径。但是,目前尚不明确KIR受体发挥的作用,因为一个NK细胞可以单独或同时表达多个抑制型和激活型KIR受体(S-KIR),不同个体KIR基因的表达频率和基因组合也不相同。本研究回顾性分析56对供受者KIR基因的组合型,观察KIR基因是否与肝移植术后AR的发生相关。
1 资料与方法
1.1 研究对象 解放军458医院肝胆外科2007年2月-2013年2月因肝衰竭接受原位异基因肝脏移植的受者56例及相应供者。取静脉血液2ml,EDTANa2抗凝,-20℃保存。
1.2 肝移植受者临床信息采集 56例受者均为初次肝脏移植,年龄41.9±12.1(19~60)岁,其中男性52例(92.86%),女性4例(7.14%)。原发疾病包括原发性肝癌、肝炎后肝硬化、酒精性肝硬化、肝豆状核变性合并急性肝功能衰竭。肝脏移植后住院天数32.7±10.3d,移植物存活>30d。肝移植术式均为经典原位肝移植。
1.3 肝移植后AR的诊断 根据Banff排斥活动指数明确是否发生AR以及AR的严重程度。诊断标准:①临床表现为发热、尿量减少、移植肝区胀痛、血清转氨酶升高伴或不伴胆红素升高;②彩色多普勒超声检查显示供肝血管阻力指数升高;③供肝细针穿刺活检病理检查符合AR病理标准。
1.4 术中及术后免疫抑制剂的使用 所有受者术中无肝期前和无肝期均使用甲泼尼龙(Pred)500mg;术后基础免疫抑制方案采用三联疗法[他克莫司(FK506)+霉酚酸酯(MMF)+Pred],即术后第1~6天静脉使用Pred并逐日递减使用量,术后第7天开始改为口服,60mg/d,每3~4d递减10mg,直至使用剂量为10mg/d时维持,术后第2天加用MMF,1g/次,2次/d,术后第5天加用FK506并维持药物浓度(谷浓度)为8~10ng/ml。
1.5 KIR基因分型 取全血提取DNA,A260/A280为0.9~1.6。采用序列特异性引物聚合酶链反应技术(polymerase chain reaction-sequences specific primer,PCR-SSP)进行KIR基因分型。
1.5.1 KIR引物序列设计[1]根据2010年11月10日IPD (immuno polymorphism database)KIR序列数据库(www.ebi.ac.uk/ipd/kir)公布的KIR碱基编码序列(release 1.3.0),设计23对上下游引物序列,经BLAST软件验证可识别16个KIR基因及12个等位基因,包括14个功能基因及其8个等位基因2DL1、2DL2、2DL3、2DL4(group1& group2)、2DL5(A*001、005、B*、B*002、003、004)、3DL1、3DL2、3DL3、2DS1、2DS2、2DS3、2DS4(group1& group2)、2DS5、3DS1,沉默基因2DP1、3DP1(*001、002、003、004)。内对照采用人类生长激素(HGH)基因特异性引物,浓度25μmol/L。引物由天津秀鹏科技有限公司合成(表1)。
1.5.2 PCR-SSP反应 反应体系:模板DNA 1μl,PCR Buffer 5μl,15mol/L MgCl21μl,dNTP 1μl,上、下游引物各1μl(浓度为25μmol/L),Taq酶0.08U。96℃预变性 2min;96℃变性15s,65℃退火60s,10次循环;96℃变性15s,61℃退火50s,30℃延伸30s,20次循环。依次取扩增产物8μl,2%琼脂糖凝胶水平电泳(12mV/cm),溴化乙啶染色,UVP成像。
1.5.3 S-KIR组合类型与基因包含关系 参照文献[2],KIR基因组合型分为L-KIR(AA)和S-KIR(AB/BB类型)。
1.6 统计学处理 采用SPSS 16.0软件进行分析。两组计量资料的比较采用两样本t检验,两组AR发生率的比较采用Fisher确切概率法。P<0.05为差异有统计学意义。
2 结 果
2.1 受者KIR基因频率及组合型频率 由于沉默基因2DP1、3DP1会导致内在遗传缺失而无法阐述其功能,本研究参照文献[2]对KIR功能基因的14个组合型进行了分析。56例受者共获得8个组合型,其中2个KIR基因的组合型为:由多个抑制型KIR基因(KIR-2DL1、2DL3、2DL4、3DL1、3DL2、3DL3)和1个激活型KIR基因(2DS4)组成,即仅包含AA类型;由多个抑制型KIR基因(KIR-2DL1、2DL3、2DL4、3DL1、3DL2、3DL3)和多个激活型KIR基因(2DS1、2DS2、2DS3、2SD4、2DS5、3DS1)组成,即AB类型;由多个抑制型KIR基因(KIR-2DL1、2DL3、2DL4、3DL1、3DL2、3DL3)和不包括KIR-2DS4的多个激活型KIR(2DS1、2DS2、2DS3、2DS5、3DS1)组成,即BB类型(表2)。其中L-KIR(AA)在肝移植患者中的表达频率为0.499,S-KIR(AB/BB)在肝移植患者中的表达频率为0.500(表3)。
2.2 肝移植后受者AR发生率 56例受者中有16例发生了AR,AR发生率28.6%,AR发生时间为术后7~30d,中位时间为术后14d。
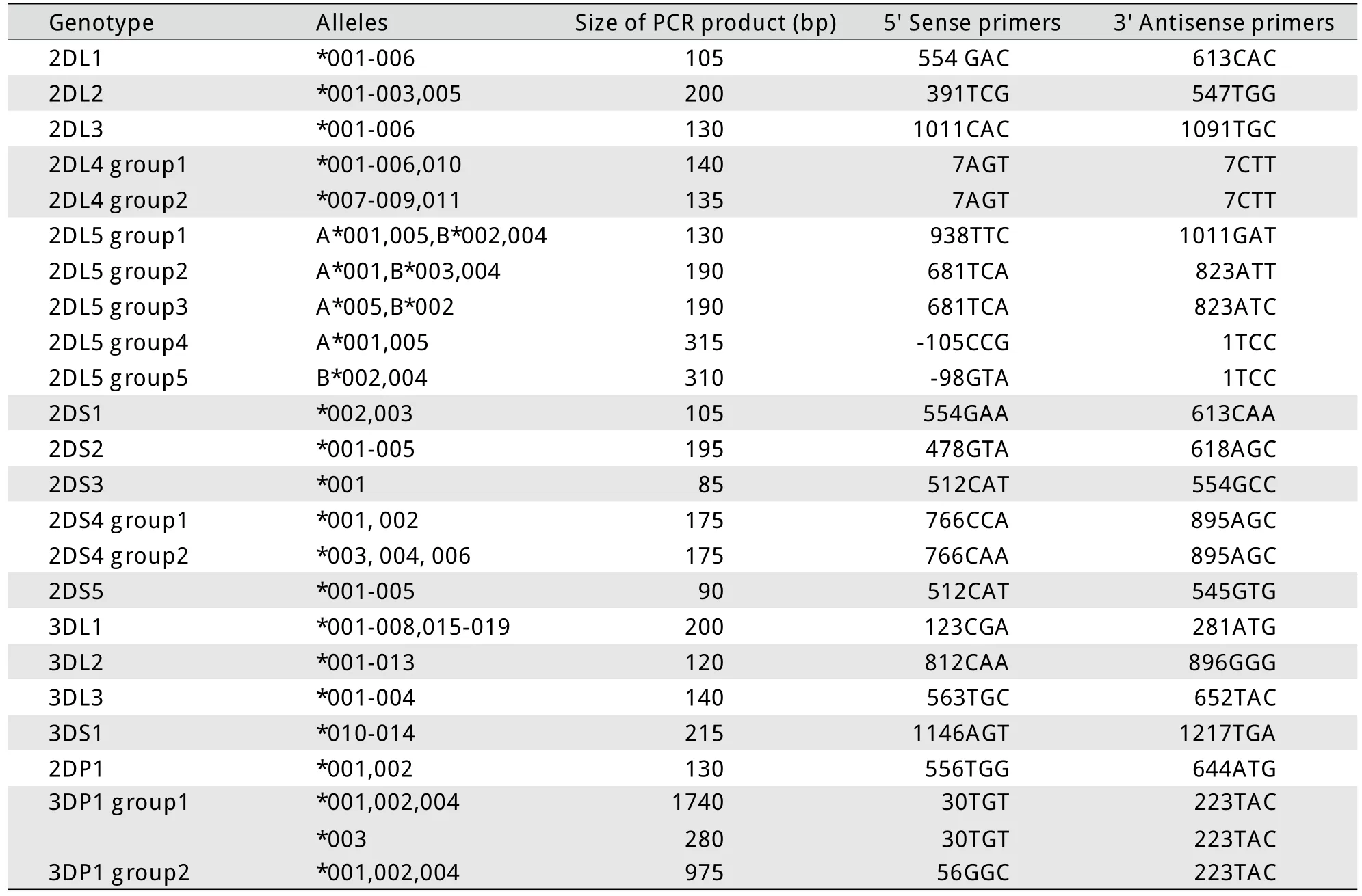
表1 KIR基因及其等位基因引物序列Tab.1Primers for identification of KIR genes and allelic genes

表2 KIR基因组合与KIR基因的包含关系Tab.2KIR genotype assortment and inclusion relation thereof
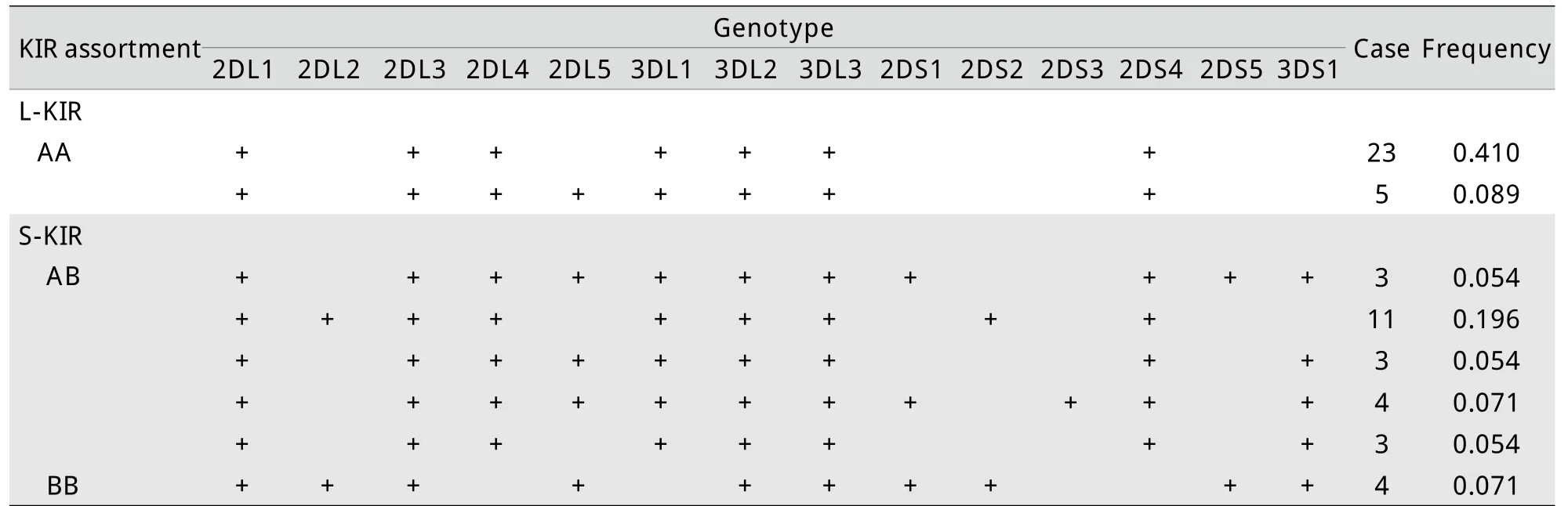
表356 例肝移植受者KIR基因频率和组合型频率一览表Tab.3Frequency of KIR gene and its assortment in 56cases of liver transplantation recipients
2.3 供、受者KIR基因组合型与肝移植后AR的关系 16例术后发生AR的患者中,受者为L-KIR者占18.8%(3/16),受者为S-KIR者占43.8%(7/16),两者之间差异无统计学意义(P>0.05);供者为L-KIR者占25.0%(4/16),供者为S-KIR者占12.5%(2/16),两者之间差异亦无统计学意义(P>0.05)。
2.4受者KIR激活基因数量与肝移植后AR发生率的关系 在移植后发生AR的受者中,表达1个KIR激活基因(S1)的占16.67%,表达≥2个激活KIR基因(S2)的占83.33%,两者之间差异有统计学意义(P<0.05)。
3 讨 论
器官移植后,联合应用免疫抑制药物可在细胞周期的不同阶段和不同信号传导通路上阻断淋巴细胞的活化、增殖[6-7]。NK细胞具有自然杀伤作用,可以通过加强免疫抑制作用来控制宿主对移植物的排斥。此外,KIR还可特异性识别HLA,形成对靶细胞的激活或耐受通路,介导并调节NK细胞和效应性T细胞的杀伤功能。NK细胞毒性被认为是特定的KIR的刺激性效应和抑制性效应之间平衡的结果。由此可以认为,在病理和药物环境下,NK细胞承担着“获得免疫”的生物学功能[5]。本研究结果显示,L-KIR(AA)在肝移植患者中占50.0%(28/56),其表达频率为0.499,S-KIR(AB/BB)也占50.0%(28/56),其表达频率为0.500。国内外学者普遍认为在肝移植患者中,KIR基因组合型以抑制性信号通路为主[4-5],但本文结果显示S-KIR在其中也起着重要作用。
本研究对L-KIR/S-KIR与移植后AR的关系进行分析发现,L-KIR受者AR发生率较低但供者AR发生率较高,S-KIR受者AR发生率较高但供者AR发生率较低。此外,本研究结果还显示,供受者基因组合型为L-KIR或S-KIR时,其AR发生率之间差异无统计学意义(P>0.05),即无论KIR组合型为抑制型还是激活型,对肝移植后AR的发生均没有明显影响。进一步分析显示,受者S-KIR数目≥2与移植后AR的发生有关,即受者S-KIR数目≥2有增加肝脏移植后AR发生率的可能性,提示在肝移植中对受者进行KIR检测具有一定临床意义。
本组研究对象中有部分肝癌患者,而肝癌细胞能明显下调KIR表达,抑制NK细胞活性,也可能并未直接参与对移植物的排斥,而是通过一些未知的免疫信号通路对受者获得性免疫功能的调节起作用[8]。总之,我们的研究提示,受者S-KIR基因组合型及数目可能增加肝移植术后AR的发生率,可借助S-KIR或L-KIR与特异性识别配体HLA-Ⅰ类分子来调控受者的NK细胞功能。上述结论为肝移植后小剂量、低浓度、联合抗排斥药物的临床应用研究提供了参考。
[1]Eissens DN, Van Der Meer A, Van Cranenbroek B, et al.Rapamycin and MPA, but not CsA, impair human NK cell cytotoxicity due to differential effects on NK cell phenotype[J].Am J Transplant, 2010, 10(9): 1981-1990.
[2]Moroso V, van der Meer A, Tilanus HW, et al. Donor and recipient HLA/KIR genotypes do not predict liver transplantation outcome[J]. Transpl Int, 2011, 24(9): 932-942.
[3]Castroagudín JF, Molina E, Varo E. Calcineurin inhibitors in liver transplantation: to be or not to be[J]. Transplant Proc, 2011,43(6): 2220-2223.
[4]Fu SJ, Yu LX, Luo M, et al. Association between inhibitory KIR genotype assortment and acute rejection after kidney transplantation[J]. J Fourth Mil Med Univ, 2009, 30( 10): 929-931. [付绍杰, 于立新, 罗敏, 等. 抑制型KIR基因组合型与肾移植急性排斥反应的关系[J]. 第四军医大学学报, 2009,30(10): 929-931.]
[5]Yu LX, Xiao F, Xiao LL, et al. KIR/HLA ligand matching and acute rejection after kidney transplantation[J]. J South Med Univ, 2010, 30(2): 288-291. [于立新, 肖飞, 肖露露, 等. KIR及其HLA配体与肾移植急性排斥反应的关系[J]. 南方医科大学学报, 2010, 30(2): 288-291.]
[6]Yu HB, Jian M, Liu Y, et al. Expression of ILT-4mRNA in peripheral blood mononuclear cell of liver cancer patients[J].J Logist Univ CAPF(Med Sci), 2012, 21(12): 955-957. [喻红波, 简明, 刘阳, 等. 肝癌患者外周血单个核细胞ILT-4mRNA的表达[J]. 武警后勤学院学报(医学版), 2012, 21(12): 955-957.]
[7]Li T, Hou J. Progress of acute graft versus host disease caused by natural killer T cells[J]. Chin J Pract Intern Med, 2013, 33(2):154-156. [李拓, 侯健. 自然杀伤样T细胞引发急性移植物抗宿主病研究进展[J]. 中国实用内科杂志, 2013, 33(2): 154-156.]
[8]Kitchens WH, Uehara S, Chase CM, et al. The Changing role of natural killer cells in solid organ rejection and tolerance[J].Transplantation, 2006, 81(6): 811-817.
