肝癌抑制基因1对肝癌细胞干性表型及侵袭转移能力的影响
2014-03-02林峰张晨虹周志军刘芳魏若菡陈慧
林峰,张晨虹,周志军,刘芳,魏若菡,陈慧
我国是一个肝癌大国,目前患病人数约占全球肝癌患者总数的55%,在肿瘤相关死亡中仅次于肺癌,位居第二[1]。研究表明肝癌的发生是一个多基因参与,并通过不同基因表达进行调控的复杂过程,癌细胞的早期侵袭转移是肝癌患者死亡的重要原因之一[2]。深入研究肝癌的发生机制,评估、筛选肝癌细胞侵袭转移过程中的核心分子并制定靶向干预措施是目前肝癌基础与临床领域的研究重点。肝癌抑制基因1(hepatocellular carcinoma suppressor gene 1,HCCS1)是新近发现的候选肿瘤抑制基因,位于染色体17p13.3区,其cDNA全长约2.1×103,共18个外显子[3]。HCCS1在肝癌组织中存在高频突变,基因表达水平明显低于癌旁组织。研究发现HCCS1高表达能够促进钙离子内流而诱导细胞凋亡,HCCS1表达缺失则会促进细胞过度增殖[4]。非小细胞肺癌及结肠癌肿瘤细胞HCCS1较正常组织明显降低,且HCCS1表达水平越低,肿瘤恶性程度越高,患者更易出现肿瘤复发及转移[5-6]。目前,HCCS1已经成为肝癌及其他恶性肿瘤基因治疗的潜在靶点之一[6-7]。本研究探讨HCCS1对肝癌细胞干性表型及侵袭转移能力的影响,以期为研究肝癌治疗的新靶点提供理论依据。
1 材料与方法
1.1 主要试剂 荧光素PE标记的小鼠抗人CD133单克隆抗体及小鼠抗人CD90流式细胞检测用单克隆抗体购自德国Miltenyi Biotec公司;小鼠抗人E-钙黏蛋白(E-cadherin)、纤连蛋白免疫组化用单克隆抗体,HCCS1、E-cadherin、纤连蛋白、GAPDH蛋白印迹用单克隆抗体购自美国Santa Crutz公司;血管内皮生长因子(VEGF)酶联免疫吸附实验(enzyme linked immunosorbent assay,ELISA)试剂盒购自美国eBioscience公司;Matrigel购自美国BD公司。编码HCCS1基因的重组腺病毒载体(Ad-HCCS1)及对照病毒载体(Ad-LacZ)由本实验室自行构建。
1.2 细胞培养及分组 人肝癌细胞系细胞株MHCC-97H购自中科院上海细胞库,细胞培养于含10%胎牛血清的RPMI 1640培养液中,37℃、5%CO2密闭传代培养,每2~3d换液,收集对数生长期MHCC-97H细胞,配制成密度为1×106/ml细胞悬液。实验细胞分为正常对照组、HCCS1组及Ad-LacZ组。正常对照组细胞不做特殊处理,HCCS1及Ad-LacZ组细胞按感染复数(multiple of infection,MOI)100:1分别感染Ad-HCCS1及Ad-LacZ,培养5d后收集各组细胞及培养液上清,用于后续检测。
1.3 荧光定量RT-PCR检测HCCS1mRNA水平 各组细胞内HCCS1的mRNA表达水平采用荧光定量RT-PCR方法检测[8]。建立反转录PCR反应体系,总量10μl。所用引物序列如下:HCCS1,上游5'-GCAGATCTATGATGGA GGAGGAGGAACT-3',下游5'-GCCTCGAGC TACGTCCATCTCACCTGTT-3';GAPDH,上游5'-ACCACAGTCCATGCCATCAC-3',下游5'-TCCACCACCCTGTTGCTGTA-3'。PCR反应条件如下:50℃ 2min,95℃ 5min;95℃ 15s,60℃30s,循环40次。目的基因mRNA表达水平以相应标本内GAPDH mRNA为基准采用2-ΔΔCt方法计算,并将正常对照组标本内目的基因表达水平设为1,对其他组标本内目的基因的表达水平进行标准化计算(所得结果为1的倍数)[8]。
1.4 Western blotting检测相关基因蛋白表达水平裂解液裂解3组细胞,提取细胞总蛋白并采用BCA蛋白分析试剂盒测定蛋白浓度。采用12% SDSPAGE电泳分离蛋白质(30μg蛋白/泳道),将蛋白转移至硝酸纤维素膜上,常温下用含5%脱脂奶粉的TBST封闭2h;经TBST清洗2次后,加入适当稀释的小鼠抗人HCCS1、E-cadherin、纤连蛋白、GAPDH单克隆抗体(1:200),4℃孵育过夜;加入辣根过氧化物酶偶联的第二抗体孵育1h;加入底物并曝光、显影。
1.5 流式细胞术检测CD133+、CD90+细胞比例收集各组细胞,4℃ PBS清洗2次;将细胞沉淀充分混匀,调整细胞密度至1×106/ml,经过滤后,吸取100μl至试管,加入20μl PE标记的小鼠抗人CD133或CD90单克隆抗体,冰上避光作用约15min;每管各加入1×流式细胞检测用缓冲液380μl。采用流式细胞仪检测细胞凋亡率,并应用Cellquest软件对数据进行初步分析。
1.6 ELISA检测VEGF含量 各组细胞培养液上清中VEGF含量采用相应的ELISA试剂盒进行检测,按说明书进行操作。
1.7 Transwell实验 收集各组细胞,并用含1%胎牛血清的RPMI 1640培养液调整细胞密度至1×105/ml;在小室内加入200μl肿瘤细胞悬液,小室外加入800μl含10%胎牛血清的RPMI 1640培养液;常规培养48h,取出Transwell小室,HE染色,在显微镜下随机挑取10个200倍视野,计数穿膜细胞,每组重复4个样本。
1.8 统计学处理 采用SPSS 13.0统计软件进行分析,计量资料以x±s表示,多组样本均数之间的比较采用单因素方差分析,进一步两两比较采用LSD-t检验,P<0.05为差异有统计学意义。
2 结 果
2.1 HCCS1基因及蛋白表达水平 与正常对照组(0.92±0.10)及Ad-LacZ组(1.10±0.11)比较,HCCS1组细胞HCCS1mRNA表达水平(5.42±0.53)明显升高(P<0.01),但Ad-LacZ组与正常对照组比较差异无统计学意义(P>0.05)。与正常对照组及Ad-LacZ组比较,HCCS1组HCCS1蛋白表达水平明显升高(P<0.01),而Ad-LacZ组与正常对照组比较差异无统计学意义(P>0.05,图1)。
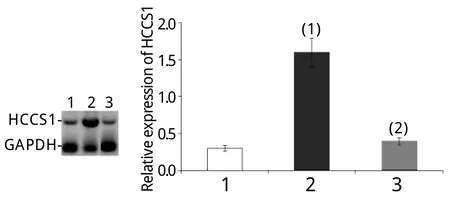
图1 各组细胞HCCS1蛋白表达水平Fig.1Expression of HCCS1protein in each group
2.2 CD133+、CD90+细胞比例 流式细胞术检测结果显示,与正常对照组及Ad-LacZ组比较,HCCS1组CD133+、CD90+细胞比例明显降低(P<0.01),但Ad-LacZ组与正常对照组比较差异均无统计学意义(P>0.05,表1)。
2.3 细胞培养液上清中的VEGF含量 ELISA检测结果显示,与正常对照组及Ad-LacZ组相比,HCCS1组细胞培养液上清中的VEGF含量明显降低(P<0.01),而正常对照组与Ad-LacZ组比较差异无统计学意义(P>0.05,表1)。

图2 各组细胞E-钙黏蛋白及纤连蛋白表达水平Fig.2Expression of E-cadherin and fibronectin in each group
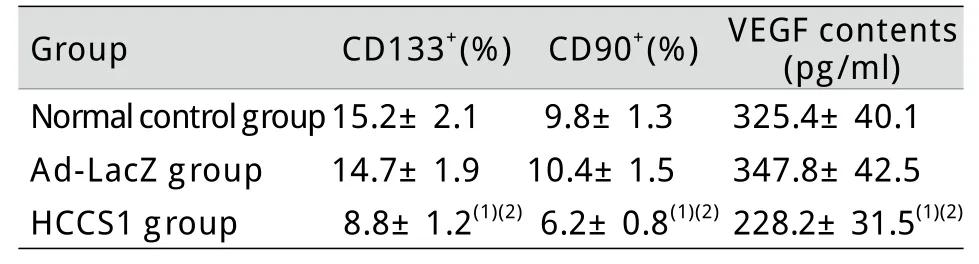
表1 各组细胞CD133+、CD90+细胞比例及培养液上清中的VEGF含量(x±s,n=4)Tab.1Proportion of CD133+, CD90+ positive cells and VEGF contents in the supernatant (x±s, n=4)
2.4 E-cadherin及纤连蛋白表达水平 Western blotting检测结果显示,与正常对照组及Ad-LacZ组相比,HCCS1组细胞E-cadherin及纤连蛋白表达水平均明显升高(P<0.01),而Ad-LacZ组与正常对照组比较差异无统计学意义(P>0.05,图2)。
2.5 各组细胞的侵袭转移能力 Transwell小室检测结果显示,HCCS1组穿膜细胞数量为14.2±2.1个,明显少于正常对照组(34.2±4.5个)及Ad-LacZ组(32.6±4.2个,P<0.01)。
3 讨 论
研究显示,在乳腺癌、前列腺癌、皮肤癌等肿瘤组织中存在一群数量较少,但具有较强的自我更新、分化潜能的细胞,称为肿瘤起始细胞或肿瘤干细胞(cancer stem cells,CSCs)[9-12]。2006年美国癌症研究协会对CSCs作出了如下定义:CSCs是肿瘤中具有自我更新能力并能产生异质性肿瘤细胞群的细胞;在肿瘤组织中,仅有CSCs具备肿瘤始动能力和转移特性;CSCs是维持肿瘤生长并逃避内、外源性调控的最重要细胞群[13]。进一步研究显示,肝癌组织内也存在CSCs,它们在肿瘤的发生、发展中发挥着关键作用,与肿瘤的侵袭、转移、抗药性的产生及治疗后的复发密切相关[14-15]。因此,研究肝癌组织内CSCs干性维持机制将有助于发展治疗肿瘤的新的有效手段[16-17]。
本研究结果显示,HCCS1能降低肝癌细胞CD133、CD90的表达。CD133最初作为人类造血干细胞表面的一种跨膜糖蛋白而被发现,现已作为肝癌干细胞的重要标志物而受到密切关注。2007年Ma等[18]率先发现CD133(+)肝癌细胞较CD133(-)肝癌细胞具有更强的体外克隆成瘤能力、更高的增殖性及体内成瘤能力,并且有肝祖细胞的重要特征,包括基因的表达、自我更新和分化能力。来源于临床手术切除肝癌标本的资料显示,CD133(+)肿瘤细胞频繁出现在肝癌组织中,且CD133高表达与肿瘤分级升高、疾病的进展阶段、较短的总生存期以及较高复发率相关[19]。同时,CD90作为肝癌干细胞的标志物也受到广泛重视。体内实验表明,多个小鼠肝癌细胞系及人肝癌细胞系中,CD90(+)肿瘤细胞的成瘤率较CD90(-)肿瘤细胞显著增强[20]。本研究结果表明,HCCS1能够抑制肝癌细胞的干性表型,其确切机制仍需进一步研究。
本研究进一步分析了HCCS1对肿瘤细胞侵袭转移能力的影响。肝癌的发生、发展与肿瘤血管生成密切相关。VEGF是目前已知的在原发性肝癌血管生成中作用最强的诱导血管生成因子,通过作用于血管内皮细胞、提高血管通透性、促进肝癌细胞的增殖从而促进肝癌的发生、发展[21]。研究显示,肝癌组织中VEGF的表达显著高于正常肝组织,且随着肝癌的进展呈上升趋势,是重要的肝癌预后分子之一[22]。本研究结果显示,HCCS1能够抑制肿瘤细胞合成并分泌VEGF。E-钙黏蛋白和纤连蛋白是参与细胞间连接的主要分子,发挥着维持细胞极性和组织结构完整性的功能,也抑制着肿瘤细胞的侵袭转移。肿瘤组织中E-钙黏蛋白表达降低,细胞间黏附力减弱并导致细胞外基质降解和基底膜缺损,进而促进肿瘤细胞突破原来的位置进入血管。有关结肠癌肝转移的研究发现,发生肝转移的结肠癌细胞中E-钙黏蛋白的表达较未发生肝转移的癌细胞明显降低。同时,采用RNA干扰技术降低肿瘤细胞中E-钙黏蛋白蛋白水平可明显促进细胞的侵袭生长能力并提高其耐药性[23]。研究结果显示,HCCS1能够明显提高肿瘤细胞内E-钙黏蛋白及纤连蛋白的表达。Transwell实验进一步证实HCCS1能够明显降低肝癌细胞的侵袭转移能力。
综上,本研究表明,HCCS1能降低人肝癌细胞株MHCC-97H的肿瘤干细胞表型并抑制其侵袭转移能力,为研究肝癌治疗的新靶点提供了理论依据。
[1]Bai XF, Wang PY, Wu YJ. Value of combined determination of tumor markers based on two discriminative models in facilitating diagnosis of hepatic carcinoma[J]. Med J Chin PLA, 2012,37(11): 1019-1022. [白雪峰, 王平瑜, 吴拥军. 基于两种判别模式的肿瘤标志物联合检测对肝癌辅助诊断的价值[J]. 解放军医学杂志, 2012, 37(11): 1019-1022.]
[2]Sano T, Izuishi K, Takebayashi R, et al. Surgical approach for extrahepatic metastasis of HCC in the abdominal cavity [J].Hepatogastroenterology, 2011, 58(112): 2067-2070.
[3]Zhao X, Li J, He Y, et al. A novel growth suppressor gene on chromosome 17p13.3with a high frequency of mutation in human hepatocellular carcinoma[J]. Cancer Res, 2001, 61(20):7383-7387.
[4]Gan Y, Zhao X, Hu J, et al. HCCS1overexpression induces apoptosis via cathepsin D and intracellular calcium, and HCCS1disruption in mice causes placental abnormality[J]. Cell Death Differ, 2008, 15(9): 1481-1490.
[5]Xiao-Yong S, Zhi-Feng L, Fan-Zhen L, et al. Expression and clinical significance of HCCS1in non-small cell lung cancer[J].Contemp Oncol (Pozn), 2012, 16(4): 328-331.
[6]Gan Y, Zhao X, Hu J, et al. Adenovirus-mediated HCCS1overexpression elicits a potent antitumor efficacy on human colorectal cancer and hepatoma cells both in vitro and in vivo[J].Cancer Gene Ther, 2008, 15(12): 808-816.
[7]Xu HN, Huang WD, Cai Y, et al. HCCS1-armed, quadrupleregulated oncolytic adenovirus specific for liver cancer as a cancer targeting gene-viro-therapy strategy[J]. Mol Cancer,2011, 10: 133.
[8]Song S, Shen X, Tang Y, et al. Sinomenine pretreatment attenuates cold ischemia/reperfusion injury in rats: the role of heme oxygenase-1[J]. Int Immunopharmacol, 2010, 10(6): 679-684.
[9]Gangopadhyay S, Nandy A, Hor P, et al. Breast cancer stem cells:a novel therapeutic target[J]. Clin Breast Cancer, 2013, 13(1):7-15.
[10]Tu SM, Lin SH. Prostate cancer stem cells[J]. Clin Genitourin Cancer, 2012, 10(2): 69-76.
[11]Li HX, Guan HH, Sun JF, et al. The differential expression and significance of tumor stem cell markers ABCG2, CK19and P63in patients with actinic keratosis, Bowen's Disease and squamous cell carcinoma[J]. Med J Chin PLA, 2012, 37(6): 623-627. [李泓馨, 管海宏, 孙建方, 等. 肿瘤干细胞标志物ABCG2、CK19和P63在皮肤日光性角化病、Bowen病及鳞状细胞癌中的表达差异及意义[J]. 解放军医学杂志, 2012, 37(6): 623-627.]
[12]Ge LL, Yang XA. Cancer stem cell-like properties of EpCAM+cell subpopulation in hepatocellular carcinoma cell line Huh-7[J]. J Zhengzhou Univ (Med Sci), 2012, 47(3): 306-309. [葛丽丽, 杨小昂. 肝癌细胞系Huh-7中EpCAM+细胞亚群的肿瘤干细胞样特性[J]. 郑州大学学报(医学版), 2012, 47(3): 306-309.]
[13]Clarke MF, Dick JE, Dirks PB, et al. Cancer stem cells perspecrives on current status and future directions: AACR Workshop on cancer stem cells[J]. Cancer Res, 2006, 66(19):9339-9344.
[14]Jin SL, Huang ZR, Chen H, et al. The biological difference between CD13+CD133+and CD13–CD133–liver cancer cells and its clinical significance[J]. Med J Chin PLA, 2013, 38(8):661-664. [金世龙, 黄中荣, 陈华, 等. CD13+CD133+和CD13-CD133-肝癌细胞的生物学差异及临床意义[J]. 解放军医学杂志, 2013, 38(8): 661-664.]
[15]Wen KM, Fu ZX, Zhang GH, et al. Apoptosis induced by Octamer 4gene silencing and its potential mechanism in colorectal cancer[J]. Med J Chin PLA, 2012, 37(10): 947-950.[文坤明, 傅仲学, 张贵海, 等. Oct4基因沉默对结直肠癌细胞凋亡的诱导作用及机制研究[J]. 解放军医学杂志, 2012,37(10): 947-950.]
[16]Bao B, Ahmad A, Li Y, et al. Targeting CSCs within the tumor microenvironment for cancer therapy: a potential role of mesenchymal stem cells[J]. Expert Opin Ther Targets, 2012,16(10): 1041-1054.
[17]Ding Y, Liang WT, Hu X, et al. The sphere formation and tumorigenesis of different aldehyde dehydrogenase characteristic subsets in H22cells[J]. J Logist Univ CAPF(Med Sci), 2012,21(6): 424-427. [丁毅, 梁文涛, 胡鑫, 等. 小鼠肝癌H22细胞不同乙醛脱氢酶表达亚群的致瘤性分析[J].武警后勤学院学报(医学版), 2012, 21(6): 424-427.]
[18]Ma S, Chan KW, Hu L, et al. Identification and characterization of tumorigenic liver cancer stem/progenitor cells[J].Gastroenterology, 2007, 132(7): 2542-2556.
[19]Song W, Li H, Tao K, et al. Expression and clinical significance of the stem cell marker CD133in hepatocellular carcinoma[J]. Int J Clin Pract, 2008, 62(8): 1212-1218.
[20]Fang L, Zhang HB, Li H, et al. miR-548c-5p inhibits proliferation and migration and promotes apoptosis in CD90(+) HepG2cells[J]. Radiol Oncol, 2012, 46(3): 233-241.
[21]Tseng PL, Tai MH, Huang CC, et al. Overexpression of VEGF is associated with positive p53immunostaining in hepatocellular carcinoma (HCC) and adverse outcome of HCC patients[J]. J Surg Oncol, 2008, 98(5): 349-357.
[22]Inoue K, Torimura T, Nakamura T, et al. Vandetanib, an inhibitor of VEGF receptor-2and EGF receptor, suppresses tumor development and improves prognosis of liver cancer in mice[J].Clin Cancer Res, 2012, 18(14): 3924-3933.
[23]Chen X, Wang Y, Xia H, et al. Loss of E-cadherin promotes the growth, invasion and drug resistance of colorectal cancer cells and is associated with liver metastasis[J]. Mol Biol Rep, 2012,39(6): 6707-6714.
