两种肝脏全器官脱细胞基质制备方法的比较
2014-03-02王立曼王妍段翠密王海滨王常勇
王立曼,王妍,段翠密,王海滨,王常勇
肝移植是有效根治肝衰竭的方法,然而供体来源有限、费用昂贵等原因限制了肝移植的应用[1]。体外再造肝脏有望为肝衰竭的治疗提供新手段。近年来,基于全器官脱细胞-再细胞化策略的组织工程研究受到了越来越多的关注,发展异常迅速[2-6]。该策略的基础是制备肝脏全器官脱细胞基质支架材料,保留完整的脉管结构及细胞外基质(extracellu lar m atrix,ECM)成分,这是解决再造肝脏营养物质输送问题的关键[7-9]。研究人员相继利用十二烷基硫酸钠(sodium dodecylsu lfate,SDS)[10]、磷脂酶和脱氧胆酸钠[11]、不同浓度Triton X-100[12-14]成功获得脱细胞基质,但其洗脱方法均存在一定不足,如洗脱时间长、ECM破坏严重、生长因子大量丢失等[15]。此外,由于门静脉容易暴露、插管后不宜扭转,因此以往研究主要采用门静脉灌注的方法[9-13],但是门静脉的管壁较薄,插管后血管很容易破裂,造成洗涤剂外泄。Pan等[16]于2013年采用肝下下腔静脉灌注获得脱细胞基质,但肝下下腔静脉灌注为逆行灌注,不符合生理学特征,静脉瓣膜很可能对灌注带来阻力。目前为止尚未见采用肝动脉插管的报道。本研究采用肝动脉插管的方式,比较不同方法对细胞和核酸成分的去除情况,以及对ECM蛋白成分的影响,以期为筛选更为有效的肝脏全器官脱细胞基质制备方法提供依据。
1 材料与方法
1.1 实验动物及试剂 SD大鼠购于军事医学科学院动物中心,雌雄不限,体重200~300g。戊巴比妥钠、肝素钠(国药集团化学试剂有限公司);胰蛋白酶(Sigm a公司,美国);甲苯胺蓝染液(北京化工厂);Ⅳ型胶原抗体、纤连蛋白抗体和层黏连蛋白抗体(武汉博士德生物工程有限公司)。
1.2 肝脏全器官脱细胞基质的制备 SD大鼠腹腔注射2%戊巴比妥钠(30m g/kg)麻醉,十字切口打开腹腔,显露门静脉,注射器推注2m l肝素(100U/m l)抗凝。肝动脉行留置针固定,结扎门静脉、肝上下腔静脉,肝下下腔静脉用于洗脱液的外流。游离肝脏周围韧带,切断腔静脉,取出完整肝脏。SDS方案:肝脏-80℃冷冻24h后常温解冻,0.01m o l/L PBS灌注1h,1%SDS灌注3h,0.01m o l/L PBS冲洗24h。Tx(Triton X-100)+SDS方案:肝脏-80℃冷冻24h后常温解冻,以0.01m o l/L PBS灌注1h,1%Triton X-100灌注3h,超纯水冲洗15m in,0.1%SDS灌注2h,0.01m o l/L PBS冲洗24h。灌流速度均为3m l/m in。1.3 三维形态观察和甲苯胺蓝染色 大鼠肝脏脱细胞前后行大体观察。肝动脉灌流0.5%甲苯胺蓝染液,灌流速度0.1m l/m in,体式显微镜下观察脉管结构保留情况。
1.4 HE染色及免疫荧光染色 4%多聚甲醛固定脱细胞基质,梯度乙醇脱水,石蜡包埋、切片(厚3μm)、脱蜡后行HE染色。另取切片脱蜡,3%双氧水去除内源性过氧化物酶,修复,加1%牛血清白蛋白封闭,滴加Ⅳ型胶原、层黏连蛋白、纤连蛋白一抗,4℃过夜;0.01m o l/L PBS清洗3次,Ⅳ型胶原、层黏连蛋白滴加山羊抗小鼠IgG-FITC生物素化二抗(1:200),纤连蛋白滴加山羊抗小鼠IgG-Cy3生物素化二抗(1:200),37℃孵育20m in;0.01m o l/L PBS清洗3次,荧光显微镜下观察(DM IRB,Leica,德国)。
1.5 DNA含量检测 采用组织DNA基因组提取试剂盒(TIANGEN公司)提取天然组织和脱细胞基质DNA,采用核酸电泳仪(Bio-Rad,美国)进行琼脂糖凝胶电泳,Bio-Rad核酸蛋白测量仪(Bio-Rad Sm artspecTMPlus,北京赛百奥科技公司)进行定量分析。
1.6 生长因子检测 采用大鼠肝细胞生长因子(HGF)ELISA试剂盒、大鼠碱性成纤维细胞生长因子(b FGF)ELISA试剂盒(上海BLUEGENE生物科技有限公司)检测HGF、b FGF含量。分别称取100m g左右正常肝脏组织和脱细胞基质,匀浆后取上清,设置空白对照组、标准品组、样品组,具体操作按试剂盒说明书进行。测量450nm波长处各孔吸光度(A)值,计算HGF、b FGF含量。
1.7 胶原含量检测 采用酸水解法测定羟脯氨酸含量以反映组织中的胶原含量。制备样品处理液:称取30m g左右的正常肝脏组织和脱细胞基质,于安瓿瓶中加6m o l/L HCl,酒精灯火焰封口后110℃水解24h,然后调节pH至6.5~7.0。制备羟脯氨酸储备液(1m g/m l),并稀释成梯度浓度标准液(0、2、4、6、8、10μg/m l)。分别取标准液和样品处理液0.5m l,依次加入2m l正丙醇和0.5m l氯胺T试剂,室温放置25m in,然后加入0.5m l恩克里试剂,混匀后65℃水浴20m in。冷却后560nm下测量A值,计算胶原蛋白含量。
1.8 统计学处理 采用SPSS 16.0软件进行分析。计量资料以±s表示,多组间均数比较采用方差分析,进一步两两比较采用Studen t t检验,P<0.05为差异有统计学意义。
2 结 果
2.1 三维形态观察和甲苯胺蓝染色结果 肝脏经两种灌注方法洗脱后,外形结构保持良好,期间逐渐变白并透明化(图1)。肝脏脱细胞基质包膜结构完整,透过肝包膜可以清晰地看到脉管结构。甲苯胺蓝染色显示,SDS方案脱细胞化会对脉管壁造成损害,灌入的染液外泄,而Tx+SDS方案保持了脉管结构的完整性,染液从血管根部一直流向血管分支(图2)。
2.2 组织学检测结果 HE染色未见明显的细胞及细胞成分,肝脏全器官脱细胞基质呈网状结构(图3)。免疫荧光染色显示两种脱细胞方法均能很好地移除细胞核成分,并能保留ECM成分(图4)。SDS方案得到的支架纤维结构松散,网络结构遭到不同程度破坏,未见完整的脉管系统,Tx+SDS方案保留了完好的ECM网状结构,脉管系统保留完整(图3、4)。
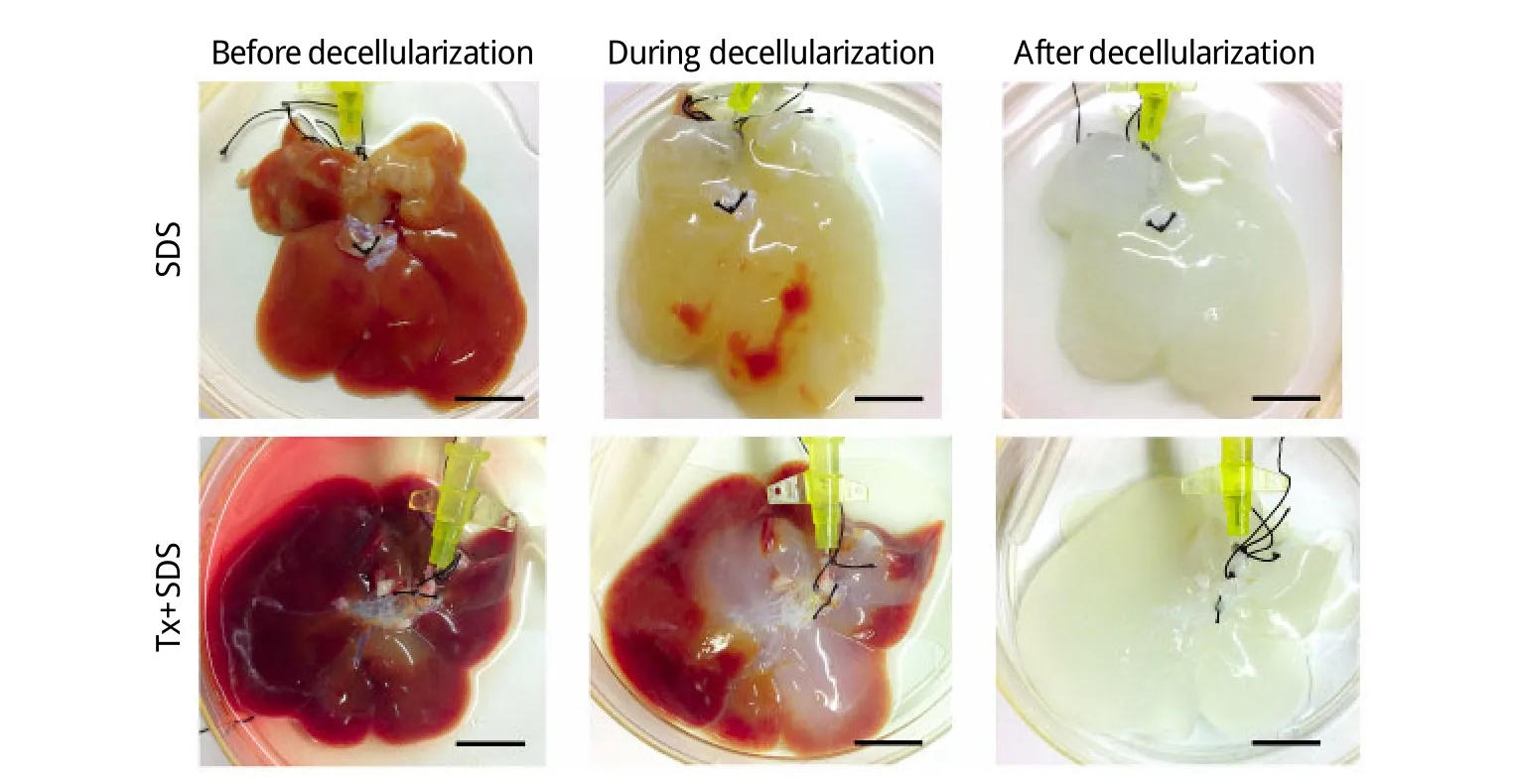
图1 肝脏全器官脱细胞基质制备过程(Bar=10mm)Fig. 1 Decellu larization fo r p reparing liver w ho le-o rgan dece llu larized m atrix (Bar=10mm)
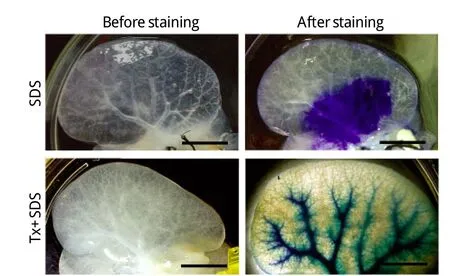
图2 肝脏脱细胞基质甲苯胺蓝染色(Bar=10mm)Fig. 2 Toluidine blue staining of liver whole-organ decellularized m atrix (Bar=10mm)
2.3 DNA含量 正常肝脏组织中DNA含量为2955.0±138.1μg/g,SDS方案脱细胞基质中DNA含量为47.4±3.0μg/g,为正常组织的1.60%,Tx+SDS方案脱细胞基质中DNA含量为46.8±4.3μg/g,为正常组织的1.58%。统计学分析显示,两种方案脱细胞基质中DNA含量均明显低于正常肝脏组织,差异有统计学意义(P<0.05)。琼脂糖凝胶电泳未见脱细胞基质中有明显的DNA片段(图5)。
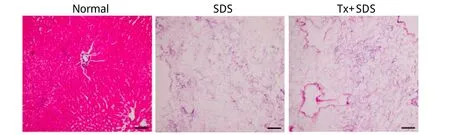
图3 正常肝脏及肝脏全器官脱细胞基质HE染色(Bar=100μm)Fig. 3 HE staining of no rm al liver and liver w ho le-o rgan dece llu larized m atrix (Bar=100μm)
2.4 ECM中胶原及HGF、b FGF的含量 SDS方案脱细胞基质中胶原含量为4.23±0.05μg/m g,明显低于正常组织中的胶原含量(7.54±0.11μg/m g,P<0.05),表明SDS脱细胞方法会破坏ECM胶原蛋白成分;Tx+SDS方案脱细胞基质中胶原含量为7.76±0.15μg/m g,与正常组织比较差异无统计学意义(P>0.05),表明Tx+SDS方案能够很好地保留胶原蛋白成分。SDS方案脱细胞基质中HGF含量为11.3±1.8ng/g,明显低于Tx+SDS方案(44.5±2.9ng/g)及正常组织(76.1±4.1ng/g),且Tx+SDS方案脱细胞基质中HGF含量明显低于正常组织,差异有统计学意义(P<0.05)。SDS方案脱细胞基质中b FGF含量为6.1±0.7ng/g,明显低于Tx+SDS方案(15.9±0.4ng/g)及正常组织(37.6±3.3ng/g),且Tx+SDS方案脱细胞基质中b FGF含量明显低于正常组织,差异有统计学意义(P<0.05)。
3 讨 论
本研究采用SDS及Tx+SDS方案进行洗脱,均可见肝脏逐步变得透明,但三维结构保持不变。HE染色、免疫荧光染色均未见细胞及细胞核残留,DNA含量分别减少至天然组织的1.60%和1.58%,表明两种方案制备的肝脏全器官脱细胞基质符合脱细胞标准[17],证实了肝动脉插管的可行性及两种脱细胞方法的有效性。但是两种方法的脱细胞化效果不尽相同:甲苯胺蓝、免疫荧光及胶原定量检测结果表明,SDS方案对ECM成分破坏较大,纤维结构松散,脉管结构不完整,而Tx+SDS方案对ECM成分破坏则较小,维持了肝脏天然的ECM成分和脉管结构。此外,ELISA检测结果显示,相对于SDS方案,Tx+SDS方案可以保留更多的ECM及生长因子成分。
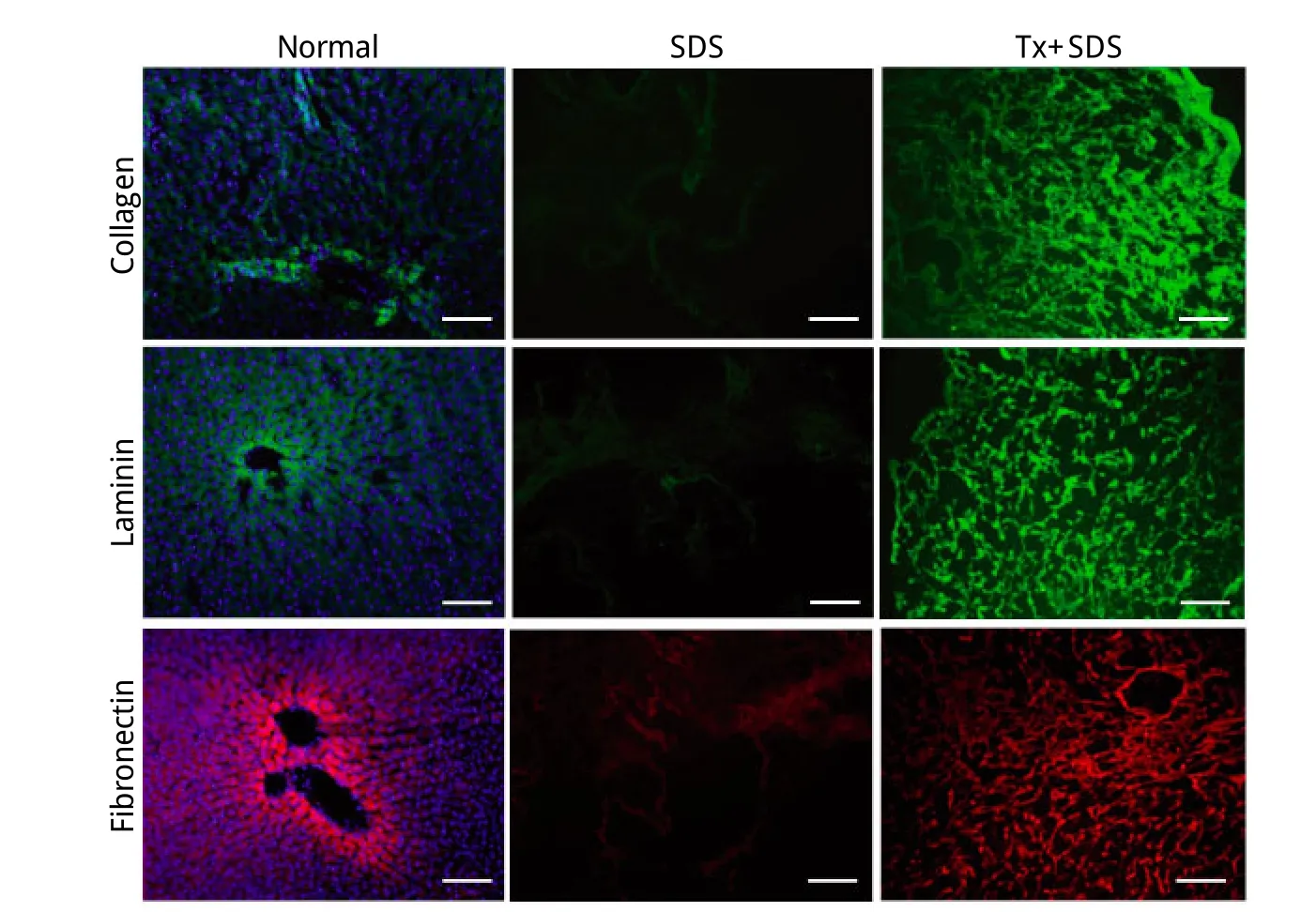
图4 正常肝脏及肝脏全器官脱细胞基质免疫荧光(Bar=100μm)Fig. 4 Imm unefluo rescence of no rm al liver and liver w ho le-o rgan decellu larized m atrix (Bar=100μm)
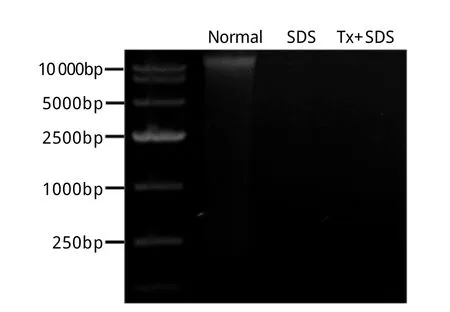
图5 肝脏全器官脱细胞基质DNA含量检测Fig. 5 Determ ination of DNA content of liver w hole-organ decellu larized m atrix
本研究采用的脱细胞方法结合了物理法和化学法。冻融法是常用的物理脱细胞方法,在冰冻过程中,溶液会形成冰晶,细胞内的小冰晶可胀破细胞膜,有效地破坏细胞结构,但是必需联合其他方法来清除细胞成分。SDS是广泛使用的离子洗涤剂,能溶解细胞质、细胞核和细胞膜,可高效清除细胞核和细胞质内蛋白残留。本研究中SDS方案有效清除了细胞成分,但ECM成分也遭到了严重破坏,这可能是由于SDS破坏了蛋白之间的联系,使蛋白发生变性,导致纤维结构松散。Triton X-100是一种温和的非离子洗涤剂,能够与生物膜中的磷脂等脂质结合形成可溶性复合物,破坏生物膜,它打破了脂质之间和脂质与蛋白间的联系,但保留了蛋白与蛋白之间的联系,因此,以Triton X-100为主要洗涤剂的脱细胞方案能够更好地保护肝脏超微结构和ECM蛋白成分。但单纯的Triton X-100过于温和,洗脱不完全,因此我们结合SDS进一步洗脱以完全去除细胞残留成分,SDS的浓度控制在0.1%,既能发挥很好的洗脱作用,又能较好地保留ECM蛋白[18]。
总体来说,通过Tx+SDS方案制备肝脏全器官脱细胞基质能够更好地保留肝脏三维结构和ECM蛋白成分,维持肝脏ECM的力学、生物学特性,为基于肝脏全器官脱细胞-再细胞化策略的肝脏再造提供了优良的肝脏全器官脱细胞基质材料,有望成为临床上移植供肝的重要来源之一。
[1] So ltys KA, So to-Gu tierrez A, Nagaya M, et al. Barriers to the successfu l treatm en t of liver d isease by hepatocyte transp lan tation[J]. J Hepato l, 2010, 53(4): 769-774.
[2] Badylak SF, Taylor D, Uygun K. Whole-organ tissue engineering:decellu larization and recellu larization of three-dim ensional m atrix scaffo lds[J]. Annu Rev Biom ed Eng, 2011, 13: 27-53.
[3] Ott HC, Matthiesen TS, Goh SK, et al. Perfusion-decellu larized m atrix: using nature's p latform to engineer a bioartificial heart[J]. Nat Med, 2008, 14(2): 213-221.
[4] Petersen TH, Calle EA, Zhao L, et al. Tissue-engineered lungs for in vivo im p lantation[J]. Science, 2010, 329(5991): 538-541.
[5] Song JJ, Guyette JP, Gilp in SE, et al. Regeneration and experim ental orthotopic transp lan tation of a bioengineered kidney[J]. Nat Med, 2013, 19(5): 646-651.
[6] Shupe T, W illiam s M, Brow n A, et al. Me thod fo r the decellu larization of in tact rat liver[J]. Organogenesis, 2010,6(2): 134-136.
[7] Badylak SF. The extracellu lar m atrix as a scaffo ld for tissue reconstruction[J]. Sem in Cell Dev Bio l, 2002, 13(5): 377-383.
[8] Gilbert TW, Sellaro TL, Badylak SF. Decellu larization of tissues and o rgans[J]. Biom aterials, 2006, 27(19): 3675-3683.
[9] Traverse JH. Using biom aterials to im p rove the efficacy of cell therapy follow ing acute m yocardial in farction[J]. J Cardiovasc Transl Res, 2012, 5(1): 67-72.
[10] Uygun BE, Soto-Gutierrez A, Yagi H, et al. Organ reengineering through developm ent of a transplantab le recellularized liver graft using decellu larized liver m atrix[J]. Nat Med, 2010, 16(7): 814-820.
[11] Wang YF, Cui CB, Yam auchi M, et al. Lineage restriction of hum an hepatic stem cells to m ature fates is m ade efficient by tissue-specific biom atrix scaffo lds[J]. Hepatology, 2011, 53(1):293-305.
[12] Shirakigaw a N, Takei T, Ijim a H. Base structure consisting of an endothelialized vascular-tree network and hepatocytes for whole liver engineering[J]. J Biosci Bioeng, 2013, 116(6): 740-745.
[13] So to-Gu tierrez A, Zhang L, Medberry C, et al. A w ho le-organ regenerative m edicine app roach for liver rep lacem ent[J]. Tissue Eng Part C Methods, 2011, 17(6): 677-686.
[14] Zhou P, LessaN, Estrada DC, et al. Decellu larized liver m atrix as a carrier for the transp lantation of hum an fetal and p rim ary hepatocytes in mice[J]. Liver Transp lant, 2011, 17(4): 418-427.
[15] Woods T, Gratzer PF. Effectiveness of th ree extraction techniques in the developm ent of a decellularized bone-anterior cruciate ligam ent-bone g raft[J]. Biom aterials, 2005, 26(35):7339-7349.
[16] Pan MX, Hu PY, Cheng Y, et al. An e fficien t m ethod fo r decellu larization of the rat liver[J]. J Form os Med Assoc, 2013.[Epub ahead of p rin t]
[17] Crapo PM, Gilbert TW, Badylak SF. An overview of tissue and whole organ decellularization p rocesses[J]. Biom aterials, 2011,32(12): 3233-3243.
[18] Arenas-Herrera JE, Ko I K, Atala A. Decellu larization for w ho le organ bioengineering[J]. Biom ed Mater, 2013, 8(1):014106.
