生物玻璃条索修复骨缺损的有效性研究
2014-03-02樊博王臻吴畅刘冬高鹏肖鑫张浩强黄海
樊博,王臻,吴畅,刘冬,高鹏,肖鑫,张浩强,黄海
作为骨组织工程的重要组成部分,骨移植材料修复骨缺损的能力受到了众多学者的关注,尤其是移植材料的生物相容性、成骨能力以及降解性能更是当前研究的重点和热点[1-3]。大量研究显示,生物活性玻璃45S5不仅具有良好的生物相容性、成骨能力和降解性能[4-7],而且具有促进血管生成的能力[8-9]。β-磷酸三钙(β-TCP)生物陶瓷修复骨缺损已有大量文献报道[10-13],具有良好的骨诱导、骨传导能力及促血管化作用。胶原蛋白作为骨的重要组成部分,在止血、填充组织缺损以及作为组织工程支架促进组织愈合方面发挥着重要作用[14-17]。另有研究发现Ⅰ型胶原蛋白对骨的矿化作用有着重要影响[18-20]。本研究拟将含有Ⅰ型胶原的新型生物活性骨移植材料植入兔股骨髁缺损处,并通过大体观察、Lane-Sandhu X线评分及组织学染色分析其成骨能力和降解性能,旨在为其进一步应用于临床提供理论依据。
1 材料与方法
1.1 实验动物 健康成年新西兰大白兔18只,均为雌性,6~8月龄,体重2.5~3.5kg,平均2.85kg,购自西安迪乐普生物资源开发有限公司,许可证号SCXK(陕)2006-001。实验过程中对动物的处置符合科技部2006年发布的《关于善待实验动物的指导性意见》。
1.2 实验材料 胶原生物玻璃条索(No vaBon e collagen bioactive glass strips)由牛皮提取的高纯度Ⅰ型胶原和直径32~2500μm的45S5生物玻璃按1.5:8.5比例制作,为直径0.5cm、高1.0cm的圆柱体。胶原生物玻璃颗粒(NovaBone co llagen bioactive g lass m o rsels)的组成成分和比例与胶原生物玻璃条索相同,但其形态为胶原纤维和玻璃颗粒混合的粉末状。含Ⅰ型胶原的β-TCP颗粒由牛皮提取的高纯度Ⅰ型胶原和颗粒大小多变的β-TCP颗粒按1:4比例制作,为大小不等的具有生物活性的颗粒。以上3种材料均由美国诺邦生物制品有限公司提供。
1.3 手术方法及分组 按缺损部位植入的材料不同,实验分为3组,即A组(自体骨髓+胶原生物玻璃条索)、B组(自体骨髓+胶原生物玻璃颗粒)、C组(自体骨髓+含Ⅰ型胶原的β-TCP颗粒),每组6只兔(12个股骨髁)。所有实验动物均在术前24h禁水禁食,肌注陆眠宁Ⅱ(吉林省华牧动物保健品有限公司)0.5m l/kg进行麻醉,取兔股骨下端膝关节外侧切口,逐层切开,直至暴露股骨外侧髁。使用高速磨钻(北京天和)在股骨髁松质骨部建立直径为6mm,深12mm的腔隙性骨缺损模型,纱布压迫止血,并清理残余骨碎屑。利用骨穿针在同侧胫骨近端穿刺抽取骨髓液1.5~2.0m l,将抽取出的骨髓液与植入材料充分混合,立即植入骨缺损处,逐层关闭切口。术后双侧下肢不予固定,连续3d肌内注射硫酸庆大霉素4万U/d,定期观察动物一般情况。按照实验分组结果,术后6周和12周每组分别随机处死3只动物,在骨缺损上方截取股骨髁,立即置于10%甲醛液中固定7d,用于后续检测分析。
1.4 检测指标
1.4.1 动物一般情况观察 主要包括术后恢复情况,饮食以及二便情况,对外界刺激的反应程度等。
1.4.2 大体观察 术后6、12周取材时,观察切口,评价愈合情况;观察缺损周围是否有炎性包块,缺损部位是否愈合,以及是否有异常的骨破坏和畸形愈合;观察膝关节内有无炎性积液,有无材料漏出。
1.4.3 X线分析 术后6周和12周取到的股骨髁标本分别拍摄正、侧位X线片,采用Lane-Sandhu X线评分标准[21]对侧位照片进行成骨情况评分。
1.4.4 硬组织切片检测 将在10%甲醛溶液中固定7d的标本取出,沿与股骨长轴平行方向均分为两半,一半置于-20℃冰箱内保存,另一半用于硬组织切片观察。将标本置于梯度乙醇(70%、90%、100%)中进行脱水,随后置于浸塑液Ⅰ、浸塑液Ⅱ、浸塑液Ⅲ中各10d,然后用聚丙烯酸甲酯(PMMA)包埋,SHANDON真空抽吸机抽吸6h后,置于50℃水浴锅中加热48h,直至PMMA凝固,取出包埋好的标本,使用Leica-SP 1600型硬组织锯式旋转切片机(Leica公司,德国)平行于标本的中切面进行切片,厚约180μm。将修剪好的切片粘贴于树脂载玻片上,待其晾干后置于玻璃板下将切片压平,随后将切片置于RF-1型硬组织切片研磨机(西安瑞丰仪器设备有限责任公司)上用1500目砂纸进行磨片,直至切片厚度约70μm,再用齿科抛光打磨机(西安泛亚医疗器械有限责任公司)对切片进行抛光,直至光学显微镜下观察不到划痕。随后将所有切片进行Van-Gieson(VG)染色,在全自动光学显微镜(Leica LA型,Leica公司,德国)下观察骨缺损区成骨情况、材料降解情况以及是否有炎性细胞聚集等。应用View finder Version 3.0.1(Pixera公司,美国)软件观察并采集照片,Im age-Pro Plus 6.0图像分析软件(Med ia Cybernetics公司,美国)计算切片中新生骨和剩余材料占骨缺损区域面积的百分比。
2 结 果
2.1 一般情况 所有动物术后恢复良好,无脱线及明显感染现象;进食良好,二便无异常;对外界刺激反应灵敏,活动正常,与未手术动物相比无明显差别。
2.2 大体观察 各组动物伤口愈合情况良好,未见红肿、渗出及坏死现象,均为一期愈合。骨缺损周围未见异常炎性纤维包块,未发现额外的骨破坏以及畸形愈合。膝关节腔内无明显积液,滑膜光滑平整,未发现漏出的材料颗粒。6周时肉眼尚可辨别缺损处材料与周围骨组织的界线,12周时缺损处材料与周围骨组织融合良好,肉眼难以区分其界线。
2.3 X线分析 从拍摄的X线片上可以观察到6周时A组材料已经部分吸收且伴有毛玻璃样的新骨生成,新生骨与周围骨组织分界线模糊,但是缺损区的材料密度与周围骨组织仍不一致;B组材料也可观察到少量吸收现象,材料边界和内部结构不清晰,与A组相比,其材料与周围骨组织密度差异更大;C组缺损部位材料无明显降解吸收,材料清晰可见,与周围骨组织的分界线清楚,成骨现象不明显(图1)。侧位片Lane-Sandhu X线评分显示,A组评分高于B组和C组(P<0.05),且B组的评分高于C组(P<0.05,表1)。12周时,A组缺损区已经基本无剩余材料,密度与周围骨质接近,可观察到疑似骨髓腔部分再通现象;B组材料已经大部分被吸收,转而以新生骨替代,可见疑似骨髓腔部分重建现象;C组材料与周围骨组织界线已经模糊,内部密度不均匀,与周围骨质有融合(图1)。侧位片Lane-Sandhu X线评分结果表明,A组评分高于B组和C组(P<0.05),且B组评分高于C组(P<0.05)。与6周时比较,12周时3组评分均明显增高(P<0.01,表1)。
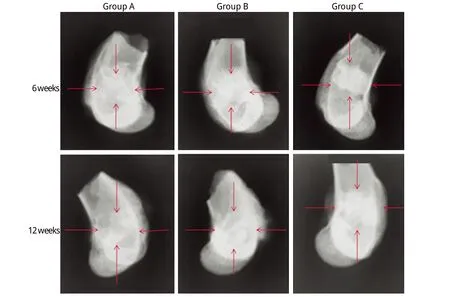
图1 3种材料植入后的6周和12周侧位X线片Fig. 1 Lateral X-ray p ictu re of 6th and 12th w eek after insertion of the new b ioactive m aterialArrow s ind icate the areas of m ateria ls' insertion
表1 各组骨生成及重塑情况的Lane-Sandhu X线评分结果(±s,n=6)Tab. 1 Lane-Sandhu X-ray sco res of osteogenesis and rem ode ling in each g roup (±s, n=6)
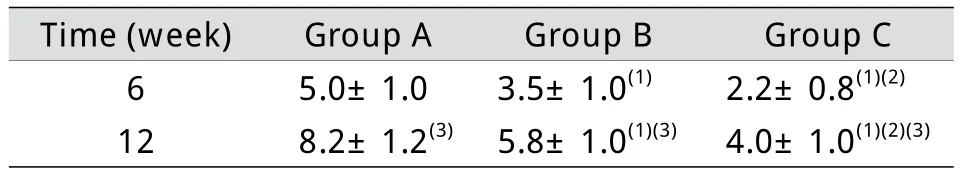
表1 各组骨生成及重塑情况的Lane-Sandhu X线评分结果(±s,n=6)Tab. 1 Lane-Sandhu X-ray sco res of osteogenesis and rem ode ling in each g roup (±s, n=6)
(1)P<0.05 com pared with group A; (2)P<0.05 com pared with g roup B; (3)P<0.01 com pared with 6 w eeks
Tim e (w eek) Group A Group B Group C 6 5.0±1.0 3.5±1.0(1) 2.2±0.8(1)(2)12 8.2±1.2(3) 5.8±1.0(1)(3) 4.0±1.0(1)(2)(3)
2.4 组织学观察结果 各组光学显微镜下观察均未见明显炎症细胞聚集或吞噬细胞出现。6周时3组均可见材料有所降解,残余材料周围环绕着新生骨组织,并伴有类骨质的结晶层形成,表明成骨过程是由材料周边逐渐向中心移行的(图2)。图像分析显示,A组和B组新生骨组织与骨缺损区域的面积比(分别为17.1%±1.0%、14.5%±1.3%)明显高于C组(10.5%±1.3%,P<0.01),且A组明显高于B组(P<0.01);A组和B组残余材料与骨缺损区域的面积比(分别为21.1%±0.8%、24.1%±1.8%)明显低于C组(32.9%±0.9%,P<0.01),且A组明显低于B组(P<0.01)。12周时,伴随着材料的逐步降解,3组新生骨组织进一步增多,可观察到成熟骨小梁的形成,与6周时相比骨小梁板层增粗变大(图2)。图像分析显示,A组和B组新生骨组织与骨缺损区域的面积比(分别为23.8%±1.1%、20.3%±1.1%)高于C组(15.9%±1.2%,P<0.01),且A组明显高于B组(P<0.01);A组和B组残余材料与骨缺损区域的面积比(分别为12.0%±1.0%、15.1%±1.4%)明显低于于C组(19.7%±1.3%,P<0.01),且A组明显低于B组(P<0.01)。与6周时比较,12周时3组新生骨量均明显增加(P<0.01),残余材料明显减少(P<0.01)。
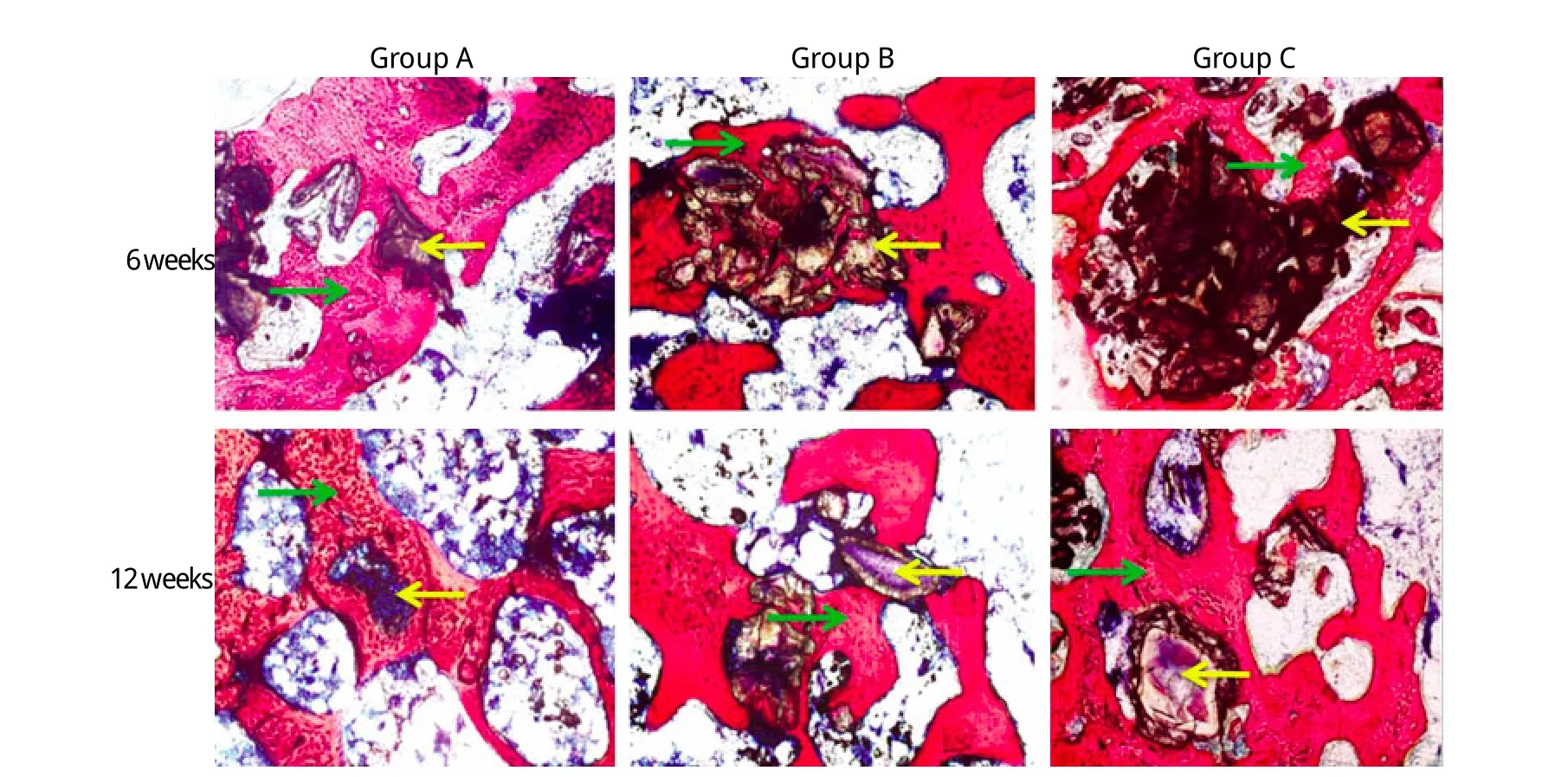
图2 术后6周及12周组织学观察结果(VG染色 ×100)Fig. 2 Histo log ical im ages of rabb it fem u r 6th and 12th w eek after insertion of m aterials (VG stain ing ×100)Green arrow ind icates the new bone and ye llow arrow ind icates the excess g ra ft
3 讨 论
外伤、肿瘤及整形外科手术等原因均可导致骨组织缺损、功能丧失。为满足修复治疗的需要,研究者探索了多种修复骨组织缺损的方法,经历了自体移植、同种异体移植、异种移植、人工组织代用品及组织化人工骨等几个阶段。自体骨移植效果虽好,但自体供骨量严重不足,无法满足较大骨缺损的修复要求。异体骨、异种骨的免疫排斥反应等问题目前仍未彻底解决[22-23]。各种骨替代材料在生物学和力学方面仍有许多缺陷[24],已在临床应用的一些人工骨材料尚存在不能吸收及爬行替代等问题。骨替代材料成分的不同影响着骨缺损的修复效应,而选择一种更有利于成骨的生物活性材料是当前亟待解决的问题。
本研究将Ⅰ型胶原纤维分别与生物活性玻璃以及β-磷酸三钙按一定比例组成不同三维形态的成骨相关材料,并观察其修复骨缺损的能力和降解性能,结果发现Ⅰ型胶原不仅具有低免疫原性和良好的生物相容性,还可促进骨的修复重建[25-27]。本研究结果显示,3种包含Ⅰ型胶原的新型生物活性材料均具有良好的生物相容性,骨缺损区域未发现排异的炎性反应,材料与周围骨组织能够完全融合,结合紧密。术后6周和12周的X线片及组织学切片分析表明,在成骨能力方面胶原生物玻璃条索>胶原生物玻璃颗粒>含Ⅰ型胶原的β-TCP(P<0.05),而材料的降解性能也与成骨能力相一致,即胶原生物玻璃条索>胶原生物玻璃颗粒>含Ⅰ型胶原的β-TCP(P<0.05)。这可能是由于胶原生物玻璃材料中Ⅰ型胶原与45S5的比例更适合新生骨的爬行替代,以及生物玻璃的颗粒直径(32~2500μm)相对于大小不定的β-TCP来说具有更好的生物活性。此外,可能由于胶原生物玻璃颗粒中Ⅰ型胶原与45S5颗粒结合不够紧密,致使胶原过早过快降解,导致骨缺损区出现大量空洞,从而使剩余的材料不能充分与周围骨组织接触,最终影响到其成骨和剩余材料的降解。本实验结果还间接证实胶原生物玻璃条索材料的降解与骨组织的再生填充是同步的,可避免材料降解过快而骨组织生长缓慢导致的缺损不愈合的发生。
因此,在生物活性骨替代材料的制备过程中,不仅要考虑选用什么样的材质,还要考虑到材料的三维形态。本研究结果表明胶原生物玻璃条索在成骨能力和降解性能方面优于其他两种材料,提示其可作为一种新型的生物活性骨移植材料,为进一步深入研究奠定了基础。
[1] Raham an MN, Day DE, Sonny Bal B, et al. Bioactive g lass in tissue engineering[J]. Acta Biom ater, 2011, 7(6): 2355-2373.
[2] Karageorgiou V, Kap lan D. Porosity of 3D biom aterial scaffo lds and osteogenesis[J]. Biom aterials, 2005, 26(27): 5474-5491.
[3] Van der Stok J, Van Lieshout EM, El-Massoud i Y, et al. Bone substitutes in the Netherlands-a system atic literature review[J].Acta Biom ater, 2011, 7(2): 739-750.
[4] Go ru sto v ich AA, Ste im e tz T, Cab rin i RL, et a l.Osteoconductivity of strontium-doped bioactive g lass particles:A histom orphom etric study in rats[J]. J Biom ed Mater Res A,2010, 92(1): 232-237.
[5] Fu Q, Huang Wh, Jia W t, et al. Three-dim ensional visualization of bioactive g lass-bone integration in a rabbit tibia m odel using synchrotron X-ray m icrocom puted tom ography[J]. Tissue Eng Part A, 2011, 17(23-24): 3077-3084.
[6] San M igue l B, Kriauciunas R, Tosatti S, et al. Enhanced osteob lastic activity and bone regeneration using su rfacem odified porous bioactive g lass scaffo ld[J]. J Biom ed Mater Res A, 2010, 94(4): 1023-1033.
[7] Huang H, Wang Z. An ti-in flamm ato ry and osteogenesis of com plex particles com posed of ceric oxide and bioglass on repair of rabbit fem oral defects[J]. Med J Chin PLA, 2011, 36(2): 130-132. [黄海, 王臻. 二氧化铈复合生物玻璃颗粒在兔股骨缺损修复中的抗炎及成骨作用观察[J]. 解放军医学杂志,2011, 36(2): 130-132.]
[8] Leu A, Leach JK. Proangiogenic potential of a collagen/bioactive g lass substrate[J]. Pharm Res, 2008, 25(5): 1222-1229.
[9] Gorustovich A, Roether J, Boccaccini AR. Effect of bioactive g lasses on ang iogenesis: A review of in vitro and in vivo evidences[J]. Tissue Eng Part B Rev, 2010, 16(2): 199-207.
[10] Wang C, Wang Z, Li A, et al. Repair of segm ental bone-defect of goat's tibia using a dynam ic perfusion culture tissue engineering bone[J]. J Biom ed Mater Res A, 2010, 92(3): 1145-1153.
[11] Bai F, Wang Z, Lu J, et al. The correlation between the internal structure and vascularization of controllab le porous bioceram ic m aterials in vivo: a quan titative study[J]. Tissue Eng Part A,2010, 16(12): 3791-3803.
[12] Bai F, Jinkang Z, Wang Z, et al. The effect of pore size on tissue ingrow th and neovascu larization in porous bioceram ics of con tro lled architecture in vivo[J]. Biom ed Mater, 2011, 6(1):015007.
[13] Lv XF, Peng C, Lai HC, et al. An experim en tal study on the resto rative effect of coralline hyd roxyapatite versus betatricalcium phosphate filled the bone defects around im plants[J].Tian jin Med J, 2012, 40(10): 1026-1029.[吕晓飞, 彭诚, 赖红昌, 等. 珊瑚羟基磷灰石与β-磷酸三钙用于修复种植体周骨缺损的研究[J]. 天津医药, 2012, 40(10): 1026-1029.]
[14] Kanatani I, Kanem atsu A, Inatsugu Y, et al. Fab rication of an op tim al urethral graft using co llagen-sponge tubes rein forced with copoly(L-lactide-cap ro lactone) fabric[J]. Tissue Eng, 2007,13(12): 2933-2940.
[15] Ou XR, Jian XC, Lin G. An investigation of resto ration of alveo lar cleft withengineered bone[J]. Chin J Plast Surg, 2007,23(1): 1994-1996.[欧新荣, 翦新春, 林戈. 组织工程骨修复牙槽嵴裂的实验研究[J]. 中华整形外科杂志, 2007, 23(1):1994-1996.]
[16] Bu tle r DL, Gooch C, Kinneberg KR, et al. The use of m esenchym al stem cells in collagen-based scaffo lds for tissueengineered repair of tendons[J]. Nat Protoc, 2010, 5(5): 849-863.
[17] Zhu XQ, Xing SZ, Yang B, et al. An experim en tal study on co llagen sponge p rom oting bone form ation in teeth socket[J].Chin J Oral Maxillofac Surg, 2011, 9(3): 208-211. [朱晓琴, 邢树忠, 杨波, 等. 胶原蛋白海绵促进牙槽窝早期骨愈合的实验研究[J]. 中国口腔颌面外科杂志, 2011, 9(3): 208-211.][18] Tsu ruoka N, Yam ato R, Sakai Y, et al. Prom otion by co llagen tripep tide of type I co llagen gene exp ression in hum an osteob lastic cells and fracture healing of rat fem u r[J]. Biosci Bio techno l Biochem, 2007, 71(11): 2680-2687.
[19] Liebscher MA. Biom im etic considerations of anim al m odels used in tissueengineering of bone[J]. Biom aterials, 2004, 25(9):1697-1714.
[20] Fan H, Chen ZQ. Effect of com posite of chond roitine su lfate A and type I co llagen on the com bination of bone and pu re titanium im p lant[J]. Tian jin Med J, 2009, 37(7): 595-596.[樊洪,陈治清. 硫酸软骨素A与Ⅰ型胶原复合材料对纯钛种植体骨结合的影响[J]. 天津医药, 2009, 37(7): 595-596.]
[21] Lane JM, Scandhu HS. Current approaches to experim ental bone g rafting[J]. Orthop Clin No rth Am, 1987, 18(2): 213-215.
[22] Banw art JC, Asher MA, Hassanein RS. Iliac crest bone g raft harvest donor site m orbidity. A statistical evaluation[J]. Sp ine,1995, 20(91): 1055-1060.
[23] Parikh SN. Bone g raft substitu tes: past, p resen t, futu re[J]. J Postg rad Med, 2002, 48(2): 142-148.
[24] Lau rencin CT, El-Am in SF, Ib im SE, et al. A high ly po rous 3-d im ensional po lyphosphazene po lym er m atrix for skeletal tissue regeneration[J]. J Biom ed Mater Res, 1996, 30(2): 133-138.
[25] Mackie EJ. Osteob lasts: novel roles in orehestration of skeletal architectu re[J]. In t J Bioehem Cell Bio l, 2003, 35(9): 1301-1305.
[26] Gungorm us M. The effect on osteogenesis of type I co llagen app lied to experim ental bone defects[J]. Dent Traum atol, 2004,20(6): 334-337.
[27] Gungorm us M, Kaya O. Evaluation of the effect of hetero logous type I co llagen on healing of bone defects[J]. Oral Maxillofacial Su rg, 2002, 60(5): 541-545.
