三氧化二砷影响人骨肉瘤细胞自噬现象的实验研究
2014-02-14梁伟民郭卫燕太强杨荣利
梁伟民 郭卫 燕太强 杨荣利
三氧化二砷影响人骨肉瘤细胞自噬现象的实验研究
梁伟民 郭卫 燕太强 杨荣利
目的探讨三氧化二砷( AS2O3)对人骨肉瘤细胞( HOS,MG63 )自噬现象的影响。方法用MTT 法观察 AS2O3对 HOS、MG63 细胞活力的作用;用透射电镜、免疫荧光染色、Western blot 检测 HOS、MG63 细胞基础自噬以及 AS2O3诱导细胞自噬的情况。结果透射电镜、免疫荧光染色、Western blot 结果显示 MG63 基础自噬水平明显高于 HOS( P<0.01 );AS2O3抑制 MG63 细胞活力的 IC50值 15.42 μmol / L 明显大于AS2O3抑制 HOS 细胞的活力的 IC50值 1.067 μmol / L,多耐药株 MG63 较 HOS 对 AS2O3耐药;检测 LC3-II 及PARP 蛋白的表达水平发现,随着 HOS 自噬水平的增加,HOS 的凋亡逐渐增加,而 AS2O3通过促进 MG63 的保护性自噬延缓了凋亡的发生。结论AS2O3可引起骨肉瘤细胞自噬,对不同的骨肉瘤细胞自噬的影响各不相同。对于化疗耐药的骨肉瘤细胞 MG63,AS2O3诱导的自噬是保护性自噬,自噬延缓了凋亡的发生;而对于化疗敏感的 HOS 细胞,AS2O3诱导的自噬促进了凋亡的发生。
自噬;骨肉瘤;细胞系,肿瘤;三氧化二砷
骨肉瘤是青少年最常见的原发恶性骨肿瘤,目前采取“术前化疗+手术+术后化疗”的综合治疗方法,5 年生存率由过去的不足 20% 提高到目前的60%~70%[1]。然而化疗药物的多药耐药( multidrug resistance,MDR )使得骨肉瘤容易复发和转移,严重影响了其临床疗效和骨肉瘤患者的长期生存率[2]。三氧化二砷( AS2O3)最早在治疗急性早幼粒白血病中取得了巨大进展,目前已作为治疗 III 期骨肉瘤的化疗药物,并取得了较好的短期疗效[3]。由于 AS2O3耐药,从而会影响治疗效果。真核细胞中存在两种蛋白降解途径:一种是通过蛋白酶体降解;另一种是通过细胞自噬的溶酶体降解。细胞成份更新、保持正常的生理状态都依赖于细胞自噬的发生,自噬可以作为保护肿瘤细胞产生化疗耐药的生存机制[4]。自噬是一种在细胞中普遍存在的生命现象,化疗药物在诱导肿瘤细胞凋亡的同时,也能诱导细胞自噬,自噬既能作为保护肿瘤细胞产生化疗耐药的生存机制,也能与凋亡共同参与诱导肿瘤细胞死亡[5]。因此,我们通过两种骨肉瘤细胞系 HOS( 化疗敏感株 )和 MG63( 多耐药株 )来研究AS2O3对人骨肉瘤细胞自噬现象的作用。
资料与方法
一、细胞、试剂及抗体
MG63 及 HOS 细胞系均购自美国 ATCC 公司;RPMI-DMEM 培养液胎牛血清购自美国 HyClone公司;噻唑蓝购自上海碧云天生物技术研究所;AS2O3、Anti-LC3 抗体、Anti-P62 抗体购自 Sigma 公司;Anti-PARP 购自 Cell Signaling 公司;VDF 5 膜购自 Amersham 公司;发光液购自 Thermo 公司。
二、仪器设备
电子显微镜( Hitachi 公司,日本 )、CO2细胞培养箱( NUAIRE 公司,美国 )、Mini Trans-Blot 电转仪( Bio-RAD 公司,美国 )、AE-65009 型电泳槽( ATTO 公司,日本 )、恒压恒流电泳仪( JY600C,JUNYI 公司 )。
三、方法
1. MG63 及 HOS 细胞培养:两种细胞系均用含10% 胎牛血清的 RPMI-DMEM 培养液进行常规培养( 37 ℃ 培养箱、5% CO2),每 3 天传代 1 次。
2. 透射电子显微镜观察细胞自噬情况:透射电子显微镜是检测自噬最可靠和广泛使用的方法。电镜下可看到单层或双层膜结构的自噬体,内含细胞浆成分,如线粒体、内质网碎片等。自噬体是自噬发生的特征,自噬体的数量与自噬活性正相关[6]。
将骨肉瘤细胞 MG63、HOS 细胞分别接种于6 cm 培养皿上,37 ℃、5% CO2细胞培养箱中培养过夜,至细胞混合度达 60%~70% 时换无血清培养基。用胰酶消化细胞,4 ℃、1000 g 离心 5 min 收集细胞,冷 PBS 洗涤 2 遍,加入 3% 戊二醛,4 ℃30 min 固定,送样检验,电镜观察细胞自噬情况。
3. 免疫荧光染色观察细胞膜 GFP-LC3 表达:绿色荧光蛋白 GFP-LC3 是一种自噬体标记物,GFPLC3 以酯化形式结合在自噬泡上,呈明显的点状分布,一个荧光点表示为一个自噬体[7]。
将骨肉瘤 MG63、HOS 细胞接种到 6 孔板内,常规培养过夜,至细胞混合度达到 60%~70%。用lipofectamine 2000 转染 GFP-LC3 质粒 DNA,6 h 后换液,继续培养 24 h,取出爬片,用 4% 多聚甲醛室温固定 10~15 min,PBS 洗 3 遍,封片。荧光显微镜下观察,对 GFP-LC3 的阳性点数进行统计。
4. 蛋白质印迹法( Western blot )检测 P62、LC3、PARP 蛋白的表达:P62 作为自噬特异性的底物,当自噬被抑制时,P62 不再降解而积累起来,因此 P62 水平的变化能反应自噬流的变化[8],P62 的含量与细胞自噬活性呈负相关。LC3-II 是目前公认的自噬体相关的标记蛋白,LC3-II / β-Actin比值能很好地反应自噬的变化情况[7]。LC3 在细胞中有两种形式,即胞浆型 LC3( LC3-I )与膜型 LC3( LC3-II )。细胞自噬活性升高时,细胞内 LC3 的含量及 LC3-I 向 LC3-II 的转化均明显增加,LC3-II 或LC3-II / I 比值的大小与细胞自噬活性正相关[9]。
PBS 将各组细胞洗涤 3 遍,蛋白提取液提取蛋白,测定蛋白浓度。各组细胞取 25 μg,10% SDS 聚丙烯酰胺凝胶电泳,200 mA 转膜 1 h,用 5% 脱脂奶粉 / TBS( 0. 05% Tween20,125 mmol / L NaCl,25 mmol / L Tris,pH7.5 )封闭 1 h,兔抗人 P62、LC3和 PARP 孵育 4 ℃ 过夜,辣根过氧化物酶标记第二抗体孵育 1 h,ECL 显色,β-Actin 管家基因作为内参。
5. MTT 法检测 AS2O3对 MG63 及 HOS 细胞增殖的影响:分别取传代稳定后的骨肉瘤细胞 MG63、HOS 以 3.5×105/ ml 的细胞浓度接种于 96 孔板上,每孔体积为 200 μl。培养 24 h 后,按实验要求加入不同浓度的 AS2O3,以 0、0.5、1、2、4、6、12 μmol / L 处理 MG63,以 0、0.1、0.2、0.4、0.6、1.0、2.0 μmol / L 处理 HOS,每种浓度设 4 个平行孔,并设空白对照。于加药后 24 h 向每孔加入 MTT液 20 μl( 5 mg / ml )继续培养 4 h,吸去上清液,每孔加二甲基亚枫( DMSO )150 μl 避光振荡 10 min,酶联免疫检测仪在 490 nm 波长下检测各孔吸光度值( OD490 )。将所得结果绘制直方图,用药物浓度的对数值与细胞抑制率做线性回归计算 AS2O3对 MG63及 HOS 细胞的药物半数抑制浓度( IC50)。细胞存活率( % )=加药组 OD 值 / 对照组 OD 值×100%。
四、统计学处理
以上实验均独立重复 3 次。Western blot 条带的灰度测量采用 Image Lab 软件。实验数据采用 SPSS 18.0 软件进行两个独立样本 t 检验,P<0.05 为差异有统计学意义。
结 果
一、MG63 及 HOS 的基础自噬水平
1. 透射电镜观察 HOS、MG63 细胞自噬情况:透射电镜结果显示,HOS 细胞,自噬处于较低水平,细胞内自噬体较少;而 MG63 自噬水平较高,出现较多自噬泡和自噬体( 图1 )。
2. 荧光显微镜下观察自噬标记蛋白 GFP-LC3 表达:在多耐药株 MG63 中每视野 GFP-LC3 阳性点数为( 183±49 ),化疗敏感株 HOS 中每视野 GFP-LC3为( 12±2 ),MG63 较 HOS 细胞株表达量明显要高,二者比较差异有统计学意义( P<0.01 )( 图2 )。
3. 长寿蛋白 P62 / β-Actin 及 LC3-II / β-Actin比值的变化情况:MG63 细胞的 P62 / β-actin 值( 0.37±0.05 )低于 HOS 细胞的 P62 / β-actin 值( 0.95±0.20 ),二者差异有统计学意义( P<0.01 );MG63 细胞的 LC3-II / β-Actin 值( 0.81±0.10 )高于HOS 中 LC3-II / β-Actin 值( 0.24±0.05 ),二者差异有统计学意义( P<0.01 )。可见,在 MG63 细胞中,P62 表达水平较 HOS 低,而 LC3-II 表达水平较 HOS增高,这说明 MG63 细胞的基础自噬活性较 HOS 细胞高( 图3 )。
二、AS2O3对 HOS 及 MG63 细胞活力的影响
MTT 结果显示,HOS 及 MG63 在不同浓度 AS2O3处理后,细胞活力均受抑制,并且呈浓度依赖性( 图4a )。对于 HOS 细胞,AS2O3浓度为 0.4 μmol / L时与对照组( 不加 AS2O3组 )相比,能够有效地抑制细胞活性( P<0.05 ),AS2O3浓度为 1.0 μmol / L 时显著抑制细胞活性( P<0.01 );而对于 MG63 细胞,AS2O3浓度为 6 μmol / L 时与对照组相比,能够有效地抑制细胞活性( P<0.05 ),AS2O3浓度为 12 μmol / L时显著抑制细胞活性( P<0.01 )。为进一步分析AS2O3对 HOS 及 MG63 细胞活力的影响,我们用SPSS 软件计算两种细胞系的 IC50。发现 AS2O3抑制HOS 细胞活性的 IC50为 1.067 μmol / L,而 AS2O3抑制 MG63 细胞活性的 IC50为 15.42 μmol / L( 图4b )。结果显示,AS2O3对 MG63 较 HOS 耐药,这与 ATCC上关于两种细胞耐药性的描述是一致的[10-11]。
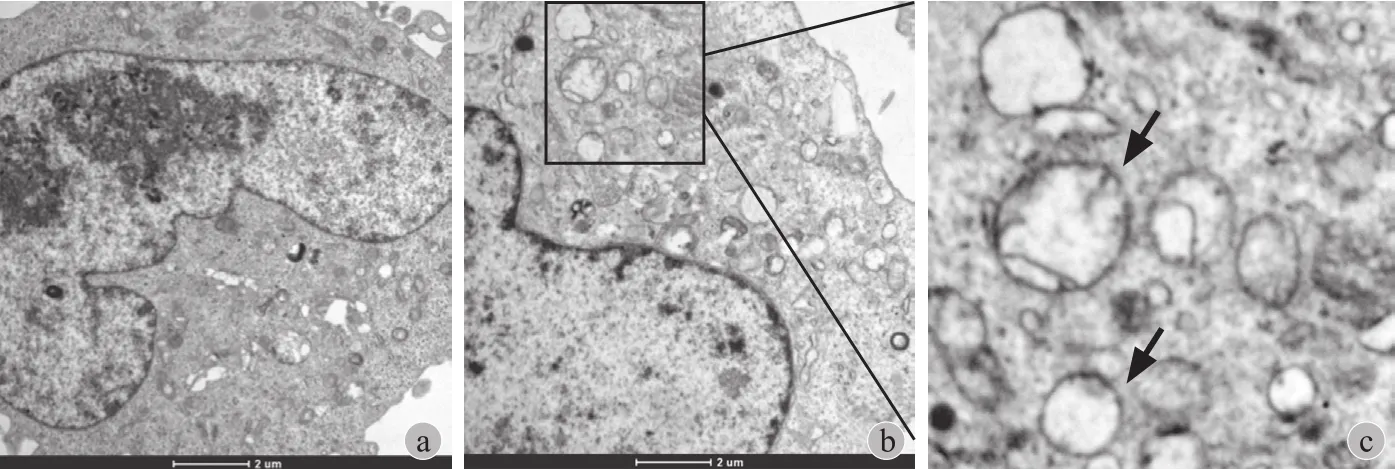
图1 透射电镜观察 HOS、MG63细胞自噬体 a:HOS( ×8200 );b:MG63( ×8200 );c:箭头所示为MG63 自噬体( ×16500 )Fig.1 Autophagosomes of HOS and MG63 cells were observed under transmission electron microscope a: HOS( ×8200 ); b: MG63( ×8200 ); c: Autophagosomes were indicated by the arrows( ×16500 )

图2 免疫荧光染色观察细胞膜 GFPLC3 表达,检测 HOS、MG63 细胞自噬情况 a:HOS 荧光显微镜图( ×400 );b:MG63 荧光显微镜图( ×400 );c:直方图(**P < 0.01 )Fig.2 The expressions of Green Fluorescent Protein( GFP )-LC3 in HOS and MG63 cells were determined by immunofluorescent staining to observe
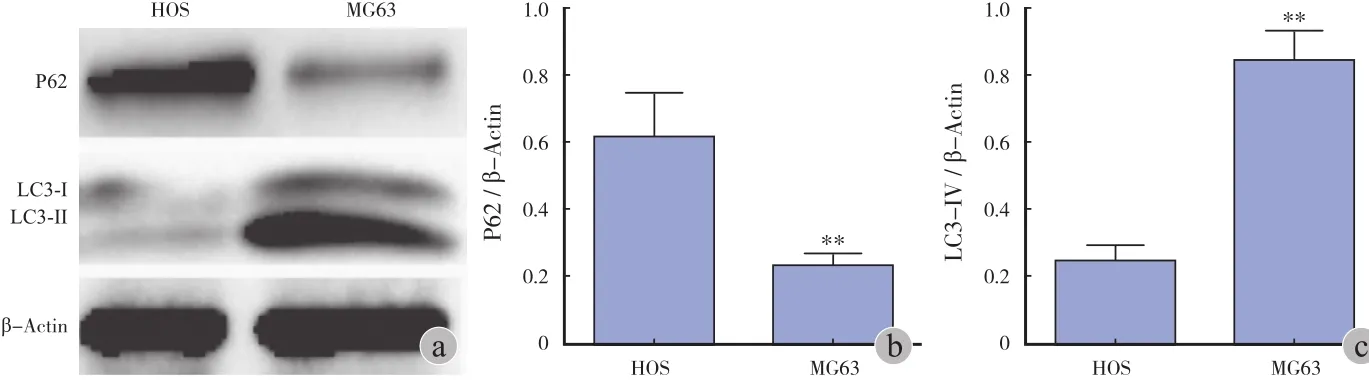
图3 Western blot 检测 HOS、MG63细胞 P62、LC3-I、LC3-II 蛋白相对表达情况 a:电泳图;b~c:直方图(**P < 0.01 )Fig.3 The relative expressions of P62, LC3-I and LC3-II proteins in HOS and MG63 cells were detected by Western blot assay a: Electrophoretogram; b-c: Histogram(**P<0.01 )
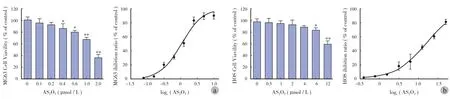
图4 AS2O3对 HOS、MG63 细胞活力的影响 a:AS2O3对 HOS 细胞活力的影响;b:AS2O3对 MG63 细胞活力的影响( 与对照组0 μmol / L 相比,*P < 0.05,**P < 0.01 )Fig.4 The effects of AS2O3on osteosarcoma cell viability a: The effects of AS2O3on HOS cell viability; b: The effects of AS2O3on MG63 cell viability(*P<0.05,**P<0.01, when compared with 0 μmol/L in the control group )

图5 Western blotting 检测 AS2O3诱导 HOS、MG63 自噬及凋亡的情况 a:AS2O3诱导 HOS 自噬及凋亡的情况;b:AS2O3诱导 MG63自噬及凋亡的情况Fig.5 The AS2O3-induced autophagy and apoptosis were detested by Western blot assay a: AS2O3-induced autophagy and apoptosis in HOS cells; b: AS2O3-induced autophagy and apoptosis in MG63 cells
三、不同浓度 AS2O3对 HOS 及 MG63 自噬及凋亡的影响
多聚 ADP 核糖聚合酶( poly ADP-ribose polymerase,PARP )是细胞早期凋亡的标记蛋白[12],当细胞内出现 PARP 切割,说明细胞内启动了凋亡的级联反应。结合 Western blot 及灰度值直方图( 图5 ),显示:随着 AS2O3浓度的升高,HOS 细胞的自噬活性逐渐增高,至 0.6 μmol / L 时,PARP 发生了切割,说明发生了早期凋亡;而 MG63 的自噬活性随着 AS2O3浓度的升高也在升高,至 2.0 μmol / L 时,自噬活性达到最高,此后随着 AS2O3浓度的升高,自噬活性出现了降低,至 6.0 μmol / L 时,细胞自噬活性已低于基础自噬活性,此时 PARP 发生了切割。发现 AS2O3可促进 HOS 自噬的发生,但随着细胞自噬水平的增加,HOS 的凋亡逐渐增加;AS2O3也可促进 MG63 细胞自噬,随着 AS2O3浓度的增加,细胞自噬水平也增加,直到零界点 6.0 μmol / L时,才发生细胞凋亡。
讨 论
化疗药物杀伤肿瘤细胞的主要途径是诱导肿瘤细胞凋亡[13]。化疗还可引起肿瘤细胞其它非凋亡形式的死亡,如:自噬、坏死、细胞衰老以及有丝分裂突变等[14]。化疗药物诱导肿瘤细胞自噬的发生,即可与凋亡共同诱导细胞死亡,也可作为肿瘤细胞在不利环境下进行自我保护的生存机制[15-17]。化疗药物在骨肉瘤治疗中的地位尤其重要,患者对化疗药物不敏感,则预后较差[18]。AS2O3最早用于治疗急性早幼粒细胞白血病,我们前期实验证明 AS2O3在体外能明显、有效地抑制骨肉瘤细胞的运动、迁移和侵袭[19],临床应用 AS2O3治疗转移性成骨肉瘤取得了满意的临床疗效[3,20]。但 AS2O3具体抗肿瘤机制目前尚不清楚,有报道认为与其诱导凋亡有关[21]。而 AS2O3可否引起细胞自噬的发生,国内外报道较少。我们通过检测凋亡相关蛋白 PARP、自噬标记蛋白 LC3 的变化,发现 AS2O3既可诱导MG63、HOS 这两种骨肉瘤细胞凋亡,也可促进自噬的发生。
自噬和凋亡同为细胞程序性死亡的方式,自噬也被称为 II 型程序性死亡。自噬和凋亡可相互促进,也可各自独立存在[22]。Kanzawa 等[23]研究发现小剂量( ≤2 mmol / L )AS2O3处理恶性胶质瘤细胞系后,肿瘤细胞产生了自噬性的细胞死亡,而不是凋亡。我们推测,对于 AS2O3相对不耐药的 HOS细胞,随着自噬水平的提高,可能促进了凋亡的发生,从而与凋亡共同诱导细胞死亡,来发挥抗肿瘤疗效;而对于 AS2O3耐药的 MG63 细胞,自噬可能作为保护肿瘤细胞抑制凋亡的生存机制,是保护性自噬。
促进肿瘤细胞的凋亡是化疗药物抗肿瘤的重要机制之一,肿瘤细胞凋亡受到抑制或凋亡易感性降低是耐药的原因之一[24]。化疗药物诱导肿瘤细胞发生的保护性自噬,能抑制凋亡,从而发生耐药。而抑制肿瘤细胞的保护性自噬,可能逆转肿瘤耐药。我们发现 MG63 较 HOS 对 AS2O3耐药,AS2O3通过促进 MG63 的保护性自噬延缓了凋亡的发生,推测自噬可能在 MG63 对 AS2O3化疗耐药中起到了一定的保护作用。Zhang 等[25]用 AS2O3和氯喹处理胃癌细胞 mgc-083,结果显示,AS2O3可诱导胃癌细胞产生保护性自噬,抑制凋亡;而两药联合处理胃癌细胞后,细胞的自噬减少,而凋亡增加。
以上研究结果表明,AS2O3可引起骨肉瘤细胞自噬,对不同的细胞诱导自噬或者降低自噬都可能促进肿瘤细胞的凋亡,从而达到治疗骨肉瘤的目的;也可诱导骨肉瘤细胞产生保护性自噬,延缓凋亡的发生,但是其具体调控机制目前仍不明确。本研究还发现,自噬在不同的骨肉瘤细胞中起着不同的作用,对 AS2O3化疗耐药的骨肉瘤细胞系基础自噬水平较高,随着细胞自噬水平的降低,可降低骨肉瘤细胞的耐药性,提示自噬可能是骨肉瘤细胞耐药的机制之一,有待通过进一步加入自噬抑制剂和自噬增强剂来验证。相信随着对自噬与骨肉瘤关系不断深入地了解,可为骨肉瘤发病机制的研究以及骨肉瘤的临床治疗提供新的思路。
[1] Rainusso N, Wang LL, Yustein JT. The adolescent and young adult with cancer: state of the art--bone tumors. Curr Oncol Rep, 2013, 15(4):296-307.
[2] Gorlick R, Janeway K, Lessnick S, et al. Children’s Oncology Group’s 2013 blueprint for research: bone tumors. Pediatr Blood Cancer, 2013, 60(6):1009-1015.
[3] 郭卫, 汤小东, 唐顺, 等. 三氧化二砷联合化疗治疗III期成骨肉瘤、尤文肉瘤的初步报告. 中华外科杂志, 2006, 44(12): 805-808.
[4] Klionsky DJ, Emr SD. Autophagy as a regulated pathway of cellular degradation. Science, 2000, 290(5497):1717-1721.
[5] Levine B, Kroemer G. Autophagy in the pathogenesis of disease. Cell, 2008, 132(1):27-42.
[6] Yang Z, Klionsky DJ. An overview of the molecular mechanism of autophagy. Curr Top Microbiol Immunol, 2009, 335:1-32.
[7] Mizushima N, Yoshimori T, Levine B. Methods in mammalian autophagy research. Cell, 2010, 140(3):313-326.
[8] Pankiv S, Clausen TH, Lamark T, et al. p62/SQSTM1 binds directly to Atg8/LC3 to facilitate degradation of ubiquitinated protein aggregates byautophagy. J Biol Chem, 2007, 282(33): 24131-24145.
[9] de Haan CA, Molinari M, Reggiori F. Autophagy-independent LC3 function in vesicular traffic. Autophagy, 2010, 6(7): 994-996.
[10] Billiau A, Edy VG, Heremans H, et al. Human interferon: mass production in a newly established cell line, MG-63. Antimicrob Agents Chemother, 1977, 12(1):11-15.
[11] McAllister RM, Gardner MB, Greene AE, et al. Cultivation in vitro of cells derived from a human osteosarcoma. Cancer, 1971, 27(2):397-402.
[12] Mullen P. PARP cleavage as a means of assessing apoptosis. Methods Mol Med, 2004, 88:171-181.
[13] Briccoli A, Rocca M, Salone M, et al. High grade osteosarcoma of the extremities metastatic to the lung: long-term results in 323 patients treatedcombining surgery and chemotherapy, 1985-2005. Surg Oncol, 2010, 19(4):193-199.
[14] Ricci MS, Zong WX. Chemotherapeutic approaches for targeting cell death pathways. Oncologist, 2006, 11(4):342-357.
[15] Gump JM, Thorburn A. Autophagy and apoptosis: what is the connection? Trends Cell Biol, 2011, 21(7):387-392.
[16] Thorburn A. Apoptosis and autophagy: regulatory connections between two supposedly different processes. Apoptosis, 2008, 13(1):1-9.
[17] Hippert MM, O’Toole PS, Thorburn A. Autophagy in cancer: good, bad, or both? Cancer Res, 2006, 66(19):9349-9351.
[18] Braccini AL, Bondiau PY, Litrico S, et al. Long term survival of an atlas osteosarcoma treated by surgery, chemotherapy and robotic stereotacticradiotherapy: a case report. Radiother Oncol, 2010, 97(3):608-609.
[19] 任婷婷, 郭卫, 卢新昌, 等. 三氧化二砷抑制骨肉瘤转移和侵袭的体外研究. 肿瘤研究与临床, 2009, 21(12):796-798.
[20] 张清, 徐万鹏, 郭卫, 等. 我国骨肉瘤治疗现状及改进建议: 17家骨肿瘤治疗中心1998~2008年资料分析. 中国骨肿瘤骨病, 2009, 8(3):129-132.
[21] Zhang S, Guo W, Ren T, et al. Arsenic trioxide inhibits Ewing’s sarcoma cell invasiveness by targeting p38MAPK and c-Jun N-terminal kinase. Anti-cancer Drugs, 2012, 23(1): 108-118.
[22] Moscat J, Diaz-Meco MT. p62 at the crossroads of autophagy, apoptosis, and cancer. Cell, 2009, 137(6):1001-1004.
[23] Kanzawa T, Zhang L, Xiao L, et al. Arsenic trioxide induces autophagic cell death in malignant glioma cells by upregulation of mitochondrial celldeath protein BNIP3. Oncogene, 2005, 24(6):980-991.
[24] Amaravadi RK, Yu D, Lum JJ, et al. Autophagy inhibition enhances therapy-induced apoptosis in a Myc-induced model of lymphoma. J Clin Invest, 2007, 117(2):326-336.
[25] Zhang G, Liu J, Zhang Y, et al. Cbl-b-dependent degradation of FLIP(L)is involved in ATO-induced autophagy in leukemic K562 and gastric cancer cells. FEBS Lett, 2012, 586(19): 3104-3110.
( 本文编辑:代琴 )
An experimental research on the effects of arsenic trioxide on autophagy in human osteosarcoma cells
LIANG Wei-min, GUO Wei, YAN Tai-qiang, YANG Rong-li. Musculoskeletal Tumor Center, Peking University People’s Hospital, Beijing, 100044, PRC
ObjectiveTo explore the effects of arsenic trioxide( AS2O3)on autophagy in human osteosarcoma cells( HOS, MG63 ).MethodsThe effects of AS2O3on the viability of HOS and MG63 cells were detected by 3-( 4,5-Dimethylthiazol-2-yl )-2,5-diphenyltetrazolium bromide( MTT )assay. The basal and AS2O3-induced levels of autophagy were observed by transmission electron microscope, immunofluorescent staining and Western blot assay.ResultsThe examination results of transmission electron microscope, immunofuorescent staining and Western blot assay showed the basal level of autophagy of MG63 cells was higher than that of HOS cells( P<0.01 ). The half maximal inhibitory concentration( IC50)value of AS2O3on MG63 cells was 15.42 μmol/L, which was obviously higher than 1.067 μmol/L of IC50value of AS2O3on HOS cells. HOS cells were more sensitive to AS2O3than MG63 cells. The protein expression levels of microtubule-associated protein 1 light chain 3( LC3 )-II and poly-ADP-ribose polymerase( PARP )were detected. The apoptosis was gradually serious with the improvement of AS2O3-induced autophagy in HOS cells, but AS2O3-induced autophagy protected the MG63 cells from apoptosis.ConclusionsThe AS2O3-induced autophagy plays different roles in osteosarcoma cells, and the apoptosis of tumor cells can be promoted so as to achieve the aim of erase osteosarcoma. For MG63 cells of chemotherapy resistance, the AS2O3-induced autophagy is protective, and the apoptosis will be delayed by autophagy. As to HOS cells of chemotherapy sensitivity, the apoptosis will be induced by autophagy
Autophagy; Osteosarcoma; Cell line, tumor; Arsenic trioxide( AS2O3)
10.3969/j.issn.2095-252X.2014.05.008
R738.1
国家自然科学基金资助项目( 81172543 )
100044 北京大学人民医院骨与软组织肿瘤诊疗中心暨骨肿瘤科
郭卫,Email: bonetumor@163.com
2014-01-07 )
