油酸对鸭原代肝细胞脂类氧化相关基因表达的影响
2014-01-21刘玮孟卢立志王军一
■刘玮孟 张 静 卢立志 王军一 周 磊
(1.临沂市动物疫病预防控制中心,山东临沂276000;2.罗庄区畜牧局,山东临沂276022;3.浙江省农业科学院畜牧兽医研究所,浙江杭州310021;4.临沂市畜牧站,山东临沂276000)
油酸是单不饱和脂肪酸(MUFA)中最有代表性脂肪酸,脂肪酸链中含有一个不饱和双键。单不饱和脂肪酸作为一类膳食脂肪酸,具有其特有的物理化学特性和特殊生理功能。多年来,油酸一直被认为对血浆胆固醇水平呈中性作用。然而,近期的许多研究证实,油酸降低胆固醇的作用及其能力与多不饱和脂肪酸(PUFA)相同,能够降低血液的胆固醇和脂肪的含量[1-2]。2001年美国国家胆固醇教育计划项目提出了一种膳食模式,即总脂肪的摄入占总热量的25%~35%,饱和脂肪酸(SFA)占总热量应低于7%,多不饱和脂肪酸(PUFA)占总热量的10%,单不饱和脂肪酸(MUFA)占总热量的10%。这个计划项目建议摄入更多的MUFA[3]。油酸几乎存在于所有的植物油和动物脂肪中,其中以橄榄油、低芥酸菜籽油、花生油、茶籽油、杏仁油和鱼油中含量较高[4]。
过氧化酶体增殖物激活受体α(PPARα)是一类由配体激活的核转录因子,参与调节机体脂类代谢相关基因的转录,在肝脂肪代谢过程中起重要调控作用,最终影响机体的生理过程[5]。PPARα的配体与PUFA结合后,促进了肉毒碱棕榈酰转移酶(CPT)、解偶联蛋白-3(UCP-3)、乙酰CoA氧化酶(ACOX)等基因的表达,促进脂肪酸β-氧化[6-8]。大量研究表明,脂肪酸影响脂类代谢相关基因的表达,但多集中在多不饱和脂肪酸,而单不饱和脂肪酸的研究却少有报道。为此,本试验通过在体外培养绍兴鸭原代肝细胞,在培养液中加入一定浓度的油酸,研究油酸对脂类代谢相关基因的表达量变化,为研究单不饱和脂肪酸调控脂类代谢影响机制打下基础。
1 材料与方法
1.1 肝细胞培养
肝细胞的培养采用改良的原位二步灌流法分离和培养[5]。将细胞按每孔5×105接种于6孔培养板,待细胞培养3 d后,弃去原有培养基,加入含油酸(100 μM)的无血清培养基,继续培养2 d,每组设三个复孔。收集细胞用于RNA的提取。
1.2 电镜观察细胞形态
取培养的细胞用PBS缓冲液洗3次,使用自制橡胶刮子将贴壁细胞从培养瓶或培养皿上轻轻刮下来,将含有细胞的液体倒入尖底离心管,500 r/min、离心8 min,2.5%戊二醛4℃固定过夜,2%锇酸固定1 h,再以30%~100%乙醇梯度脱水各10 min,常规包埋、修块、半薄及超薄切片,超薄切片用醋酸双氧铀及柠檬酸铅电子染色,透射电镜下观察肝细胞的特征性标志。
1.3 荧光定量PCR分析
1.3.1 细胞RNA提取
细胞收集后,Trizol法(Trizol试剂盒购自大连宝生物工程有限公司)分别提取细胞总RNA,测OD值,调整各组织总RNA浓度为1 μg/μl后分装保存于-70℃冰箱中待用。
1.3.2 RNA反转录
RNA样本按照大连宝生物工程有限公司Re⁃verse Transcriptase M-MLV(RNAase H-)说明书逆转录合成cDNA。
cDNA 反 应体 系 为 20 μl:Rnase Free ddH2O 11.25 μl、10 mmol/l的 dNTP Mixture 1 μl、Oligo(dT)引物1 μl、40 U/μl Rnase Inhibitor 0.25 μl、5×M-MLV Buffer 4 μl、RNA 模板 2 μl、200 U/μl Reverse Tran⁃scriptase M-MLV 0.5 μl。
反应条件:42℃ 1 h,72℃ 10 min,-20℃保存。
1.3.3 引物设计和荧光定量PCR扩增
根据genebank提交的序列设计实时荧光定量PCR引物。引物序列及目的片段长度见表1。采用SYBR Green I荧光定量PCR法检测目的基因。

表1 引物序列信息
1.3.4 荧光定量结果分析方法
采用2-ΔΔCt法对数据进行相对定量处理。校正公式为:目的基因的相对量=2-△△Ct;ΔΔCt=[Ct目的基因(待测样品)-Ct内参(待测样品)]-[Ct目的基因(校正样品)-Ct内参(校正样品)],以对照组相应组织样品基因的表达量作为校正样品。2-△△Ct即表示试验组目的基因的表达相对于对照组的变化倍数。
1.4 统计学方法
采用SAS 6.12广义线性模型进行方差分析,差异显著者进行Duncan's多重比较。数据以“平均值±标准误”来表示,P<0.05为差异显著。
2 结果
2.1 肝细胞形态观察(见图1)
由图1可知,本研究成功地培养鸭原代肝实质细胞,肝细胞为透亮圆形,并有立体感,呈单个或者三两聚集。在接种3 h后活细胞已经贴壁,24 h后出现伸展现象,贴壁的肝细胞呈上皮细胞样的多角形,体积明显增大,可见许多双核细胞,继续培养72 h后细胞已经基本铺满培养皿底。


图1 分离培养的鸭肝细胞形态(×200)
2.2 肝细胞亚结构观察(见图2)
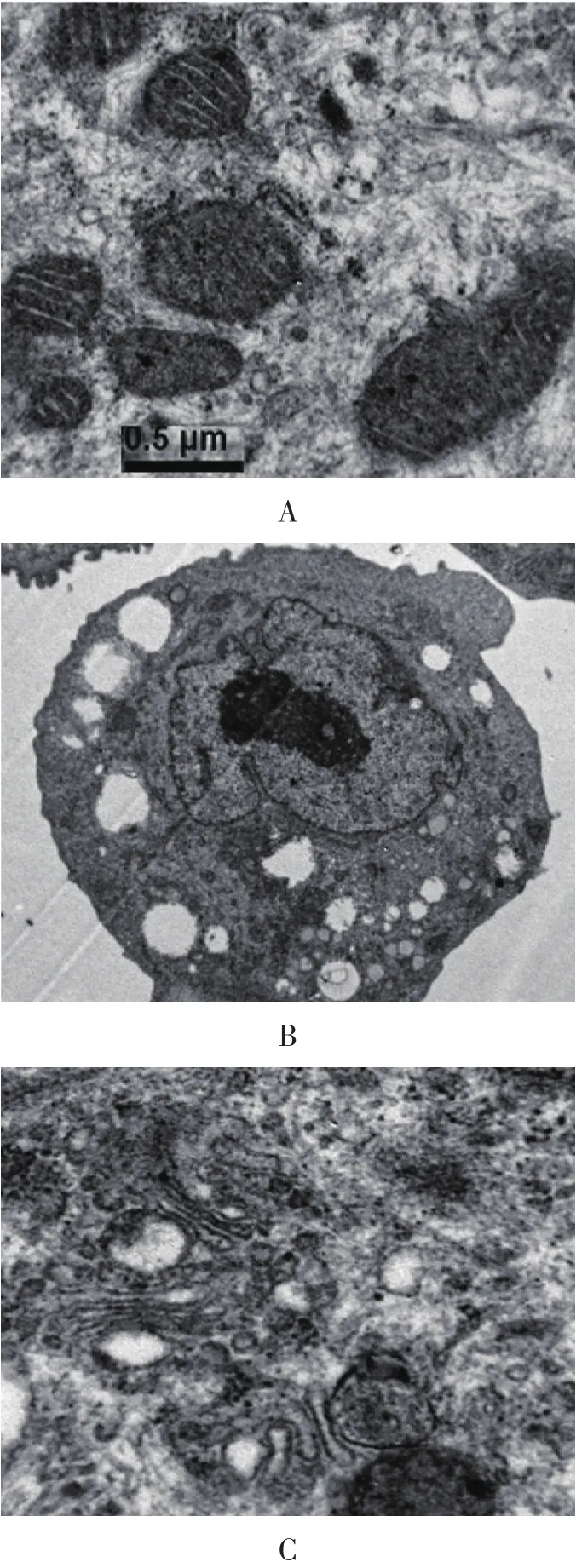
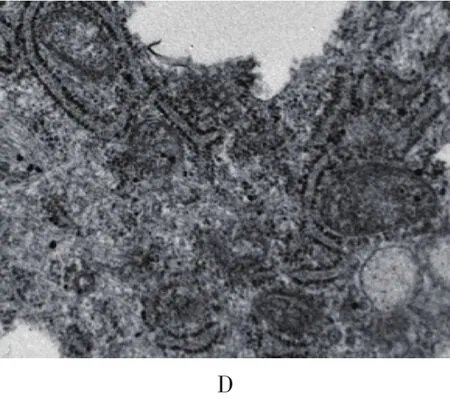
图2 培养的肝细胞透射电镜观察
由图2可见,培养48 h后肝细胞细胞核,核仁染色质清晰,有的为双核,胞质内有丰富的细胞器:大量的内质网,其中有典型的车轮状线粒体,核糖体,玫瑰花瓣形糖原颗粒,符合肝细胞的内部结构特征。
2.3 油酸对肝实质细胞基因表达影响(见图3)

图3 油酸对肝细胞脂类氧化基因表达的影响
由图3可知,在培养基里加入100 μM 油酸,孵育48 h后,促进了脂类合成相关基因的表达,其中PPARα、ACOX和LPL基因的表达量显著升高(P<0.05),L-FABP基因表达量在加入LA并未受到显著影响。
3 讨论
PPARs是一类由配体激活的核转录因子,PPARα能够与视黄醇X受体(RXR)结合形成二聚体,锚定到许多基因的启动子区的正向重复序列单元——过氧化物酶体增殖因子反应元件上,进而激活靶基因的转录。PPARα基因在许多组织都表达,如肝脏、肾脏、肌肉、睾丸及脂肪。PPARα基因能够调节过氧化物酶体的β氧化,促进脂蛋白脂肪酶合成,催化脂蛋白中的甘油三酯脂解成游离脂肪酸。本研究表明,培养液内加入油酸,上调了肝实质细胞PPARα基因的表达量。PPARα在调节过氧化物酶体增殖剂基因转录活性和肝脏过氧化物酶中起重要作用,是维护细胞内脂质代谢平衡的重要调控因子,其激活可以引起其下游靶基因ACOX表达量增加,加速脂肪的氧化,降低脂肪的含量,这些结果与前人在哺乳动物和鱼的细胞研究结果相类似[9-11]。
LPL基因在育种过程中经常作为牛、猪、鸡等畜禽脂肪沉积的重要候选基因[12-14],国内外对LPL基因的研究报道已有很多,但大部分都集中在禁食、补饲及不同日粮种类对LPL mRNA表达水平的影响[15-17],而在细胞水平研究水禽LPL方面的报道却不多。LPL是甘油三酯降解的限速酶,脂蛋白将内源性和外源性的脂肪运送到肝脏,在此LPL水解TG、VLDL和乳糜微粒。本试验发现,肝实质细胞在油酸中孵育,LPL基因表达量显著高于对照组,而在鸡和鱼的脂肪细胞中不饱和脂肪酸降低了LPL基因的表达量[18-19],这暗示LPL基因的调控可能存在组织特异性。L-FABP是肝脏中表达的脂肪酸结合蛋白,它不仅影响着细胞内的脂肪转运,也影响着脂肪代谢、脂质合成、长链脂肪酸依赖性基因调控胆汁酸与胆固醇的代谢等[20]。LFABP在编码区域存在PPAR反应元件,PPARα激活后,与视黄醇受体(retinoid X receptor,RXR)形成异源二聚体,作用于PPAR反应元件,上调L-FABP的表达。但本试验发现,加入油酸后,L-FABP基因的表达量并没有显著高于对照组,这可能是由于在细胞培养5 d后L-FABP基因在细胞内的表达量很低所致。
鸭原代肝细胞在加入油酸后,PPARα和ACOX基因表达的增加能够减少脂质沉积,维护脂类代谢的平衡,对于肥肝肝细胞的形成有一定的抑制作用。而L-FABP表达量的降低,使细胞内的游离脂肪酸不能及时转运到线粒体、内质网进行氧化分解,细胞内积蓄大量的游离脂肪酸,导致细胞膜损伤。油酸的孵育,最终会产生细胞的脂肪病变,进一步转变为脂肪肝细胞,但是其孵育的最佳时间和浓度以及具体机制还需要进一步研究。
