水杨酸钠致耳鸣大鼠脑海马区促肾上腺皮质激素释放因子的表达*
2013-12-23解为全廖华杨希林陈抗松邹哲飞李暐
解为全 廖华 杨希林 陈抗松 邹哲飞 李暐
耳鸣是指个体在外界无声源或电刺激的情况下主观感觉耳内或者颅内有声音,是一种常见的临床症状[1]。部分耳鸣患者通过转移注意力能够耐受耳鸣,部分耳鸣患者由于持续、枯燥耳鸣声严重影响学习和生活,甚至出现焦虑、抑郁等情绪障碍。同时,焦虑、抑郁等情绪障碍可以加重患者对耳鸣的主观感觉,从而形成恶性循环,给患者带来极大痛苦[2]。耳鸣产生的机制尚不明确,目前被广泛认可的理论由Jastreboff[3]提出,他认为耳鸣产生于听觉皮层下中枢对神经末梢的微弱信号的觉察处理过程中,与自主神经系统和边缘系统密切相关。因此,情绪相关脑区参与耳鸣的发生、发展、维持以及耳鸣发病的心理机制成为耳科学家及心理学家的研究热点。促肾上腺皮质激素释放因子(corticotropin-releasing facotr,CRF)作为急慢性应激应答的驱动因子广泛存在于情绪相关脑区,与应激、情绪、学习和记忆等行为活动密切相关,可能在耳鸣引起负性情绪和大脑海马区对耳鸣的病理性记忆中起重要作用。本研究拟通过检测水杨酸钠致耳鸣大鼠模型海马区CRF的表达,探讨CRF与耳鸣的关系。
1 材料与方法
1.1 实验动物及分组 健康Wistar大鼠30只(购自武汉大学A3动物实验室),体重200~300g,2~3月龄,耳廓反应灵敏,雌雄不拘,无强噪声暴露及耳毒性药物使用史。随机分为A、B、C 三组,每组10只,A 组每天注射10%水杨酸钠溶液(购自Sigma公司)350 mg/kg,共注射21 天;B 组每天注射10%水杨酸钠溶液350 mg/kg,共注射14 天;C 组为阴性对照组,每天同时间注射等量生理盐水14天。
1.2 动物耳鸣行为学检测 大鼠耳鸣行为学检测最经典的方法是Jastreboff提出的饮水抑制法[4],本实验参考Jastreboff经典饮水抑制法并在此基础上将足部电击改为嘴部电击。在水杨酸钠注射前采用饮水抑制法对三组大鼠进行条件反射训练,使大鼠形成“声音出现-饮水开始,声音消失-饮水停止”的条件反射,条件反射建立后停止训练并开始注射水杨酸钠,条件反射消退期1~3天测量饮水抑制率(R),R=B/(A+B),其中B 为条件刺激(背景噪声停止)期1min内大鼠的饮水次数,A 为条件刺激之后1min内大鼠饮水次数。
1.3 ABR 检测 分别于给药前、首次给药后2h、给药结束当天对各组大鼠行ABR 检测。检测均在环境噪声<30dB SPL 的隔声屏蔽室中进行,动物腹腔注射1%戊巴比妥钠50 mg/kg麻醉,记录电极置于颅顶正中位置,参考电极置于同侧耳后皮下,鼻尖接地。探测音由SigGenRP2(TDT)软件包编译,TDT(Tucker-Davis Technology)系统校准后连接高频电磁扬声器(MF1)给声,采用BioSigRP2(TDT)软件包记录分析结果。采用短声(click)刺激,极间电阻<5kΩ,刺激率为21次/秒,观察时程10ms,滤波带宽100~3 000 Hz,叠加500次,以引出波Ⅲ的最小刺激强度为反应阈。
1.4 Western blot检测大鼠脑海马区CRF表达 给药结束当天各组动物处死后断头取脑,根据George Paxinos &Charles Watson大鼠立体定位图谱[5]定位大鼠脑海马区,体式显微镜下掀开大脑皮层后迅速完整剥离海马,整个取材过程冰上操作,取材后将组织置于-80 ℃冰箱保存。各组标本分别称重,加入适量RIPA 裂解液后冰上匀浆,4 ℃12 000rpm 离心,取上清液,BCA 法测蛋白浓度,各样品取50μg总蛋白上样,恒压120V/40mA,12%的SDS-PAGE凝胶电泳。根据预染溴酚蓝显示,目的蛋白充分分离后,停止电泳。取出凝胶,切下目的条带,蒸馏水冲洗后200 mA 恒流PVDF 膜转膜,用含5% 含脱脂奶粉的TBST 封闭液室温封闭2 h,将PVDF 膜浸泡于含兔抗鼠GAPDH 及兔抗鼠CRF一抗孵育液(1:500,Santa)中,4 ℃孵育过夜。TBST 缓冲液洗膜5min×5次,加入HRP 标记二抗(1:40 000,武汉博士德生物公司),室温摇床孵育2h。TBST 洗膜5min×5次,ECL 发光剂曝光、显影,Gel Pro4.0 软件进行灰度扫描分析,检测条带光密度比值(CRF/GAPDH),比较各组CRF 蛋白表达。
1.5 统计学方法 应用SPSS19.0统计软件,各组数据总体差异采用单因素方差分析(One-way analysis of variance,One-Way ANOVA),组间多重比较采用LSD-t检验,以P<0.05为差异有统计学意义。
2 结果
2.1 大鼠行为学检测结果 经过5天的适应性训练三组大鼠饮水抑制率均小于0.2,且R 值趋于稳定,大鼠条件反射已经建立。条件反射消退期1~3天A、B 两组大鼠R 值大于C 组,差异有统计学意义(P<0.05),说明耳鸣大鼠模型造模成功。从第4天开始,三组大鼠R 值差异无统计学意义。
2.2 ABR 检测结果 给药前各组大鼠ABR 反应阈差异无统计学意义(P>0.05)。A、B两组大鼠水杨酸钠注射后2hABR 波形分化较差,反应阈较注药前和对照组明显升高(P<0.01);对照组大鼠ABR 反应阈与注射前差异无统计学意义(P>0.05)。给药结束后当天,A、B 两组大鼠ABR 反应阈较首次给药后2小时升高(P<0.05),较对照组也明显提高(P<0.01),但A、B 两组间ABR 反应阈差异无统计学意义(P>0.05)(表1)。
表1 各组大鼠不同时间ABR 反应阈比较(dB SPL,±s)(n=20耳)
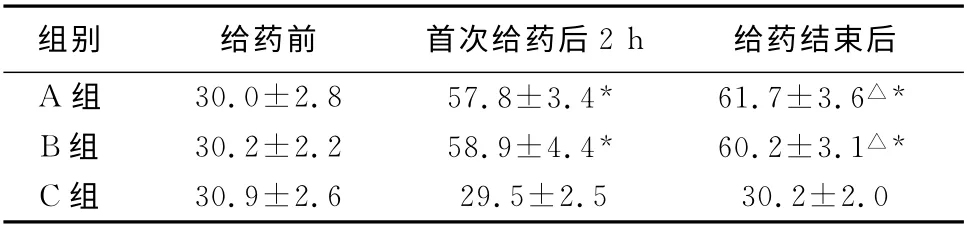
表1 各组大鼠不同时间ABR 反应阈比较(dB SPL,±s)(n=20耳)
注:*与同组给药前及对照组同一时间比较,P<0.01;△与同组给药后2h比较,P<0.05
组别给药前首次给药后2h 给药结束后A 组30.0±2.8 57.8±3.4*61.7±3.6△*B组30.2±2.2 58.9±4.4*60.2±3.1△*C组30.9±2.6 29.5±2.5 30.2±2.0
2.3 各组大鼠海马区CRF 表达 给药结束后A、B、C三组CRF/GAPDH 的值分别为0.25、0.23和0.09,可见A 组大鼠海马区CRF表达最高,B 组次之,C 组表达最低,A、B 两组与C 组大鼠海马区CRF表达差异均有显著统计学意义(P<0.01)(图1)。
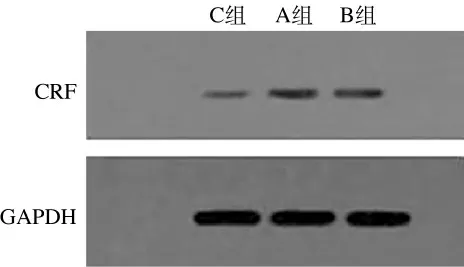
图1 Western blot法检测三组大鼠脑海马区CRF表达
3 讨论
海马不仅是边缘系统的重要结构,也是下丘脑-垂体-肾上腺(HPA)轴的高级调节中枢之一,在应激反应的调控中起到重要作用,与学习记忆、情绪调节等行为活动密切相关[6]。CRF 是由41个氨基酸组成的多肽,由下丘脑室旁核(PVN)分泌,能够刺激垂体前叶皮质释放大量促肾上腺皮质激素,被认为是应激反应调节的驱动因子[7]。研究表明CRF 不仅存在于PVN,而且广泛分布于中枢神经系统其它区域如新皮质、脑干和边缘系统(杏仁核、海马)。在海马,CRF 能够增强海马椎体细胞兴奋性,促进长时程增强(LTP)的诱导和形成,影响神经突触的结构和数目,在学习记忆、情绪反应以及神经系统的发育中发挥着重要作用[8]。急性应激和慢性温和不可预知应激(chronic unpredictable mild stress,CUMS)动物模型可导致海马对下丘脑抑制减弱,迅速合成的CRF激活HPA 轴调节机体应激反应。长时间的过度刺激可以持续兴奋HPA 轴,促进海马区兴奋性神经递质的释放,使突触后膜NMDA 受体增敏,形成病理性LTP,参与病理性及创伤性记忆的形成和巩固[9]。同时,如果海马受到高水平糖皮质激素及兴奋性神经递质的损伤,可导致神经信息传递损害,引起学习、记忆、情绪障碍。
海马和杏仁核是边缘系统两个主要的脑区,Mirz等[10]发现耳鸣患者的杏仁核及海马的脑血流明显增加,活性增强,提示边缘系统参与了耳鸣的发病机理;O’Mara等[11]发现适当的声音刺激可以促进听觉中枢系统和边缘系统的神经发育;海马和杏仁核接受来自听觉中枢的神经纤维投射,同时海马和杏仁核也直接或者间接投射纤维到听皮层已经得到证实[12]。本研究发现水杨酸钠注射14天后大鼠海马区CRF明显上升,说明长期的耳鸣刺激可以持续兴奋大鼠情绪相关脑区,并对大鼠海马病理性记忆产生了影响;水杨酸钠注射21天后CRF 表达继续升高,一方面可能是使病理性记忆得到巩固,另一方面可能通过多种机制损伤了海马神经元,参与了抑郁、焦虑情绪的发生。另外在耳蜗发现了局部类似HPA 轴的控制系统,CRF1基因敲除大鼠产生听力损失,其具体机制尚不清楚,说明CRF 在听觉形成中起到重要作用[13],因此CRF 表达升高,可能在边缘系统与听觉中枢系统的复杂神经纤维投射中起到桥梁作用。
水杨酸钠致耳鸣动物模型是最常用的耳鸣动物模型,其外周及听觉中枢机制已得到广泛的研究[14]。经典的饮水抑制法和近年来兴起的惊跳反射前抑制(prepules inhibition of acoustic startle response,PPI)[15]等动物行为学模型均证实了350 mg/kg水杨酸钠钠溶液连续注射可以使动物产生持续2~3天的耳鸣。本实验将经典的饮水抑制法进行改进,同样发现大鼠条件反射消退期1~3 天A、B两组与C组大鼠饮水抑制率(R 值)存在差异,证实了水杨酸钠可以使大鼠产生耳鸣,成功建立了水杨酸钠致耳鸣大鼠模型。从文中结果看,水杨酸钠注射2h后A、B两组大鼠ABR 反应阈发生了约30dB的阈移,与文献报道一致[16],水杨酸钠注射14天组与21天组大鼠ABR 反应阈变化不大,可能是水杨酸钠对听觉系统的作用达到饱和,也可能是大鼠对耳鸣的一种适应。
总之,CRF 作为情绪应激相关蛋白,可能与边缘系统参与水杨酸钠致耳鸣的发生、发展和维持的机制相关,在耳鸣的精神心理机制中起到了重要作用,说明长期慢性耳鸣刺激可能通过精神心理因素加重耳鸣病情。
1 孔维佳,耳鼻咽喉头颈外科学[M].第二版.北京:人民卫生出版社,2010.201~205.
2 黎志成,古若雷,曾祥丽,耳鸣的心理机制[J].心理科学进展,2011,19:1 179.
3 Jastreboff PJ.Phantom auditory perception(tinnitus):mechanisms of generation and perception[J].Neuroscience Research,1990,8:221.
4 Jastreboff PJ,Brennan JF,Coleman JK,etc.Phantom auditory sensation in rats:an animal model for tinnitus[J].Behavioral Neuroscience,1988,102:811.
5 George P,Watson C.The rat brain in stereotaxic coordinates[M].Academic Press,2007.26~45.
6 Mizuno K,Giese KP.Hippocampus-dependent memory formation:do memory type-specific mechanisms exist[J]?J Pharmacol Sci,2005,98:191.
7 Dautzenberg FM,Hauger RL.The CRF peptide family and their receptors:yet more partners discovered[J].Trends in Pharmacological Science,2002,23:71.
8 Wang XD,Rammes G,Kraev I,et al.Forebrain CRF1modu-lates early-life stress-programmed cognitive deficits[J].J Neurosci,2011,31:13 625.
9 Marinkovic I,Lyytinen J,Valanne L,et al.Bilateral hippocampal infarction as etiology of sudden and prolonged memory loss[J].Case Rep Neurol,2012,4:207.
10 Mirz F,Gjedde A,Sdkilde-Jrgensen H,et al.Functional brain imaging of tinnitus-like perception induced by aversive auditory stimuli[J].Neuroreport,2000,11:633.
11 O'Mara S.The subiculum:what it does,what it might do,and what neuroanatomy has yet to tell us[J].J Anat,2005,207:271.
12 Munoz-Lopez MM,Mohedano-Moriano A,Insausti R.Anatomical pathways for auditory memory in primates[J].Front Neuroanat,2010,4:1.
13 Graham CE,Vetter DE.The mouse cochlea expresses a local hypothalamic-pituitary-adrenal equivalent signaling system and requires corticotropin-releasing factor receptor 1to establish normal hair cell innervation and cochlear sensitivity[J].The Journal of Neuroscience,2011,31:1 267.
14 Kaltenbach JA.Tinnitus:models and mechanisms[J].Hearing Research,2011,276:52.
15 Liu XP,Chen L.Auditory brainstem response as a possible objective indicator for salicylate-induced tinnitus in rats[J].Brain Research,2012,1 485:88.
16 Yang G,Lobarinas E,Zhang L,et al.Salicylate induced tinnitus:behavioral measures and neural activity in auditory cortex of awake rats[J].Hearing Research,2007,226:244.
