杜仲叶酶解液辅助提高醋抗氧化活性的研究
2013-12-06贾春凤戎柯晓孙晓琦郝建新伏邦炳干苏灵张柏林
贾春凤,王 松,戎柯晓,孙晓琦,郝建新,周 方,伏邦炳,干苏灵,张柏林,*
(1.北京林业大学生物科技学院,北京100083;2.保定学院生化系,河北保定071000;3.陕西明冠食品饮料有限公司,陕西略阳724300;4.江苏绿扬现代生态农业发展有限公司,江苏扬州225105)
醋具有较好的抗氧化作用。Shoko Nishidai等[1]研究了醋的抗氧化活性(亚油酸自氧化体和DPPH体系),黑醋的乙酸乙醋萃取物(EK)的抗氧化活性最高。Atsushi Sugiyama等[2]研究表明,一定剂量的葡萄醋和葡萄汁可以降低小鼠心脏病和高血压的发病率。杜仲(Eucommia ulmoides Oliver)为杜仲科(Eucommiace-ae)植物,一般以皮入药,在我国具有悠久使用历史。近期研究发现,杜仲叶中含有的化学成分和杜仲皮中的极为相似,并且二者具有相近药理作用[3-4],且杜仲叶资源丰富易得。因此,杜仲叶作为食品加工原料,在食品中的应用已经进入起步阶段,目前市场上主要产品有杜仲茶,但应用到食品中的深加工研究却鲜有报道。杜仲叶中绿原酸含量相当丰富,绿原酸具有较强的生物活性[5],其中最主要的是抗氧化作用[6]。张万峰[7]研究表明,杜仲叶绿原酸(CA)含量为1.27%-4.06%。鉴于《中华人民共和国药典》将绿原酸定为评价杜仲叶质量优劣的主要技术指标[8],因此本研究以绿原酸为标志物质对杜仲叶酶解液的抗氧化活性进行探究。许多疾病的发生被认为与氧化有关,如冠心病、癌症、糖尿病等[9-11],从而抗氧化物质的研究已经成为目前科研领域的热门课题。生物材料的抗氧化特性可能是不同抗氧化剂相互作用的结果,表现为协同作用、负协同作用、累加效应[12-13]。本实验将研究杜仲叶酶解液和醋协同抗氧化作用,为功能性食品的开发提供理论基础。
1 材料与方法
1.1 材料与仪器
杜仲叶 陕西省汉中市略阳县秋季老叶;镇江香醋 醋酸>4.00g/100mL,江苏丹阳市恒君调味品厂;绿原酸标准品 色谱纯,上海融禾医药科技有限公司;纤维素酶 分析纯,九州同业药品公司;VC分析纯,北京奥博星生物技术有限责任公司;1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-Picrylhydrazyl radical,DPPH) 分析纯,Sigma公司;三氯乙酸(TCA)、95%的乙醇、硫酸亚铁、过氧化氢、磷酸二氢钠、磷酸氢二钠等 均为北京化工厂产分析纯。
752型紫外可见分光光度计 上海美诺达仪器有限公司;分析天平 上海民析精密科学仪器有限公司;DSY-2-8型恒温水浴锅 北京国华医疗器械厂。
1.2 杜仲叶酶解液(EEH)的制备
绿原酸(CA)标准品用95%的乙醇稀释一系列的梯度,在332nm测定吸光值,绘制曲线,建立方程y=0.0505x+0.0037(R2=0.9995)。式中:x为溶液中绿原酸质量浓度(0~60μg/mL);y为吸光值。
在酶解温度为45℃,料液比为1∶10,酶添加量为0.1%,酶解时间2h的条件下,对杜仲叶粉进行酶解,酶解液过膜,并用紫外分光光度计在332nm下测定绿原酸含量。
1.3 杜仲叶酶解液与醋配比方案
以文献[14-15]中提到的杜仲叶酶解液(EEH)抗氧化活性为依据,以杜仲叶酶解液中绿原酸含量为指标,按不同的体积比进行实验设计(见表1)。
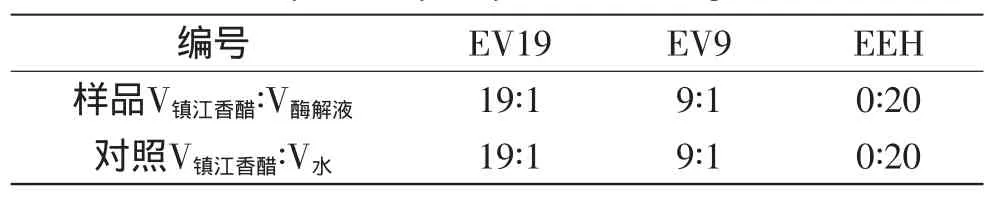
表1 不同样品的配比Table 1 Different ratio of eucommia ulmoides oliv leaves enzymatic hydrolysate and vinegar
1.4 抗氧化性能研究方法
1.4.1 清除DPPH自由基性能测定 方法在文献[16-20]的基础上略做修改。DPPH溶液的配制:准确称取4mg DPPH,用适量95%乙醇溶解,然后定容至100mL,得DPPH浓度0.004%,4℃避光保存。配制不同浓度的样品溶液,同一试管中加入1mL样品溶液,1mL 0.004%DPPH溶液,摇匀,室温放置30min。95%乙醇代替样品做为空白对照。测定各溶液517nm的吸光度。重复3~5次,然后按以下公式计算清除率,清除率越大则抗氧化能力越强。
清除率(%)=[1-(Ai-Aj)/A0]×100
式中:A0——1mL无水乙醇加入1mL DPPH溶液的吸光值;Ai——1mL样品中加入1mL DPPH溶液反应后在517nm处的吸光度;Aj——1mL待测液加1mL 95%乙醇的吸光值。
1.4.2 还原能力的测定 方法在文献[1,19-20]的基础上略作调整。按1.3得的各样品分别配制成20μL/mL的待测样品溶液备用。待测样品2mL,与2mL磷酸缓冲液(0.2moL/L,pH6.6),2mL 1%K3Fe(CN)6混合,将混合物于50℃温育25min,然后在混合物中加入2mL 10%三氯乙酸。取上层清液5mL,加入5mL水和lmL 0.1%三氯化铁,混合均匀,静置10min后以蒸馏水为空白,700nm下测定吸光值A700。
1.4.3 羟自由基的清除率测定 方法以参考文献[1,2,20]为基础并加以改进。具体操作如下:按1.3得的各样品分别配制成20μL/mL的待测样品溶液备用。1mL待测样品中加入6.0mmol/L的水杨酸乙醇溶液(用纯乙醇配制)1mL,再加入6.0mmol/L的硫酸铁溶液1mL,用蒸馏水补足4mL,混匀后加入6.0mmol/L的过氧化氢溶液1mL启动Fenton反应,摇匀,放置10min后,以蒸馏水作参比,在510nm下测定吸光值。
羟自由基的清除率(%)=[1-(Ai-Aj)/A0]×100
式中:Ai—空白对照溶液于510nm下的吸光值;Aj—1mL蒸馏水代替水杨酸,按同法进行Fenton反应,在510nm下的吸光值;A0—1mL蒸馏水代替样品,按同法进行Fenton反应,在510nm下的吸光值。
1.5 数据分析及处理
每组实验重复5次,采用SPSS 17.0软件对实验数据进行T检验和相关性分析,实验结果用平均值±标准误差表示。采用Sigmaplot 10.0软件作图。
2 结果与讨论
2.1 酶解液中绿原酸含量
测得杜仲叶酶解液中绿原酸含量为(1.80±0.16)mg/mL。
2.2 杜仲叶酶解液的抗氧化性能研究
2.2.1 酶解液清除DPPH自由基能力研究 图1显示,随着物质含量的增加,各样品都呈现出先快速上升后逐渐趋于平稳的抗氧化活性趋势,说明反应液中样品的含量达到一定值后,再增加物质含量已对样品抗氧化性没有影响。当物质含量在5~10μg/mL时,与CA标品、VC标品相比,EEH酶解液清除DPPH自由基的能力较强,这可能因为EEH酶解液中还含有黄酮等其他高抗氧化活性物质。在10μg/mL时,酶解液的DPPH的清除率达到最高值,为88.70%±0.91%。因此,酶解液应用到食品时,其绿原酸含量不能低于10μg/mL。
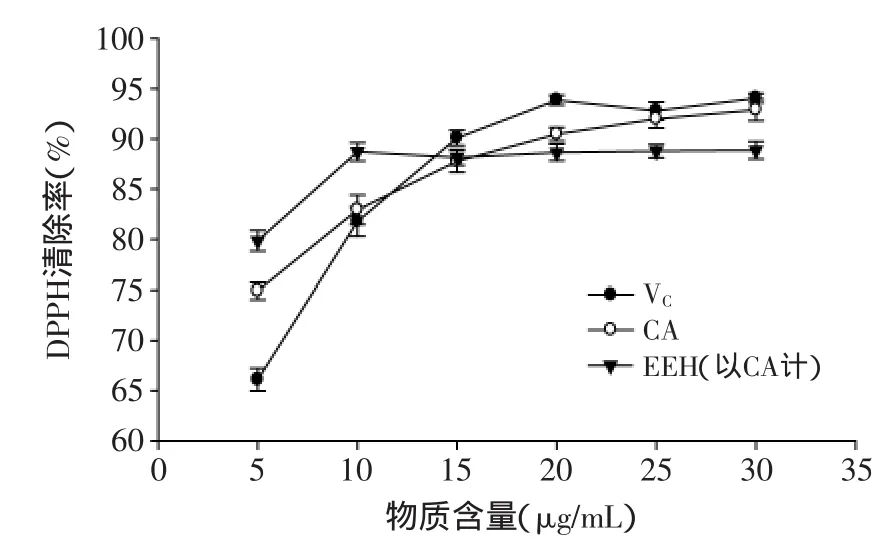
图1 VC、CA、EEH清除DPPH自由基能力Fig.1 DPPH free radical-scavenging activity of VC,CA and EEH
2.2.2 酶解液清除羟自由基能力研究 图2显示,随着物质含量的增加,各样品除羟自由基能力呈现上升趋势。物质含量为10μg/mL时,EEH、VC和CA清除羟自由基能力几乎同时达到最高,清除率分别为:47.5510%±1.37%、49.42%±0.94%、28.85%±0.96%,可见酶解液具有较强清除羟自由基能力并且远远高于绿原酸标品,这也可能是酶解液中还含有黄酮其他高抗氧化活性物质所致。当样品含量大于10μg/mL,随着样品含量的增加,酶解液清除羟自由基的能力逐渐平缓。因此,在实际应用时绿原酸添加量最好保持在10μg/mL以上,以保证其效果的稳定性。

图2 VC、CA、EEH清除羟自由基能力Fig.2Hydroxyl(OH)radical-scavenging activity of EEH,VCand CA
2.2.3 酶解液还原能力研究 图3显示,随着物质含量的增加,各样品还原能力呈现上升趋势。与VC和CA标品比较,EEH酶解液还原能力较弱。但当物质含量为0.2mg/mL时,VC和CA还原能力已经呈现平稳的趋势,而EEH还是上升的趋势。因此可以推测得出,当EEH的含量继续增加,大于0.3mg/mL,还原能力会继续增加,直至出现平稳的趋势。
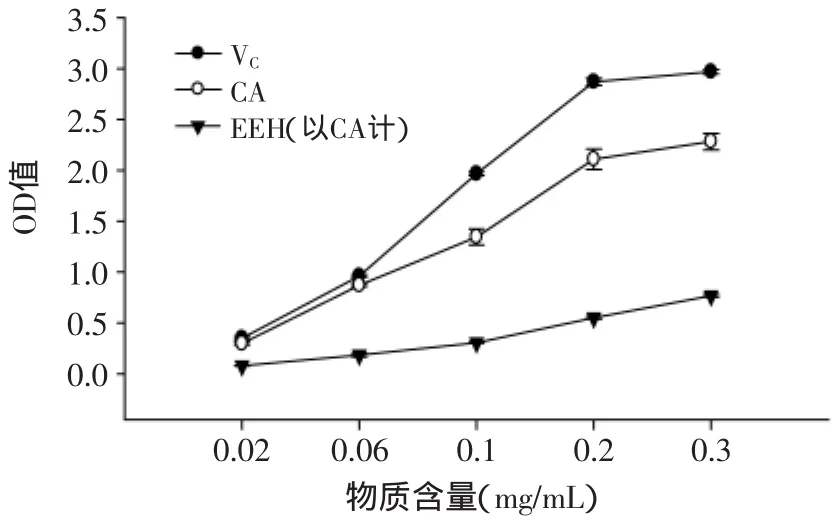
图3 VC、CA、EEH的还原能力Fig.3 Reducing power of EEH,VCand CA
2.3 酶解液和醋协同抗氧化性能研究
2.3.1 各种样品清除DPPH自由基能力比较 图4可见五种样品清除DPPH自由基的能力强弱顺序为:EEH>EV19>EV19对照>EV9>EV9对照。EEH酶解液清除DPPH自由基活性最强,显著高于除EV19的其他样品(p<0.05)。EV9对照样品清除DPPH自由基活性最弱,显著低于其他各个样品(p<0.05)。
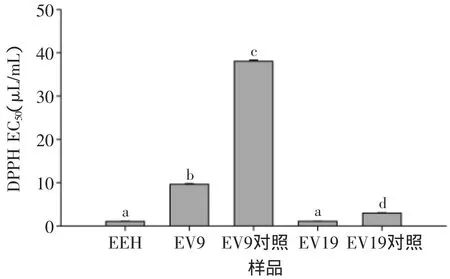
图4 不同样品清除DPPH自由基的能力Fig.4 DPPH free radical-scavenging activity of different sample
2.3.2 各种样品还原能力比较 样品还原能力的强弱可用OD值的大小表示,因此由图5可知,当体积含量为20μL/mL时,各个样品还原能力的强弱顺序为EV19>EV19对照>EV9>EV9对照>EEH,两个配制样品EV9、EV19的还原能力分别显著高于EEH以及各自的对照。
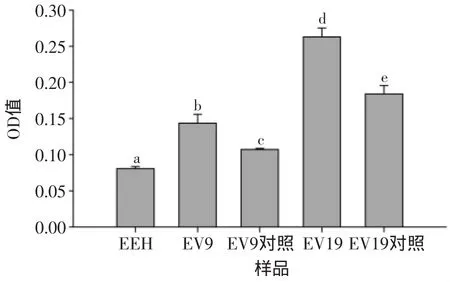
图5 不同样品的还原能力Fig.5 Reducing power of different sample
2.3.3 各种样品清除羟自由基能力比较 不同样品清除羟自由基能力见图6。清除羟自由基能力强弱顺序为:EV19>EEH>EV19对照>EV9>EV9对照,可见,EEH的添加能够提高醋清除羟自由基的能力,配制杜仲醋清除羟自由基能力与添加EEH相关,杜仲酶解液和醋具有协同清除羟自由基的作用。
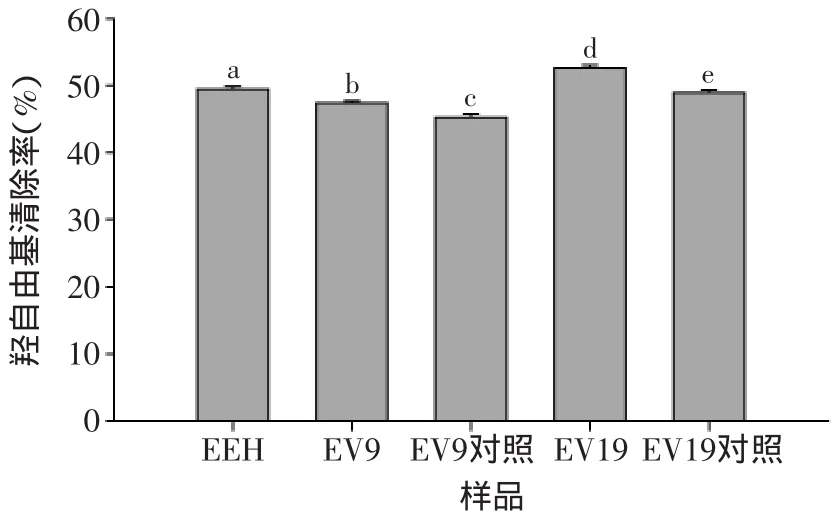
图6 不同样品清除羟自由基能力Fig.6 Hydroxyl radical-scavenging activity of different sample
由表2可知,两种配制样品(EV9和EV19)的抗氧化活性分别与EEH、醋抗氧化活性的相关系数较大,可见,EEH和醋对杜仲醋的抗氧化活性影响较强,共同增强了杜仲醋的抗氧化能力。因此,EEH与醋具有协同抗氧化作用,EEH能够辅助提高醋的抗氧化性能。
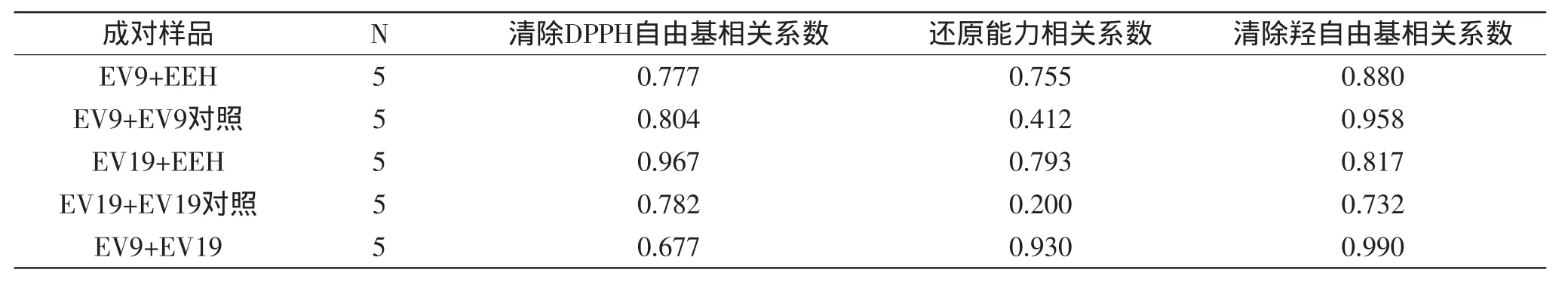
表2 成对样本相关系数Table 2 Correlation coefficient of paired samples
3 结论
3.1 杜仲叶酶解液中CA含量为(1.80±0.16)mg/mL。通过体外抗氧化实验得出,杜仲叶酶解液具有较强的抗氧化性能;当酶解液应用到食品时,产品中绿原酸含量不得小于10μg/mL。
3.2 杜仲叶酶解液和醋具有较好协同抗氧化作用,杜仲叶酶解液能够显著提高醋的抗氧化活性(p<0.05),为杜仲叶在食品中的应用提供了新的理论支持。
[1]ShokoNISHIDAI,YoshimasaNAKAMURA.Kurosea traditional vinegar produced from unpolished rice supresses lipid peroxidation in vitro and in mouse skin[J].Biosci Piotechno Bioehel,2000,64(9):1909-1924.
[2]Atsushi.Aeute cardiovascular effects of a new beverage made of wine vinegar and grape juice,assessed using an in vivo rat[J].Nuterition Researeh,2003,23:1291-1296.
[3]刘迪.杜仲叶抗疲劳功效分子机制与抗氧化作用关联性研究[D].西安:陕西科技大学,2011.
[4]周琳娜,张红霞,张艳艳,等.纤维素酶辅助水解杜仲叶醋的发酵条件[J].食品工业科技,2012,33(12):201-204.
[5]JainPK,Di Tomaso E,Duda Dqetal.Angio genesisin brain tumors[J].Nature Reviews Neuro seience,2007(8):610-22.
[6]卞合涛.绿原酸对氧化应激损伤内皮细胞的保护作用及机制探讨[J].南京:南昌大学,2011.
[7]张万峰.不同月份杜仲叶中绿原酸含量的研究[J].安徽农业科学,2008,36(19):8145-8146.
[8]国家药典委员会.中华人民共和国药典[M].北京:化学工业出版,2004:114-115.
[9]Dean RT,Fu SL,Stocker R,et al.Biochemistry and pathology of radical-mediated protein oxidation[J].Biochemical Journal,1997,324(1):1-18.
[10]Benzie IFF.Evolution of antioxidant defense mechanisms[J].European Journal of Nutrition,2000,39(2):53-61.
[11]Willcox JK,Ash SL,Catignani GL.Antioxidants and prevention of chronic disease[J].Critical Reviews in Food Science and Nutrition,2004,44(4):275-295.
[12]Ho Jin Heo,Young Jun Kim,Donghwa Chung.Antioxidant capacities of individual and combined phenolics in a model system[J].Food Chemistry,2007,104:87-92.
[13]Liu Donghong,John Shi,Alejandra Colina Ibarra.The scavenging capacity and synergistic effects of lycopene,vitamin E,vitamin C,and b-carotene mixtures on the DPPH free radical[J].LWT-Food Science and Technology,2008,41:1344-1349.
[14]叶文峰,辛增平,冷桂华.杜仲叶葡萄醋复合饮料的研制[J].食品科技,2008,34(3):73-75.
[15]宗留香,肖青苗.杜仲保健醋的配制[J].中国调味品,1999,7:12-14.
[16]Reiko Ohmori,Tamami Iwamoto,Motomi Tagb.Antioxidant activity of various teas against free radicals and LDL oxidation[J].Lipids,2005,40(8):849-853.
[17]张风云,毛富春.毛细管区带电泳法筛选提取杜仲叶中氯原酸的方法[J].西北药学杂志,1996,11(2):66.
[18]国家药典委员会.中国药典2010[M].北京:中国医药科技出版社,2010.
[19]高锦明,张鞍灵,张康健.绿原酸分布、提取与生物活性研究综述[J].西北林学院学报,1999,14(2):73.
[20]Chiu Y K,Chang X C,Takeshi D.Endothelium dependent vasorelaxant effects of the aqueous extracts of the eucommia ulmoides oliv leaf and nark:Implications on their antihypertensive action[J].Vascular Pharmacology,2004,40:229-235.
