壳聚糖-果胶钙微球的制备及其体外溶胀释放性的研究
2013-12-06夏书芹张晓鸣
杨 飞,周 华,夏书芹,谭 晨,张晓鸣
(江南大学食品学院,食品科学与技术国家重点实验室,江苏无锡214122)
随着食品科技的发展和人们生活品质要求的不断提高,如何高效吸收利用牛初乳免疫球蛋白、活性肽等具有生物活性的功能性食品成分已日益受到重视。但是,蛋白多肽类功能成分口服时通常具有不耐酸,易被消化道内的蛋白酶水解而失去活性的问题,严重降低了其营养价值。因此,以提高此类功能成分的胃肠稳定性,实现其缓释、靶向输送和高生物利用度的新型食品功能成分传输释放系统的开发和利用已经成为功能食品研究的热点。目前,采用天然多糖作为蛋白多肽类功能性成分靶向控释载体的研究已经成为研究热点。目前,果胶多以果胶钙或与其他多糖复配使用的形式被应用于有效成分缓控释的研究。低甲氧基果胶可与二价金属离子交联,形成特有的“蛋格”结构[1],可有效包埋蛋白多肽等功能性成分,但其缓释效果不佳。张良珂等研究了Ca2+和Ba2+交联果胶凝胶微丸释放蛋白多肽类药物的性质时,发现果胶钙或果胶钡微球在由模拟胃液中转入模拟肠液中后1~2h内就会完全解体,无法达到现小肠内缓慢释药的效果[2]。壳聚糖和果胶形成聚电解质复合物,有助于提高肠内缓释效果。靳镭等考察果胶-钙-壳聚糖游离膜对胃肠道上段药物释放的屏障作用时,发现果胶-钙-壳聚糖游离膜可增加胃肠道上段药物释放的屏障作用,有利于制剂的结肠靶向释药[3]。目前,国内学者多偏向于果胶载体的体外释放研究,很少涉及其体外溶胀的探究。本研究将离子移变交联和聚电解质络合相结合,以牛血清白蛋白(BSA)为模型蛋白类功能成分,通过滴加法制备壳聚糖-果胶钙微球,并着重从体外溶胀和释放两方面深度考察其应用特性,旨在为蛋白多肽类功能成分靶向输送载体的构建提供依据。
1 材料与方法
1.1 材料与仪器
牛血清白蛋白、无水氯化钙 国药集团化学试剂有限公司;低甲氧基果胶(甲氧基度26%) 美国斯比凯可公司;食品级壳聚糖(相对分子质量≈1×105,脱乙酰度93.4%) 青岛金湖甲壳制品有限公司;其他试剂 均为分析纯。
SPX-250型振荡培养箱 上海博讯实业有限公司;UV-1600型紫外可见分光光度计 上海美普达仪器有限公司;RW20.n型悬臂式搅拌器 广州仪科公司;DELTA 320型pH计 梅特勒-托利多仪器公司;DX51/BX52型显微镜 奥林巴斯公司。
1.2 实验方法
1.2.1 牛血清白蛋白壳聚糖-果胶钙微球的制备 配制果胶水溶液(90℃),待其降温至40℃时,边搅拌边将一定量的牛血清白蛋白溶于其中[4]。同时,采用2%(v/v)的醋酸溶液配制氯化钙-壳聚糖交联溶液。边缓慢搅拌边采用注射器(5mL,7#针头)将果胶和牛血清白蛋白(5%w/v)的混合溶液滴加到pH5.5氯化钙-壳聚糖溶液中,针头离液面高度为5cm左右,搅拌速度100r/min,滴速大约2mL/min,交联时间10min[5-6]。交联完成后,筛网过滤,去离子水清洗三次,真空干燥(37℃、真空度0.1MPa)24~48h,即得壳聚糖-果胶胶钙微球。
1.2.2 微球表征观察 观察干态和湿态微球的形态与分布,同时对载有BSA的壳聚糖-果胶钙微球在溶胀的不同阶段的形态结构进行分析和比较。
1.2.3 包封率和载量的计算 交联完成后,筛网过滤,水洗三次,合并滤液,取0.5mL氯化钙-壳聚糖交联溶液和微球洗涤液的混合溶液[7],采用考马斯亮蓝法测定游离BSA含量[8],计算出实际载量和包封率。包封率(EE)和载量(LC)计算公式如下:

式中:W1:微球中BSA浓度/mg;W2:交联液和洗涤液中游离BSA含量/mg;W:微球的干重/mg。
1.2.4 体外溶胀度的测定 定量称取干燥壳聚糖-果胶钙微球,置于25mL具塞烧杯中,加入5mL模拟胃液(0.1mol/L HCl,pH1.2),置于(37±0.5)℃恒温水浴锅中水浴溶胀2h后,将微球转移至模拟肠液(KH2PO4/NaOH,0.05mol/L,pH7.4)中,每隔一定时间,取出微球,用滤纸吸其表面水分,称重后记录数据,并将微球放回原来溶液[9],溶胀度计算公式如下:

式中:Wa:某一时间点溶胀后微球的质量/g;W:溶胀前微球干重/g。
1.2.5 体外释放率的测定 定量称取干燥壳聚糖-果胶钙微球,置于100mL具塞锥形瓶中,加入50mL模拟胃液,置于(37±0.5)℃恒温振荡水浴锅中,50r/min振荡。2h后再将微球由模拟胃液中转移至模拟肠液中,继续释放。每隔一定时间,取样并用考马斯亮蓝法测其吸光度,同时补充相同体积的新鲜释放介质,计算样液BSA含量[9]。累积释放率计算公式如下:

式中:Cn:第n次取样时,释放介质中BSA浓度(mg/mL);V:释放介质体积(mL);Vi:第n次取样前,所取样的体积(mL)。
2 结果与讨论
2.1 微球形态观察

图1 干燥前后的微球照片Fig.1 Images of microspheres before and after drying
由于微球的粒径主要受制备微球所用针头内径以及干燥方式的影响[6],而本实验中制备微球的针头和干燥方式都是不变因素,所以在本实验中不同条件下制备的微球大小和形态基本一致,无明显差异。如图1所示,干燥前,微球呈乳白色,球形颗粒,粒径2mm左右;干燥后,壁材被浓缩,微球呈果胶原料的浅黄色,扁圆形颗粒,粒径略有减小。
2.2 微球溶胀前后形态分析
如图2所示,载有BSA的壳聚糖-果胶钙微球在不同的溶胀阶段,有着显著的变化。当干燥的微球在进入模拟胃液中后快速吸水溶胀,0.5h和2h的时候,微球溶胀情况相近,可见当微球浸在模拟胃液中0.5h后,就达到了溶胀平衡。然后将在模拟胃液中溶胀了2h的微球转入pH7.4的模拟肠液中后,微球进一步溶胀,并随着溶胀时间的延长,微球的溶蚀现象越明显。在模拟肠液中溶胀3h后,微球几乎完全被溶蚀。因此,可推断:在模拟胃液中,壳聚糖-果胶钙微球不断溶胀,其释放主要是在微球半透膜两侧BSA浓度差的推动下,BSA不断向微球表面扩散完成;而当微球进入模拟肠液中后,主要在微球的不断溶蚀过程中,实现BSA释放的。
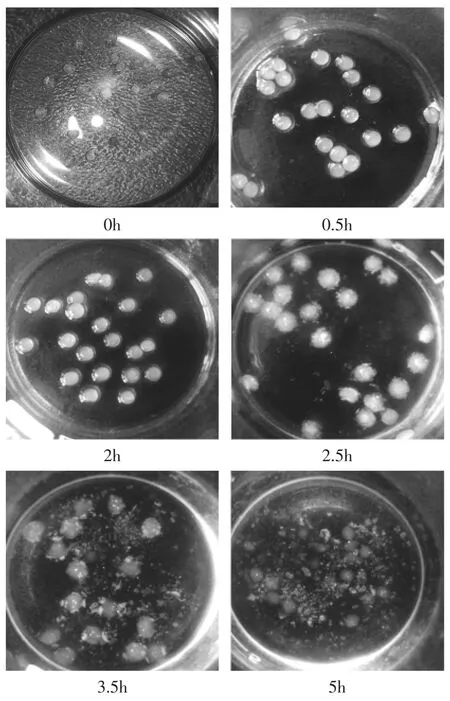
图2 不同溶胀阶段的微球照片Fig.2 Images of microspheres during swelling periods
2.3 果胶浓度的影响
果胶浓度对于微球质量具有显著的影响。由于采用注射器滴加法制备微球,果胶浓度过低时,无法形成规则球状;浓度过高时,果胶溶液粘度过大,会导针孔致阻塞。故由预实验可知,取3%~7%浓度范围内的果胶进行研究为宜。由表1和图3中可以看出,随着果胶浓度的增加,包封率增加,而载量、体外溶胀度和累计释放率逐渐减小。分析原因,可能是由于随着果胶浓度的增加,可提供更多的果胶分子和钙离子形成致密的“蛋格”结构,有效包埋更多的BSA;此外,随着果胶浓度的增加,果胶分子上的-COO-和壳聚糖分子上的-NH3+所带电荷相当,相互之间的静电吸引力增强,溶胀度减小[10],微球通透性降低,减少了BSA的释放。在现有的三个浓度梯度中,当果胶浓度为7%(w/v)时,获得最高包封率和最低累积释放率。综上所述,选取7%(w/v)的果胶进行进一步研究。

表1 果胶浓度对微球的包封率和载量的影响Table 1 Effect of pectin concentration on the EE and LC of microspheres
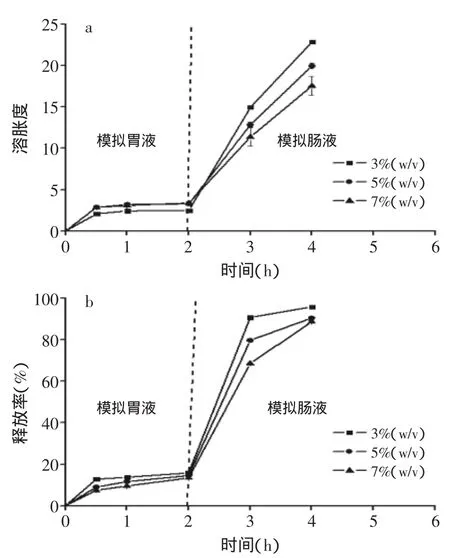
图3 果胶浓度对微球的溶胀度和释放率的影响Fig.3 Effect of pectin concentration on swelling ratioand cumulative BSA release rate of microspheres
2.4 氯化钙浓度的影响
由表2可知,当CaCl2浓度为3%时,微球的包封率和载量最高;而高于或低于该浓度时,包封率和载量均会有所下降。由图4a可知,随着CaCl2浓度的增加,微球的溶胀度逐渐减小;而图4b显示,微球在CaCl2溶液浓度为3%时,体外释放率最小。在果胶、壳聚糖和钙离子体系中,果胶和壳聚糖形成聚电解质络合物,而钙离子与凝胶网络内游离的果胶羧基结合,从而交联成更致密的网状结构。虽然,增大钙离子浓度降低了凝胶结构溶胀度,筛网孔隙率较小,进一步阻碍了大分子的释放[2],但是过多的钙离子会占据大量果胶羧基结合位点,减少聚电解质络合物的形成,多聚糖游离膜结构疏松,从而导致微球的通透性增大,溶胀度增大,加快芯材释放[11]。综上所述,选取3%(w/v)氯化钙溶液进行进一步研究。
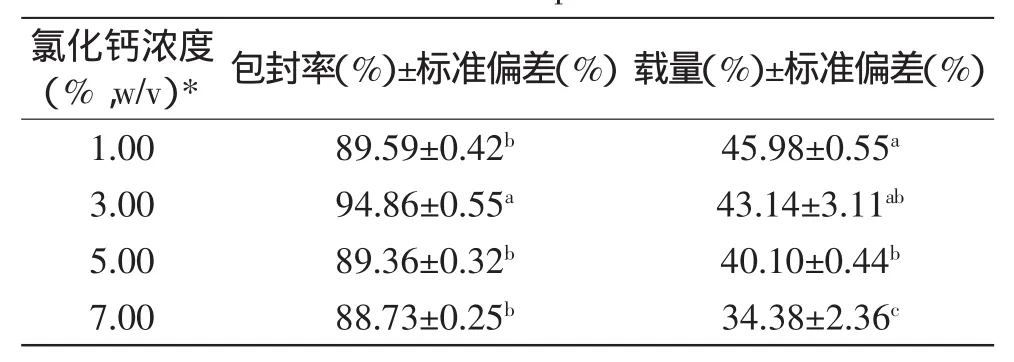
表2 氯化钙浓度对微球的包封率和载量的影响Table 2 Effect of calcium chloride concentration on the EE and LC of microspheres

图4 氯化钙浓度对微球的溶胀度和释放率的影响Fig.4 Effect of calcium chloride concentration on swelling ratio and cumulative BSA release rate of microspheres
2.5 壳聚糖浓度的影响
壳聚糖可与果胶通过静电相互作用,在微球表面形成聚合电解质复合物,对果胶钙微球具有显著的固化作用,减少其通透性。如表3所示,当果胶钙体系中加入壳聚糖之后,微球的通透性显著降低,包封率和载量最高分别提高了约17%和6%。

表3 壳聚糖浓度对微球的包封率和载量的影响Table 3 Effect of chitosan concentration on the EE and LC of microspheres
图5a所示,在模拟胃液中,果胶钙微球和壳聚糖-果胶钙微球均在1h后达到溶胀平衡,但是前者溶胀度略小于后者;而转入模拟肠液中后,果胶钙微球要早于壳聚糖-果胶钙微球2h崩解,这不利于微球中BSA的缓释。图5b所示的结论印证了图5a的推测。当不存在壳聚糖时,微球的通透性较大,在模拟胃液中突释情况严重,要高于壳聚糖-果胶钙微球约20%;而在转入模拟肠液中后,果胶钙微球的快速崩解导致微球中BSA几乎在2h内完全释放。而壳聚糖的介入显著推迟了微球的崩解时间,改善了BSA的缓释效果。当壳聚糖浓度比较低时,壳聚糖在醋酸溶液中充分溶解,壳聚糖溶液粘度小,分子基本成线状,能够在果胶钙外层充分分散均匀,大量分子链段渗透到果胶钙内层网孔中,其氨基与果胶中剩余羧基配位复合,有效降低了孔隙率,同时降低微球的通透性[11];当浓度大于0.5%时,壳聚糖无法在果胶钙外层均匀分散,也不能有效进入果胶钙孔隙中形成致密果胶-壳聚糖复合膜,导致微球通透性变大;而且,果胶和壳聚糖中的羧基和胺基以COO-、NH+、NH和COOH形式存在,适当果胶和壳聚糖比例有利于聚电解质络合物和聚合物分子内氢键的形成,使多糖凝胶网状结构收缩,从而导致膜溶胀度降低,降低释放率[2]。综上所述,选取0.50%(w/v)的壳聚糖溶液为宜。

图5 壳聚糖浓度对微球的溶胀度和释放率的影响Fig.5 Effect of pectin concentration on swelling ratio and cumulative BSA release rate of microspheres
3 结论
本文基于天然多糖复配获得的微球可避免高温处理、有毒交联剂或有机试剂的使用,减少了对蛋白多肽类功能成分的破坏,为新型肠定位释放载体的构建提供了一个有效的途径。研究结果确定了牛血清白蛋白壳聚糖-果胶钙微球的最佳制备工艺为:7%(w/v)的果胶溶液,3%(w/v)氯化钙溶液,pH5.5的氯化钙-壳聚糖交联溶液,0.50%(w/v)的壳聚糖溶液,5%(w/v)的BSA浓度。最终,壳聚糖-果胶钙微球中,BSA的包封率高达89.68%,载量高达32.13%,释放时间显著延长,缓释效果得到明显改善。但是,如何进一步优化肠部缓释效果还值得深入探究。壳聚糖-果胶钙微球有望成为蛋白多肽类功能因子口服肠道释放的输送载体。
[1]O Chambin,G Dupuis,D Championb,et al.Colon-specific drug delivery:Influence ofsolution reticulation properties upon pectin beadsperformance[J].InternationalJournalof Pharmaceutics,2006,321:86-93.
[2]张良珂,田睿,袁佩,等.牛血清白蛋白从不同果胶凝胶微丸中的释放[J].中国药学杂志,2008,43(18):1407-1410.
[3]靳镭,梁桂贤,丁红,等.果胶-钙-壳聚糖游离膜的制备及特性研究[J].中国现代医生,2010,48(18):8-12.
[4]Verma A,Pandit J K.Rifabutin-loaded floating gellan gum beads:Effect of calcium and polymer concentration on incorporation efficiency and drug release[J].Tropical Journal of Pharmaceutical Research,2011,10(1):61-67.
[5]赵瑛.胰岛素果胶钙结肠靶向微球的研究[D].武汉:华中科技大学,2008.
[6]Das S,Chaudhury A,Ng K.Preparation and evaluation of zinc-pectin-chitosan composite particles for drug delivery to the colon:Role of chitosan in modifying in vitro and in vivo drug release[J].International Journal of Pharmaceutics,2011,406(1-2):11-20.
[7]Kim T H,Park Y H,Kim K J,et al.Release of albumin from chitosan-coated pectin beads in vitro[J].International Journal of Pharmaceutics,2003,250(2):371-383.
[8]Lin Y H,Liang H F,Kuang C,et al.Physically crosslinked alginate/N,O-carboxymethyl chitosan hydrogels with calcium for oral delivery of protein drugs[J].Biomaterials,2005,26(14):2105-2113.
[9]Xu Yongmei,Zhan Changyou,Fan Lihong,et al.Preparation of dual crosslinked alginate-chitosan blend gel beads and in vitro controlled release in oral site-specific drug delivery system[J].International Journal of Pharmaceutics,2007,336(2):329-337.
[10]郑学芳,杨华,王立升.壳聚糖/果胶及其衍生物水凝胶的制备与在功能成分控制释放中的应用[J].食品工程,2008,3(12):120-123.
[11]邢楠,田丰,刘圣军,等.海藻酸钙-壳聚糖微胶囊组成对BSA通透性能影响的研究[J].化学学报,2007,65(24):2952-2928.
