肉制品中沙门氏菌invA基因实时荧光定量PCR检测方法的建立
2013-12-06杜雄伟胡文忠武晓松
杜雄伟,李 叶,冮 洁,胡文忠,武晓松
(1.大连民族学院,辽宁大连116600;2.辽宁出入境检验检疫局,辽宁大连116001)
沙门氏菌是一种重要的食源性致病菌。由沙门氏菌引起的食物中毒事件在世界各国频频报道。2007年2月,美国发生的“花生酱事件”,2005~2006年间,美国发生的“番茄事件”均是因沙门氏菌引发[1-3]。2006年卢森堡公国,沙门氏菌引起133人食物中毒,1人死亡[4]。2005年6~10月之间,澳大利亚塔斯马尼亚州爆发了5次沙门氏菌引起的食物中毒,感染125人[5]。2005年法国因牛奶引起的沙门氏菌中毒事件,同时感染100多婴儿[6]。1990~2003年间西班牙加泰罗尼亚地区,共爆发1078次食物中毒,其中因沙门氏菌引起为871次,14695人感染,1534人住院治疗,4人死亡,所占比例高达80.8%[7-9]。在我国,细菌性食物中毒中有70%~80%是由沙门氏菌引起的,以沙门氏菌引起的食物中毒占细菌性食物中毒的首位[10]。由上可见,食品行业沙门氏菌的检测尤为重要,现有检测方法主要为生化鉴定和常规PCR方法,这些方法耗时耗力,荧光定量PCR方法具有快速准确、敏感性强的特点。国外已经开发了类似的快速检测试剂盒,但由于知识产权的限制,使用起来极为不便,并且费用昂贵。因此自主建立特异、敏感、快速的沙门氏菌快速检测方法对沙门氏菌防控显得尤为重要。实时荧光定量PCR以其特异性强、灵敏度高、速度快,在病原菌检测中得到广泛应用。本研究以沙门氏菌invA基因为靶基因,应用SYBR Green荧光定量PCR技术建立特异快速的沙门氏菌检测方法,为沙门氏菌的检测奠定基础[11-12]。
1 材料与方法
1.1 材料与仪器
沙门氏菌C77-31 购于中国兽药监察所;大肠杆菌、金黄色葡萄球菌 本实验室分离保存;野生型鼠白血病病毒反转录酶(Reverse Transcriptase M-MLV)、RNA酶抑制剂(Ribonuclease Inhibitor,Rnasin)、Dnase-1、Ex-TaqDNA聚合酶(Ex-Taq Polymerase)、Taq DNA聚合酶(5U/μL)、dNTPs(100mmol/mL)、DL2000 DNA marker、Light Cycler2 FastStart DNA master SYBR GreenⅠ试剂盒、一对特异性引物InvAF、InvAR宝生物工程(大连)有限公司产品;质粒快速提取试剂盒及DNA纯化试剂盒 Omega公司产品;总RNA提取TRIZOL Reagentinvitrigen公司产品;常规试剂 均为分析纯。
7500型实时荧光定量PCR仪、ABI System 9700型常规PCR扩增仪 美国ABI公司;凝胶成像分析系统 美国UVP GelDoc-lt公司;高速离心机 美国Eppendorf公司;恒温摇床 美国Barnstead Lab-Line公司。
1.2 实验方法
1.2.1 引物的设计 根据GenBank中已经注册的沙门氏菌invA基因序列,用引物设计软件Prmier5.0设计一对特异性引物InvAF、InvAR,引物序列如下:
InvAF:5’-TCATTCCATTACCTACCTATC-3’
InvAR:5’-AGAA(G/A)ACAACAAAACCCAC-3’
1.2.2 PCR模板的制备 所有受试菌接种于3mL LB肉汤中,37℃培养至OD600为0.5,再调节细菌浓度为1×107CFU/mL,取1mL,10000r/min离心2min,收集菌体。菌体用灭菌超纯水洗涤,1000×g离心5min,弃上清,用200μL的灭菌超纯水重悬菌体,加入等体积的消化缓液及5μL的蛋白酶K(20mg/mL),50℃消化2h,12000r/min离心15min;将上清转移到新的1.5mL的eppendorf管中,加入等体积的Tris饱和酚,缓慢颠倒均匀,12000r/min离心15min;取上层的水相转入新的1.5mL的eppendorf管中,加入等体积的酚∶氯仿∶异戊醇(25∶24∶1)混匀后,在离心机上12000r/min离心15min;酚∶氯仿∶异戊醇(25∶24∶1)重复抽提一次;取上层的水相转入新的1.5mL的eppendorf管中,加入2倍体积预冷的无水乙醇,在-20℃放置l~2h或室温放置30min以沉淀细菌DNA;12000r/min离心15min,弃去上清,用70%乙醇洗涤沉淀,自然风干。用含RNAseA(20μg/mL)的TE溶解沉淀,-20℃保存备用。
1.2.3 常规PCR(25μL PCR)反应体系 10×PCR buffer(含Mg2+)2.5μL,dNTP(2.5mmol/μL)0.5μL,InvAF(20pmol/μL)0.5μL,InvAR(20pmol/μL)0.5μL,1.2.2.1产物0.5μL,Taq DNA聚合酶(5U/μL)0.5μL,DEPC水20μL;反应程序为94℃,2min;98℃ 15s,54℃15s,72℃ 30s,30个循环;72℃ 10min。取5μL PCR产物1%于琼脂糖凝胶电泳。
1.2.4 标准阳性模板的制备 将1.2.2.2中PCR产物回收纯化后,插入pMD18-T载体,命名为pMD18-T-invA,转化于DH5α大肠杆菌中,PCR、测序鉴定。
1.2.5 标准曲线的建立 20μL反应体系,SYBR GreenⅠ10μL,DryII 0.4μL,InvAF(20pmol/μL)0.4μL,InvAR(20pmol/μL)0.4μL,1.2.2.1产物 2.0μL,无菌三蒸水6.8μL;反应程序为95℃ 2min;95℃ 15s,58℃ 20s,72℃ 30s,80℃ 35s,30个循环;95℃ 15s,60℃ 2min,95℃15s。反应结束后,ABI7500型荧光定量PCR扩增仪自动记录结果。
将正确的重组的标准参照物(质粒)以10倍的倍比关系作一系列稀释,以不同稀释浓度的标准参照物作为模板,用所设计的引物进行荧光定量PCR扩增,以浓度的对数和相应的阈值循环数(Threshold cycle,Ct)为相应的X轴、Y轴制作标准曲线。
1.2.6 特异性检测 用所设计的invA引物对沙门氏菌、大肠杆菌、金黄色葡萄球菌的纯培养物菌液的基因组DNA进行荧光定量PCR,以验证所选引物的特异性。反应条件同1.2.3。
1.2.7 敏感性检测 取沙门氏菌培养液,作10倍比稀释,琼脂平板培养计数法测定浓度,并取不同浓度稀释液,进行荧光定量PCR扩增,确定检测下线测定。
1.2.8 重复性检测
1.2.8.1 组内重复性 对同一样本DNA设置20管,同时上机进行荧光PCR重复性的检测。
1.2.8.2 组间重复性 重组质粒10倍递增稀释样本检测后置于-20℃保存30d后重新进行荧光PCR检测。
2 结果与分析
2.1 沙门氏菌invA基因PCR扩增与测序
常规PCR(图1)中明显可见约188bp大小片段,结果与预期大小一致,PCR扩增产物连接在pMD18-T载体上,命名为pMD18-T-invA。
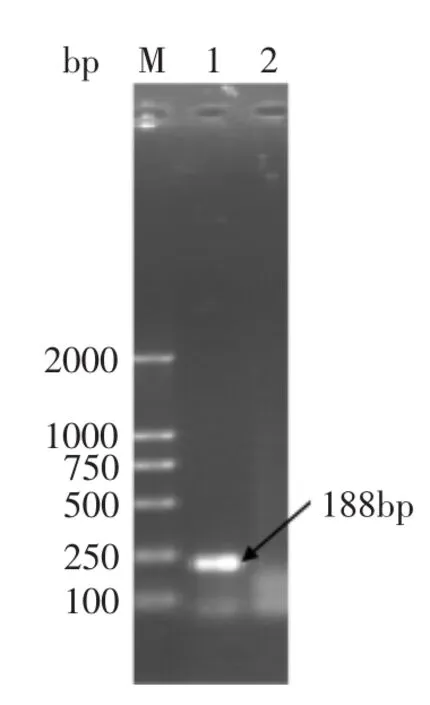
图1 invA基因PCR扩增电泳图Fig.1 The electrophoretogram of PCR amplification of invA gene
扩增片段测序结果为:TCATTCCTTACCTACCTA TCTGGTTGATTTCCTGATCGCACTGAATATCGTACT GGCGATATTGGTGTTTATGGGGTCGTTCTACATTGA CAGAATCCTCAGTTTTTCAACGTTTCCTGCGGTACT GTTAATTACCACGCTATTTCGTCTGGCATTATCGAT CAGTACGAGGAGGTGGTGGGGTTTGT。
2.2 invA基因荧光定量标准曲线的建立
2.2.1 扩增动力学曲线 将invA基因重组质粒以10倍的倍比关系作一系列稀释,当重组质粒DNA稀释度在10-2~10-8时,具有较好的线性关系,10-3、10-4、10-5、10-6四浓度摸板扩增后的动力学曲线见图2。
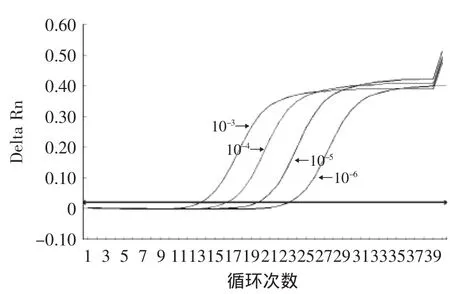
图2 invA基因扩增动力学曲线Fig.2 Amplification curve of invA
2.2.2 invA基因荧光定量标准曲线 图3中,横坐标为各基因重组质粒梯度稀释对应拷贝数的对数值,纵坐标为达到荧光域值所需的反应循环数即阈值循环数(Threshold cycle,Ct)。invA基因重组质粒的标准曲线为:y=-3.24x+32.73,相关系数r2分别为0.9981,标准曲线斜率为-3.24。

图3 invA基因标准曲线Fig3 Standard curve of invA
2.3 荧光定量PCR的特异性
对沙门氏菌、大肠杆菌、金黄色葡萄球菌进行荧光PCR检测,只有沙门氏菌出现特异性扩增,其他相关病原(大肠杆菌、金黄色葡萄球菌)并未有扩增,表明本方法特异性良好。
2.4 荧光定量PCR的敏感性
琼脂平板培养计数法测定沙门氏菌培养液浓度,10倍梯度稀释,取不同浓度稀释液,进行荧光定量PCR扩增,结果显示其检测下线为101CFU/mL。
2.5 荧光定量PCR的重复性
2.5.1 组内重复性 对同一样本设置20管重复同时检测,结果见表1,CT值变异系数为0.96%。说明组内重复性良好。
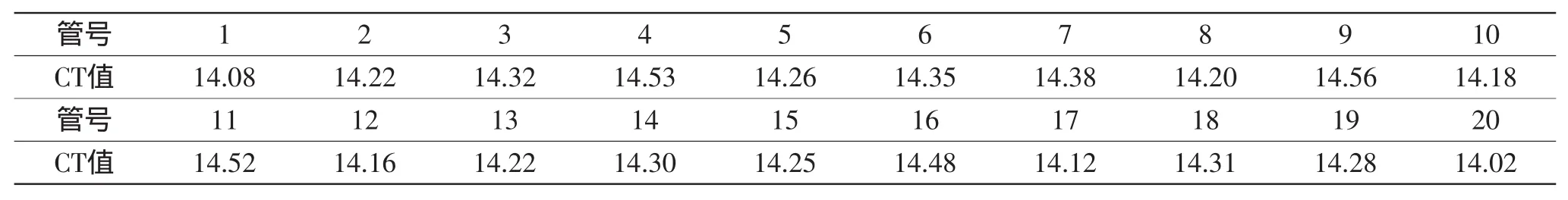
表1 组内重复性实验Table 1 Repeatability test in the group
2.5.2 组间重复性 隔30d检测同一样本10倍稀释后检测,结果见表2,经成对数据平均数比较假设检验,无显著差异(p≤0.01)。

表2 组间重复性实验Table 2 Repeatability test between groups
3 结论与讨论
引物直接影响到方法的特异性与灵敏度。由于invA基因较长,具有许多重复序列,为引物的设计增加了难度。为了保证该方法的特异性,从GenBank上下载了大量invA基因序列,通过文献及序列比较,设计了该基因的引物。为保证方法的灵敏度和扩增效率,获得检测最低Ct值和最高荧光强度值,在前期对荧光定量PCR方法Mg2+浓度、引物、探针浓度和Tm温度优化的基础上,本研究建立了检测肉制品中沙门氏菌的荧光定量PCR方法,同时也进行了一步荧光定量PCR实验。
本研究建立了一种快速、敏感、准确检测肉制品中沙门氏菌的SYBR Green实时荧光定量PCR方法。该方法从核酸提取至检测完成,仅需3h左右,且实行完全闭管式操作,从根本上杜绝了常规PCR扩增产物污染和假阳性的问题。经过大量的临床验证表明,该检测方法敏感、特异,操作方便简单,花费时间短,适用于临床样品的检测。今后的研究方向应放在用酶颗粒代替各种酶成分[13-14],该方法特异敏感,避免了再污染,具有广阔的临床应用前景。
[1]Centers for Disease Control and Prevention(CDC).Multistate outbreaks of Salmonella infections associated with raw tomatoes eaten in restaurants-United States,2005-2006[J].MMWR Morb Mortal Wkly Rep,2007,56(35):11-909.
[2]LY KT,CASANOVA JE.Mechanisms of Salmonella entry into host cells.Cell[J].Microbiol,2007,9(9):11-2103.
[3]MAJTAN J,MAJTANOVA L,XU M,et al.In vitro effect of subinhibitory concentrations of antibiotics on biofilm formation by clinical strains of Salmonella enterica serovar Typhimurium isolated in Slovakia[J].J Appl Microbiol,2008,104(5):301-1294.
[4]MOSSONG J,MARQUES P,RAGIMBEAU C,et al.Outbreaks of monophasic Salmonella enterica serovar in Luxembourg[J].Euro Surveill,2007,12(6):2-E11.
[5]STEPHENS N,SAULT C,FIRESTONE SM,et al.Large outbreaks of Salmonella Typhimurium phage type 135 infections associated with the consumption of products containing raw egg in Tasmania[J].Commun Dis Intell,2007,31(1):24-118.
[6]TOYOFUKU H,KUBOTA K,MORIKAWA K.Outbreaks of Salmonella in infants associated with powdered infant formula[J].Kokuritsu Iyakuhin Shokuhin Eisei Kenkyusho Hokoku,2006,(124):9-74.
[7]DOMINGUEZ A,TORNER N,RUIZ,et al.Foodborne Salmonella-caused outbreaks in Catalonia(Spain),1990 to 2003[J].J Food Prot,2007,70(1):13-209.
[8]DOUBLET B,WEILL FX,FABRE L,et al.Variant Salmonella genomic island 1 antibiotic resistance gene cluster containing a novel 3’-N-aminoglycoside acetyltransferase gene cassette,aac(3)-Id,in Salmonella enterica serovar newport[J].Antimicrob Agents Chemother,2004,48(10):12-3806.
[9]EAVES DJ,RANDALL L,GRAY DT,et al.Prevalence of mutations within the quinolone resistance-determining region of gyrA,gyrB,parC,and parE and association with antibiotic resistance in quinolone-resistant Salmonella enterica[J].Antimicrob Agents Chemother,2004,48(10):5-4012.
[10]王茂起,冉陆,王竹天,等.2001年中国食源性致病菌及其耐药性主动监测研究.卫生研究[J].2004,33(1):49-54.
[11]GULIG PA.Virulence plasmids of Salmonella typhimurium and other Salmonellae[J].Microb Pathog,1990,8(1):3-11.
[12]HACK CJ.Integrated transcriptome and proteome data:the challenges ahead[J].Brief Funct Genomic Proteomic,2004,3(3):9-212.
[13]STEPHENS N,SAULT C,FIRESTONE SM,et al.Large outbreaks of Salmonella Typhimurium phage type 135 infections associated with the consumption of products containing raw egg in Tasmania[J].Commun Dis Intell,2007,31(1):24-118.
[14]JACKSON EE,ERTEN ES,MADDI N,et al.Detection and enumeration of four foodborne pathogens in raw commingled silo milk in the United States[J].J Food Prot.2012,75(8):93-1382.
