N-乙酰半胱氨酸对重症急性胰腺炎肠屏障作用的实验研究
2013-12-01汪润芝何池义刘银华汪佑霞刘少锋
汪润芝,韩 真,何池义,刘银华,汪佑霞,刘少锋
(皖南医学院附属弋矶山医院 消化内科,安徽 芜湖 241001)
重症急性胰腺炎(severe acute pancreatitis,SAP)是消化系疾病的危重症,临床病死率常高达10% ~20%,甚至超过30%[1]。其病情演变过程十分复杂,随着近年来深入的研究,肠屏障功能 (intestinal barrier function,IBF)损伤在SAP中的作用逐渐被认识,目前认为IBF破坏诱发和加重了SAP时全身炎症反应综合征(systemic inflammatory response syndrome,SIRS)并引起多器官功能障碍综合征(multiple organ dysfunction syndrome,MODS),是导致 死 亡 的 主 要 原 因[1-3]。N-乙 酰 半 胱 氨 酸(NAC)是一种抗氧化剂和体内活性氧自由基清除剂,国内外研究发现其可对肠缺血再灌注、炎症性肠病、创伤、感染等多种疾病相关的肠屏障功能障碍起到有效的防治作用[4-5]。本研究通过NAC干预探讨其对SAP大鼠肠屏障损害时的作用及其机制。
1 材料和方法
1.1 实验动物及试剂 54只健康清洁级SD雄性大鼠,体重(240±20)g,浙江省实验动物中心提供,许可证号[scxk(浙)20080033]。97%牛磺胆酸钠购于上海晶纯试剂有限公司。NAC购于杭州民生药业集团有限公司。DAO、SOD、MDA及GSH试剂盒购于南京建成生物工程研究所。
1.2 分组与模型制备 54只SD雄性大鼠正常适应性喂养1周后随机分为3组,假手术(Sham)组、NAC+SAP组和SAP组,每组18只。所有大鼠术前禁食12 h,不禁水。采用3%戊巴比妥钠溶液 (40 mg/kg)腹腔麻醉,严格无菌条件下,上腹正中切口进腹。SAP组,找到胆胰管,在肝门端以动脉夹暂时阻闭胆管,找到胆胰管汇入十二指肠乳头处,4号头皮静脉针于十二指肠乳头附近穿刺十二指肠壁,逆行刺入胆胰管内并固定,于胆胰管入十二指肠端用小动脉夹暂时阻闭胆胰管,以0.2 ml/min的速度向胆胰管内逆行推注50 g/L牛磺胆酸钠溶液(1 ml/kg),注射完毕后10 min去除动脉夹,逐层关腹,建立SAP模型。NAC+SAP组,建模前2 h先给予腹腔注射NAC 300 mg/kg。Sham组,开腹后仅翻动十二指肠和胰腺。3组大鼠术后10 min均尾静脉注射5 ml/kg体质量的生理盐水,以补充术中丢失的液体,术后禁食,自由饮水。各组大鼠于术后6、12、24 h注射致死剂量的戊巴比妥钠(200 mg/kg)分批处死,每批6只。
1.3 检测指标及方法
1.3.1 组织形态学观察 严格无菌条件下迅速打开腹腔,取胰相同部位标本2 cm左右,40 g/L甲醛溶液固定,修剪、脱脂、石蜡包埋和切片,HE染色,光镜下观察胰腺组织病理改变。取出小肠并用预冷的0.9%NaCl溶液冲洗。取末端回肠标本2 cm,40 g/L甲醛溶液固定,修剪、脱脂、石蜡包埋和切片,HE染色,光镜下观察小肠组织形态学改变。
1.3.2 血液检测指标 取腹主动脉血5 ml,4℃2 500 r/min离心10 min分离血浆,收集血浆置-70℃冰箱保存,活性比色法定量检测血清二胺氧化酶(DAO),全自动生化仪测定血淀粉酶(AMY),均按照试剂盒说明书进行。
1.3.3 小肠组织氧化还原酶活性测定 取末端回肠组织4 cm,用预冷的0.9%NaCl溶液再次冲洗,滤纸吸干称量,加入9倍体积的0.9%NaCl溶液,冷水浴中用眼科剪尽快剪碎,并在玻璃匀浆管中手工匀浆,制成小肠匀浆,高速冷冻离心机4℃ 先用600 r/min离心10 min后,取上清液于10 000 r/min离心20 min,最后再取上清液-70℃低温保存,测SOD、MDA、GSH的活性,按照试剂盒说明书进行。
1.4 统计分析方法 数据应用SPSS 15.0统计软件分析,计量数据用均数±标准差(±s)描述,多组间计量资料比较采用F检验,两两比较采用q检验。
2 结果
2.1 组织学变化 光镜下,Sham组大鼠胰腺小叶结构清晰,无异常改变,回肠绒毛结构完整。而SAP组大鼠各时间点胰腺有不同程度的水肿、片状出血,并见胰腺实质和脂肪坏死及炎症细胞浸润;末端回肠黏膜均有不同程度水肿,绒毛稀疏、炎性细胞浸润,上皮细胞脱落,上皮结构完整性遭到破坏,黏膜下层血管扩张,随着建模时间的延长,改变更加明显。NAC+SAP组可见胰腺渗出、坏死和炎症细胞浸润较SAP组减轻;末端回肠黏膜绒毛略有减少、少量炎性细胞浸润和上皮细胞脱落,小肠结构的完整性较SAP组有改善。
2.2 各组大鼠不同时间点血清AMY和DAO的水平 SAP组、NAC+SAP组的血清AMY水平各时点与Sham组比较均明显增高(P<0.01);SAP组12、24 h的AMY水平较6 h时增高明显(P<0.05);NAC+SAP组各时间点间血清AMY水平无明显变化(P>0.05),见表1。SAP组各时间点血清DAO均高于 Sham组,以12 h和24 h增高明显(P<0.05)。NAC+SAP组各时间点血清DAO水平与Sham组比较,有明显增高(P<0.05);其6 h时间点血清DAO水平与SAP组同时间点无明显变化(P>0.05),而12、24 h时间点较SAP组同时间点显著降低(P<0.05),尤其是24 h时间点较同组6、12 h时间点有显著降低(P<0.05,见表2)。
表1 各组大鼠不同时间点血清淀粉酶水平比较(U/L,±s)Tab 1Comparison of the blood levels of AMY at distinct time points in different groups of rats(U/L,±s)

表1 各组大鼠不同时间点血清淀粉酶水平比较(U/L,±s)Tab 1Comparison of the blood levels of AMY at distinct time points in different groups of rats(U/L,±s)
a与Sham组同时间点比较P<0.05;b与SAP组同时间点比较P<0.05;c与组内6 h时间点比较P<0.05
组别 6 h(n=6)12 h(n=6)24 h(n=6)F P Sham 组 1 200.83 ±240.29 1 552.00 ±434.66 1 124.67 ±153 0.000 0.000 0.000.87 3.459 0.058 SAP 组 6 065.17 ±1 215.37a 8 155.50 ±832.26ac 9 243.67 ±1 921.42ac 5.509 0.016 NAC+SAP 组 5 554.67 ±856.61a 5 192.50 ±699.87ab 4 743.00 ±1 150.89ab 1.168 0.338 F 56.701 48.791 59.086 P
表2 各组大鼠不同时间点血清二胺氧化酶水平比较(U/ml,±s)Tab 2Comparison of the blood levels of DAO at distinct time points in different groups of rats(U/ml,±s)

表2 各组大鼠不同时间点血清二胺氧化酶水平比较(U/ml,±s)Tab 2Comparison of the blood levels of DAO at distinct time points in different groups of rats(U/ml,±s)
a与Sham组同时间点比较P<0.05;b与SAP组同时间点比较P<0.05;c与组内6 h时间点比较P<0.05;d与组内12 h时间点比较P<0.05
组别 6 h(n=6)12 h(n=6)24 h(n=6)F P 0.000 0.000 0.000 0.32 ±0.10 0.28 ±0.06 0.26 ±0.03 1.310 0.299 SAP 组 1.36 ±0.14a 1.61 ±0.20ac 1.67 ±0.22ac 4.730 0.026 NAC+SAP 组 1.33 ±0.16a 1.25 ±0.23ab 0.95 ±0.12abcd 7.766 0.005 F 112.234 88.188 139.661 P Sham组
2.3 小肠组织氧化还原酶活性测定结果 SAP组和NAC+SAP组的小肠组织中SOD和GSH水平与Sham组比较均明显降低(P<0.05)。随着时间延长SAP组内小肠组织中SOD和GSH水平进一步下降,以24 h时间点明显(P<0.05)。NAC+SAP组的小肠组织中SOD和GSH水平在6 h时间点与SAP组比较无明显变化(P>0.05),但12 h及24 h时间点明显增高(P<0.05);组内12 h与24 h时间点小肠组织中SOD水平比较无差异(P>0.05),但均较6 h时间点升高(P<0.05);而24 h时间点GSH水平较12 h明显升高(P<0.05);SAP组和NAC+SAP组的小肠组织中MDA水平与Sham组比较均明显增高(P<0.05);SAP组24 h时间点较6、12 h时间点明显升高(P<0.05),NAC+SAP组的小肠组织中MDA水平在6 h时间点与SAP组比较无明显变化(P>0.05),但12 h及24 h时间点降低明显(P<0.05,见表3 ~5)。
表3 各组小肠组织匀浆SOD活性的变化(U/mgprot,±s)Tab 3Changes of SOD levels in small intestine tissue in different groups of rats(U/mgprot,±s)

表3 各组小肠组织匀浆SOD活性的变化(U/mgprot,±s)Tab 3Changes of SOD levels in small intestine tissue in different groups of rats(U/mgprot,±s)
a与Sham组同时间点比较P<0.05;b与SAP组同时间点比较P<0.05;c与组内6 h时间点比较P<0.05
组别 6 h(n=6)12 h(n=6)24 h(n=6)F P Sham 组 32.62 ±4.04 32.18 ±3.71 30.83 ±3.54 0.367 0.699 0.000 0.000 0.000 SAP 组 17.33 ±2.49a 14.40 ±2.33ac 12.72 ±2.15ac 6.023 0.012 NAC+SAP 组 17.26 ±3.02a 25.30 ±3.42abc 25.20 ±3.09abc 12.582 0.001 F 44.523 46.780 57.788 P
表4 各组小肠组织匀浆GSH含量的变化(mg/gprot,±s)Tab 4Variation of GSH levels in small intestine tissue in different groups of rats(mg/gprot,±s)
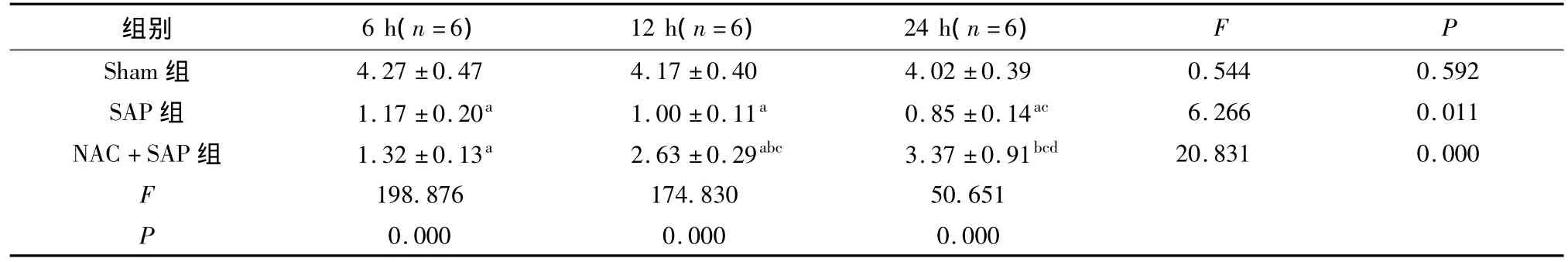
表4 各组小肠组织匀浆GSH含量的变化(mg/gprot,±s)Tab 4Variation of GSH levels in small intestine tissue in different groups of rats(mg/gprot,±s)
a与Sham组同时间点比较P<0.05;b与SAP组同时间点比较P<0.05;c与组内6 h时间点比较P<0.05;d与组内12 h时间点比较P<0.05
组别 6 h(n=6)12 h(n=6)24 h(n=6)F P 0.000 0.000 0.000 4.27 ±0.47 4.17 ±0.40 4.02 ±0.39 0.544 0.592 SAP 组 1.17 ±0.20a 1.00 ±0.11a 0.85 ±0.14ac 6.266 0.011 NAC+SAP 组 1.32 ±0.13a 2.63 ±0.29abc 3.37 ±0.91bcd 20.831 0.000 F 198.876 174.830 50.651 P Sham组
表5 各组小肠组织匀浆MDA含量的变化(nmol/mgprot,±s)Tab 5Variation of MDA levels in small intestine tissue in different groups of rats(nmol/mgprot,±s)

表5 各组小肠组织匀浆MDA含量的变化(nmol/mgprot,±s)Tab 5Variation of MDA levels in small intestine tissue in different groups of rats(nmol/mgprot,±s)
a与Sham组同时间点比较P<0.05;b与SAP组同时间点比较P<0.05;c与组内6h时间点比较P<0.05;d与组内12 h时间点比较P<0.05
组别 6 h(n=6)12 h(n=6)24 h(n=6)F P 0.000 0.000 0.000 0.44 ±0.04 0.46 ±0.06 0.49 ±0.08 0.950 0.409 SAP 组 1.76 ±0.20a 1.84 ±0.24a 2.20 ±0.24acd 6.179 0.011 NAC+SAP 组 1.72 ±0.18a 1.14 ±0.17abc 0.93 ±0.15abcd 36.177 0.000 F 139.248 92.860 161.656 P Sham组
3 讨论
重症急性胰腺炎发病凶险,并发症多,病死率高,而其中20% ~80%的死亡原因与SAP时肠道屏障功能受损、细菌移位,并发器官功能衰竭有关[6-7]。SAP时由于微循环障碍和缺血再灌注损伤、炎症介质的过度释放、肠上皮细胞凋亡以及肠道营养缺乏等导致肠屏障功能受损。肠屏障功能损害时肠道细菌和内毒素的易位进一步刺激已活化的单核巨噬细胞,释放过量的细胞因子,引发炎症介质的“瀑布样级联反应”,导致SIRS及MODS。因此,维持肠屏障功能的完整性是改善SAP预后,降低并发症和病死率的重要措施。
SAP时肠道血流减少、缺血再灌注损伤以及释放过量的细胞因子,产生大量的氧自由基,破坏了肠道屏障。DAO是位于肠黏膜上绒毛细胞中高度活性的细胞内酶,以空、回肠活性最高,其他组织或细胞中几乎不存在。如果血浆中活性增高提示有肠屏障破坏[8]。本研究通过胆胰管内逆行推注50 g/L牛磺胆酸钠溶液建立SAP大鼠模型,检测大鼠血DAO水平发现明显升高,证明了SAP时确有肠道屏障功能受损。多项研究表明小肠细胞内氧化还原平衡在维持小肠细胞的功能及肠屏障的完整性方面起着重要的作用。氧化应激发生时,自由基产生和清除之间的生理平衡被打破,结果是一些过氧化物质增加[4-5,9],如 MDA 是脂质过氧化的最终产物,组织中MDA含量可直接客观地反映脂质过氧化的程度[10]。而SOD是机体抗氧化损伤防御体系中最重要的抗氧化酶,GSH是由谷氨酸、半胱氨酸、甘氨酸组成的三肽化合物,是细胞重要的稳定性保护因子,小肠组织中SOD和GSH水平下降,反应肠道抗氧化能力的降低。本研究检测了SAP大鼠小肠组织中SOD、GSH和MDA水平,结果发现肠组织中SOD和GSH水平均明显降低;MDA水平明显增高(P<0.05),证明了SAP时小肠组织发生了氧化还原功能失调,从而导致了肠屏障功能的破坏。
NAC为左旋精氨酸的天然衍生物,是一种抗氧化剂及体内活性氧自由基清除剂。国内外研究发现NAC通过其强有力的抗氧化作用,可对肠缺血再灌注、炎症性肠病、烧伤、热损伤、感染等多种疾病相关的肠屏障功能障碍起到有效的防治作用[4-5,11]。本研究在大鼠SAP建模前2 h先给予腹腔注射NAC,发现经过NAC预处理的大鼠,胰腺实质及脂肪组织坏死减轻,中性粒细胞浸润减少。末端回肠结构的完整性较SAP组有改善,12 h后血清淀粉酶、DAO水平较SAP组同时间点显著降低(P<0.05)。在6 h时间点时小肠组织中SOD、GSH和MAD水平与SAP组比较差异不明显,但12 h后SOD和GSH水平明显增高、MAD水平明显降低(P<0.05)。说明了NAC可以增加小肠组织SOD和GSH水平,减少过氧化物质的生成,维持小肠细胞内氧化还原平衡,从而减轻小肠组织损伤,能有效保护肠道屏障功能,对预防和治疗SAP继发肠黏膜屏障损害具有重要意义。
总之,重症急性胰腺炎发病凶险,死亡原因与SAP时肠道屏障功能受损细菌移位等有关,本研究发现NAC预防和治疗SAP大鼠继发的肠黏膜屏障损害具有重要意义,为临床上NAC预防和治疗SAP时肠屏障功能受损提供理论基础。
[1]BALZAN S,DE ALMEIDA QUADROS C,DE CLEVA R,et al.Bacterial translocation:overview of mechanisms and clinical impact[J].J Gastroenterol Hepatol,2007,22(4):464 -471.
[2]KOUSSOULAS V,TZIVRAS M,KARAGIANNI V,et al.Monocytes in systematic inflammatory response syndrome:diferences between sepsis and acute pancreatitis[J].World J Gastroenteml,2006,12(41):6711-6714.
[3]MOLE DJ,TAYLOR MA,MCFERRAN NV,et al.The isolated perfused liver response to a 'second hit'of portal endotoxin during severe acute pancreatitis[J].Pancreatology,2005,5(4 - 5):475 -485.
[4]王瑜,张再重,陈少全,等.N-乙酰半胱氨酸对大鼠小肠辐射损伤的防护作用[J].第二军医大学学报,2008,29(6):65I-654.
[5]邹忠东,张再重,王瑜,等.N-乙酰半胱氨酸对重症急性胰腺炎大鼠肠道屏障功能障碍与二次打击的保护作用[J].中华实验外科杂志,2009,26(1):64 -65.
[6]RAHMAN SH,AMMORI BJ,HOLMFIELD J,et al.Intestinal hypoperfusion contributes to gut barrier failure in severe acute pancreatitis[J].J Gastrointest Surg,2003,7(1):26 -35.
[7]CARNOVALE A,RABITTI PG,MANES G,et al.Mortality in acute pancreatitis:is it an early or a late event[J].JOP,2005,6:438 -444.
[8]中华医学会消化病学分会.肠屏障功能障碍临床诊治建议[J].中华消化杂志,2006,26(9):620.
[9]OLIVER SR,PHILLIPS NA,NOVOSAD VL,et al.Hyperthermia induces injury to the intestinal mucosa in the mouse:evidence for an oxidative stress mechanism[J].Am J Physiol Regul Integr Comp Physiol,2012,302(7):R845 - 853.
[10]OLGAC V,ERBIL Y,BARBAROS U,et aI.The efficacy of octreotide in pancreatic and intestinal changes:radiation-induced enteritis in animals[J].Dig Dis Sci,2006,51:227 -232.
[11]王瑜,张再重,陈少全,等.N-乙酰半胱氨酸对大鼠辐射损伤相关肠屏障功能障碍的防护作用[J].中华胃肠外科杂志,2010,13(3):219-222.
