粉尘螨主要变应原基因Der f 1和Der f 3改组的研究
2013-12-01姜玉新马玉成刘志明李朝品
姜玉新,郭 伟,马玉成,刘志明,陈 琪,李朝品
(皖南医学院 1.生理学教研室,2.医学寄生虫学教研室,安徽 芜湖 241002)
过敏性疾病(变态反应性疾病)被WHO认为是当前世界性的重大卫生学问题之一,总发病率为10% ~30%,并呈逐年增加的趋势,其中以粉螨为致敏原引起的慢性气道炎症所致的螨性过敏性哮喘尤为常见[1],主要包括麦食螨科(Pyroglyphidae)的屋尘螨(Dermatophagoides pteronyssinus)、粉尘螨(Dermatophagoides farinae)和梅氏嗜霉螨(Euroglyphus maynei)等,其中1、2、3类变应原是诱导哮喘与变态反应性疾病的最重要变应原[2]。变应原特异性免疫治疗(allergen special immunotherapy,ASIT)是目前唯一可改变变态反应性疾病自然进程的病因疗法[3]。重组变应原疫苗与天然变应原浸液相比,不仅降低患者变应原特异性IgE的反应性,同时也保留了T细胞的活性表位,因此具有高免疫原性和低变应原性的特点。DNA改组(DNA shuffling)技术,也称有性PCR(sexual PCR)、分子育种(molecular breeding),该技术通过改变单个基因或基因家族(gene family)原有的核苷酸序列创造新的基因,并赋予表达产物以新功能[4]。如应用DNA shuffling技术可提高绿色荧光蛋白的荧光强度[5]、抗体的表达水平和亲和性[6]、枯草菌素E的热稳定性[7]以及干扰素的抗病毒作用[8]等。但应用DNA shuffling技术来改组粉尘螨主要变应原Der f 1和Der f 3基因并获得重组基因尚未见报道。本研究探索在不同酶切条件下,应用DNA改组技术对粉尘螨变应原基因Der f 1和Der f 3间进行基因重组,以期获得突变融合基因,为制备高效低价的哮喘疫苗奠定基础。
1 材料与方法
1.1 材料、试剂与仪器
1.1.1 粉尘螨 从芜湖某面粉厂的地角粉中分离获得,经形态学鉴定证实为粉尘螨,分离纯化并进行大规模培养。
1.1.2 引物 根据GenBank公布的粉尘螨Der f 1(Accession number:EU095368.1)、Der f 2(Accession number:FJ436110.1)和Der f 3 cDNA(Accession number:FJ436101.1)序列分别设计三对特异性引物,由生工生物工程(上海)有限公司合成。引物序列如下:Der f 1上游引物:AGC GCT TGC CGT ATC AAT TCG GTT,Der f 1下游引物:GAG GTT GTT TCC GGC TTG GAA ATA;Der f 2上游引物:ATT TCC AAA ATC TTG TGC CT,Der f 2下游引物:TTA ATC ACG GAT TTT ACC ATG GG;Der f 3上游引物:ACT ATC GAT AAT GAT GTT GCA TT,Der f 3 下游引物:CTG TGA ACG TTT TGA TTC AAT CC,由生工生物工程(上海)有限公司合成。扩增片段长度分别为 627 bp、438 bp、456 bp。
1.1.3 工具酶 Taq DNA聚合酶购自生工生物工程(上海)有限公司;DNaseⅠ购自Promega公司。
1.1.4 主要试剂 Trizol®购自Invitrogen公司;MMLV first strand cDNA synthesis Kit购自BBI(加拿大)公司;SanPrep柱式DNA胶回收试剂盒、PCR扩增试剂盒、SanPrep柱式PCR产物纯化试剂盒、100 bp DNA ladder购自生工生物工程(上海)有限公司;琼脂糖购自Amresco公司;其他试剂均为国产分析纯。
1.1.5 主要仪器 ABI2720型PCR仪、Beckman高速冷冻离心机、赛多利斯电子天平、Bio-Rad水平电泳仪、水浴锅、超净工作台、细菌培养箱、ImageMas terTM凝胶电泳成像分析系统。
1.2 方法
1.2.1 Der f 1、Der f 2和Der f 3基因的克隆 500只粉尘螨用Trizol®一步法提取其总RNA,以此为模板进行反转录获得其cDNA,按照说明书操作。以反转录获得的 cDNA为模板,进行PCR扩增,50 μl反应体系如下:cDNA 2 μl,10 × Ex Taq Buffer 5 μl,2.5 mmol/L dNTP 4 μl,Der f 1(Der f 2/Der f 3)上游引物1 μl(20 pmol/μl),Der f 1(Der f 2/Der f 3)下游引物 1 μl(20 pmol/μl),Ex Taq 酶 0.5 μl(5 U/μl),ddH2O 36.5 μl;PCR 反应条件:94 ℃ 变性4 min,94 ℃变性20 s,52 ℃ 复性30 s,72 ℃ 延伸1 min,进行35个循环,72℃延伸10 min。PCR产物用1.0%琼脂糖凝胶电泳,ImageMasterTM电泳成像装置观察并拍照,所获序列由生工生物工程(上海)有限公司测序。
1.2.2 Der f 1和Der f 3基因的同源性分析 使用DNAMAN软件,对获得的Der f 1和Der f 3基因序列进行同源性分析。
1.2.3 DNaseⅠ的消化 纯化后Der f 1 PCR产物1 μl,用DNaseⅠ进行酶切,室温(22℃)下分别反应10、15、20、25 和 30 min,65 ℃酶灭活。同样条件下分别酶切Der f 3基因,酶切产物分别行1.0%琼脂糖凝胶电泳。
1.2.4 DNA改组 无引物PCR:100 μl PCR体系(10 × Buffer 10 μl,MgCl27 μl,dNTPs 1 μl,Der f 1 和Der f 3酶切相同时间产物各2 μl混匀,Taq DNA聚合酶 1 μl,ddH2O 78 μl)反应条件:94 ℃变性 1 min后,94℃1 min,52℃1 min,72℃1 min进行35个循环,72℃延伸2 min。PCR产物1%琼脂糖凝胶进行电泳并拍照。
有引物PCR:100 μl PCR体系(10×缓冲液10 μl,MgCl27 μl,dNTPs 1 μl,上述无引物 PCR 产物模板 2 μl,Taq DNA 聚合酶 1 μl,上下游引物(组合见表 1)各 1 μl,ddH2O 78 μl)94 ℃ 变性 4 min,94 ℃1 min,52℃1 min,72℃1 min进行35个循环,72℃延伸10 min。PCR产物进行1%琼脂糖凝胶电泳并拍照。
2 结果
2.1 Der f 1、Der f 2和Der f 3的PCR结果 RTPCR结果表明:Der f 1、Der f 2、Der f 3均出现清晰条带,大小分别为 627 bp、438 bp、456 bp,与预期值相一致(图1);测序后应用DNAMAN软件分析表明,Der f 1和Der f 3基因的同源性为32.33%(图2)。
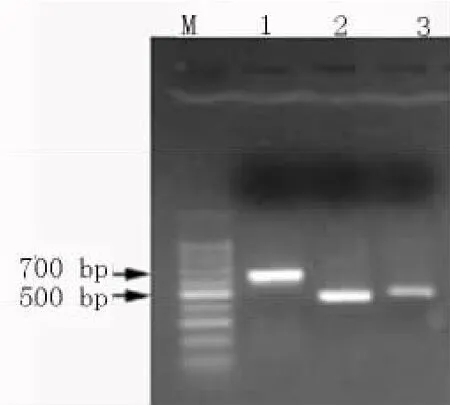
图1 Der f 1、Der f 2和Der f 3的PCR扩增结果M:DNA分子量标准;1~3:分别为Der f 1、Der f 2和Der f 3的PCR产物Fig1 PCR products of Der f 1,Der f 2 and Der f 3M:DNA ladder;1-3:PCR products of Der f 1,Der f 2 and Der f 3,respectively

图2 Der f 1和Der f 3核苷酸序列比对Fig 2 Nucleotide sequence alignment of Der f 1 and Der f 3
2.2 不同酶切时间的酶切效果 将Der f 1和Der f 3基因PCR产物各1 μl用DnaseⅠ分别酶切10、15、20、25、30 min,电泳结果显示,PCR 产物均被切断,说明酶切效果较好(图3)。
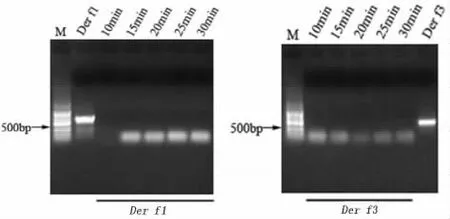
图3 Der f 1和Der f 3基因不同酶切时间的电泳结果M:100 bp DNA 分子量标准;10、15、20、25、30 min 表示不同酶切时间Fig 3 Results of different digested times of Der f 1 and Der f 3 by DnaseⅠM:100 bp DNA ladder;10,15,20,25,30 min represent different cut time using DnaseⅠ
2.3 无引物PCR结果电泳分析 分别将酶切10、15、20、25、30 min的 Der f 1 和 Der f 3 基因 PCR 产物各1 μl对应进行混合(即酶切时间相同的PCR产物混合),并进行无引物PCR扩增(不加任何引物,根据基因酶切片段的同源性进行重组),电泳结果显示,虽然仍无目的条带产生(理论值在438 bp~627 bp之间),但其亮度已增强(图4),说明无引物PCR已产生大量的重组条带。
2.4 不同引物PCR扩增电泳分析 分别以不同酶切时间的无引物PCR产物为模板,以不同的引物(包括 Der f 1 F、Der f 1 R、Der f 2 F、Der f 2 R、Der f 3 F和Der f 3 R)进行PCR扩增,研究结果表明:以Der f 1 F和Der f 1 R、Der f 1 F和Der f 2 R、Der f 1 F和Der f 3 R为引物分别在酶切10 min、15 min、20 min、25 min、30 min 均无条带出现(图 5);以 Der f 2 F和Der f 2 R为引物在酶切15 min、20 min、25 min和30 min的模板中扩增出清晰的PCR片段,以Der f 2 F和Der f 3 R为引物仅在酶切10 min、15 min、25 min扩增出模糊条带,Der f 2 F和Der f 1 R为引物在酶切 10 min、15 min、20 min、25 min、30 min 均无条带出现(图6);在以Der f 3 F和Der f 1 R为引物在酶切10 min、15 min、25 min和30 min的模板中分别扩增出模糊条带,Der f 3 F和Der f 2 R为引物仅在酶切10 min的模板中分别扩增出清晰条带,而以Der f 3 F和Der f 3 R为引物分别在酶切15 min、20 min、25 min时出现清晰条带(图7),总体情况如下表(表1)。因此,在Der f 1和Der f 3改组过程中,以Der f 2 F+Der f 2 R为引物可扩增出目的基因;以 Der f 2 F+Der f 3 R、Der f 3 F+Der f 1 R、Der f 3 F+Der f 2 R、Der f 3 F+Der f 3 R为引物也可扩增出少量目的基因,但要受酶切条件的影响。
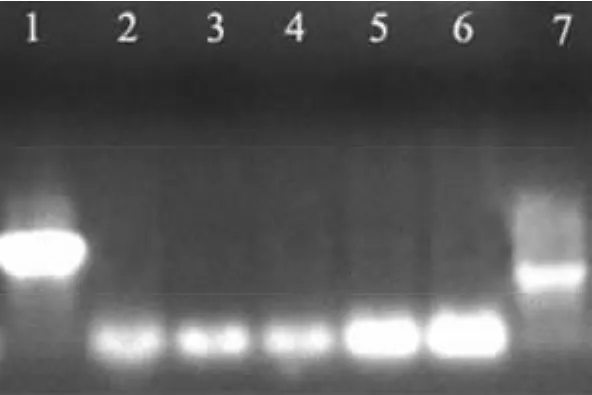
图4 Der f 1和Der f 3相同时间酶切产物混合后的无引物PCR电泳结果1:Der f 1;2 ~6:分别表示10、15、20、25、30 min 酶切时间;7:Der f 3Fig 4 Non-primer results of product mixtures from Der f 1 and Der f 3 at the corresponding time point by DnaseⅠdigestion1:Der f 1;2-6:represent different digested time using DnaseⅠ 10,15,20,25,30 min,respectively;7:Der f 3

图5 Der f 1 F和 Der f 1 R、Der f 1 F和 Der f 2 R、Der f 1 F和Der f 3 R为引物分别扩增的重组子的PCR结果Fig 5 PCR results of recombinant fragments using Der f 1 F and Der f 1 R,Der f 1 F and Der f 2 R,Der f 1 F and Der f 3 R,respectively

图6 Der f 2 F和 Der f 1 R、Der f 2 F和 Der f 2 R、Der f 2 F和Der f 3 R为引物分别扩增的重组子的PCR结果Fig 6 PCR results of recombinant fragments using Der f 2 F and Der f 1 R,Der f 2 F and Der f 2 R,Der f 2 F and Der f 3 R as primers,respectively
3 讨论
过敏性疾病是一种慢性呼吸道炎症性疾病,其中螨性过敏性哮喘在临床上尤为常见[1],粉尘螨变应原Der f 1、Der f 2和Der f 3是诱导哮喘与变态反应性疾病的最重要变应原之一[9]。变应原特异性免疫治疗(allergen special immunotherapy,ASIT)又称脱敏治疗,是目前过敏性疾病的唯一病因治疗[3],但WHO和欧洲变态反应与临床免疫学会认为变应原不明确的过敏患者不宜进行特异性免疫治疗,且变应原的制备必须标准化[10]。因此,筛选高免疫原性和低变应原性的疫苗,是治疗螨性过敏性哮喘的重要手段之一。重组变应原疫苗与天然变应原浸液相比,不仅保留了T细胞的活性表位,同时也降低患者变应原特异性IgE的反应性。近年来,国内外研究机构应用分子生物学及基因工程已对尘螨变应原进行了克隆[11-14]。本研究根据GenBank公布的序列设计特异性引物并进行了RT-PCR,结果表明,已成功克隆出粉尘螨变应原基因Der f 1、Der f 2和 Der f 3。

图7 Der f 3 F和 Der f 1 R、Der f 3 F和 Der f 2 R、Der f 3 F和Der f 3 R为引物分别扩增的重组子的PCR结果Fig 7 PCR results of recombinant fragments using Der f 3 F and Der f 1 R,Der f 3 F and Der f 2 R,Der f 3 F and Der f 3 R as primers,respectively

表1 不同引物组合以不同酶切时间后的产物为模板PCR扩增的整体情况Tab 1 Overall results by PCR amplification on the templates based on different digested time through different primers combination
DNA改组技术是根据基因同源性的基础上而进行的体外分子进化技术,可获得新基因并可能赋予表达产物以新的功能,从而可用于识别因病原体(包括病毒、细菌和寄生虫)等为适应生存出现免疫逃避反应而产生的新突变体(抗原或抗体),提高了宿主的免疫原性[15]。DNA改组条件的优化对重组粉尘螨变应原的免疫原性的提高以及变应原性的降低是首要因素[16]。Gafvelin 等[17]对来自不同尘螨的变应原同源基因Lep d 2和Gly d 2(二者的同源性高达接近80%)进行DNA家族改组,筛选后获得了T细胞反应性不变、但与IgE的结合能力比野生型低出约80倍的9个理想突变体。本研究对Der f 1和Der f 3的同源性分析表明,二者的同源性达30.38%;采用DnaseⅠ酶切不同的时间后,应用多种引物在不同酶切时间而产生的无引物PCR产物为模板进行扩增后,可产生不同的阳性片段,其大小与Der f 1的PCR产物大小明显不同,但以Der f 2 F+Der f 2 R为引物可扩增出大小与Der f 3相当的目的基因。说明尽管Der f 1和Der f 3的同源性较低,仍可产生重组片段,打破了传统的认为只有同源性高(>80%)的基因才能重组的概念,同时也验证了不同的酶切时间对基因改组会产生重要影响,从而为后期制备高免疫原性、低变应原性的粉尘螨变应原特异性基因工程重组疫苗以及对疾病的免疫诊断和治疗等方面奠定基础。
[1]石连,姜玉新,王海宁,等.粉尘螨变应原Der f 1基因的原核表达及多克隆抗体的制备[J].皖南医学院学报,2012,31(1):3-6.
[2]SCHOU C,LIND P.The antigenicity of house dust mites[J].Allergy,1991,46(Suppl.11):10-13.
[3]MUELLER GA,SMITH AM,CHAPMAN MD,et al.Hydrogen exchange nuclear magnetic resonance spectroscopy mapping of antibody epitopes on the house dust mite allergen Der p2 [J].J Biol Chem,2001,276(12):9359-9365.
[4]CRAMERI A,RAILLARD SA,BERMUDEZ E,et al.DNA shuffling of a family of genes from diverse species accelerates directed evolution [J].Nature,1998,391(6664):288-291.
[5]CRAMERI A,WHITEHOM EA,TATE E,et al.Improved green fluorescent protein by molecular evolution using DNA shuffling[J].Nat Biotechnol,1996,14(3):315-319.
[6]CRAMERI A,CWIRLA S,STEMMER WPC.Construction and evolution of antibody-phage libraries by DNA shuffling[J].Nat Med,1996,2(1):100-102.
[7]ZHAO H,GIVER L,SHAD Z,et al.Molecular evolution by staggered extension process(StEP)in vitrorecombination[J].Nat Biotechnol,1998,16(3):258-261.
[8]CHANG CC,CHEN TT,COX BW,et al.Evolution of a cytokine using DNA family shuffling[J].Nat Biotechnol,1999,17(8):793-797.
[9]MILIÁN E,DÍAZ AM.Allergy to house dust mites and asthma[J].P R Health Sci J,2004,23(1):47-57.
[10]BOUSQUET J,LOCKEY R,MALLING HJ.Allergen immunotherapy:therapeutic vaccines for allergic diseases.A WHO position paper[J].J Allergy Clin Immunol,1998,102(4 Pt 1):558-562.
[11]郝敏麒,徐军,钟南山.粉尘螨Ⅰ变应原(Der f 1)的cDNA克隆及序列分析[J].免疫学杂志,2001,17(3):213-215.
[12]郝敏麒,徐军,钟南山.华南地区粉尘螨主要变应原Der f 2的cDNA克隆及序列分析[J].中国寄生虫学与寄生虫病杂志,2003,21(3):160-163.
[13]杨庆贵,李朝品.粉尘螨Ⅰ类抗原cDNA的克隆表达和初步鉴定[J].免疫学杂志,2004,20(6):472-474.
[14]刘志刚,杨慧,傅颖媛,等.屋尘螨变应原Der p1基因原核表达产物的纯化及其特性鉴定[J].热带医学杂志,2006,6(6):656-659.
[15]LOCHER CP,HEINRICHS V,APT D,et al.Overcoming antigenic diversity and improving vaccines using DNA shuffling and screening technologies[J].Expert Opin Biol Ther,2004,4(4):589-597.
[16]NEGISHI T,MUKAIHARA T,MORI K,et al.Identification of a key amino acid residue of Streptomyces phospholipase D for thermostability by in vivo DNA shuffling[J].Biochim Biophys Acta,2005,1722(3):331-342.
[17]GAFVELIN G,PARMLEY S,NEIMERT-ANDERSSON T,et al.Hypoallergens for allergen-specific immunotherapy by directed molecular evolution of mite group 2 allergens[J].J Biol Chem,2007,282(6):3778-3787.
