弓形虫GRA7基因的克隆表达及免疫分析*
2013-11-26黄诗莹邱洁蕾谭栩颖杨灿洪斌陈陈晓光
黄诗莹 邱洁蕾 谭栩颖 杨灿洪 郭 斌陈 滨 吴 焜 陈晓光
(南方医科大学公共卫生与热带医学学院病原生物学系,广州 510515)
刚地弓形虫Toxoplasmagondii是一种严重危害人、畜健康的机会性致病原虫,呈世界性分布。该病的人群感染率极为普遍,全世界约有三分之一的人感染弓形虫。弓形虫能在孕期感染经胎盘引起胎儿先天性弓形虫病,导致流产、死产、畸胎等危害;获得性弓形虫病以多种组织器官损害为特点,尤其脑部和眼部为甚。对于免疫缺陷或免疫抑制者(如艾滋病或器官移植患者),弓形虫感染更是一个重要致死因素(陈晓光和郑学礼, 2008;赵焕阁等, 2011)。致密颗粒蛋白(Dense granules antigen, GRA)是弓形虫侵入宿主细胞后释放入纳虫泡(Parasitophorous vacuble, PV)的一类分泌代谢抗原(Tilleyetal., 1997),其在人体内和体外实验中具有较强的免疫反应性和免疫原性(Caffaroetal., 2011),现已报道有9种致密颗粒蛋白(Koetheetal., 2011)。本研究构建弓形虫RH株GRA7基因的重组质粒pET32a-GRA7和pET28a-GRA7,在大肠埃希菌中分别以融合和非融合蛋白方式进行表达,探讨GRA7重组抗原的免疫反应性。
1 材料与方法
1.1 材料
1.1.1虫株与实验动物:弓形虫RH株为本实验室液氮保种,SPF级雌性昆明小鼠(体重18~22 g)购自本校实验动物中心。
1.1.2菌株与质粒:质粒pET-28a(+)、pET-32a(+)和E.coli菌株BL21(DE3)、DH5α为本实验室保存。
1.1.3主要试剂:基因组DNA提取试剂盒为QIAGEN DNeasy Blood & Tissue Kit;质粒提取试剂盒为OMEGA E.Z.N.A.® Plasmid Mini Kit I;限制性内切酶为BioLabs公司产品;T4DNA连接酶,高保真Taq DNA聚合酶、dNTPs为TaKaRa公司产品;琼脂糖、胰蛋白胨和酵母提取物为英国Oxoid公司产品;异丙基-β-D-硫代半乳糖苷(IPTG)为美国Sigma公司产品;PVDF膜为美国Millipore公司产品;胶回收试剂盒为OMEGA E.Z.N.A.Gel Extraction Kit;ECL试剂为Millipore Immobilon Western Chemiluminescent HRP Substrate;二抗为武汉博士德生物工程有限公司HRP-羊抗小鼠IgG;PCR引物由上海生工生物工程有限公司合成。测序由英潍捷基(上海)贸易有限公司完成。
1.2 方法
1.2.1弓形虫RH株基因组DNA的提取:昆明小鼠经腹腔接种弓形虫RH株感染3天后,收集腹水纯化弓形虫速殖子,提取弓形虫基因组DNA。
1.2.2PCR扩增GRA7基因:参考GenBank中弓形虫RH株GRA7基因序列(DQ459443.2),用DNAMAN软件设计所需的引物。P1序列为5′-ACATGGATCCATGGCCCGACGCAATT-3′,P2序列为5′-ACGAGAATTCCTACTGGCGGGCATCC-T-3′。在上下游引物中分别加入BamHⅠ和EcoRⅠ酶切位点(下划线处),用高保真Taq DNA聚合酶进行扩增。反应参数如下:预变性94℃ 5 min;变性94℃ 30 s,退火55℃ 30 s,延伸72℃ 60 s, 共30个循环;最后再延伸72℃ 7 min,4℃保存。反应产物用1.0%琼脂糖凝胶电泳进行分析。
1.2.3目的基因GRA7的回收和测序:PCR产物用胶回收试剂盒回收纯化后进行双酶切,然后分别与pET28a(+)和pET32a(+)载体进行连接,连接产物转化感受态E.coliDH5α,分别铺板于LB/Kan和LB/Amp固体培养基表面,37℃过夜培养。挑数个单菌落分别接种于LB/Kan和LB/Amp培养液中,37℃以250 r/min振荡培养过夜,用质粒提取试剂提取质粒,进行PCR鉴定及EcoRⅠ和BamHⅠ双酶切鉴定,将鉴定正确的重组质粒送公司测序。序列分析鉴定无误后将重组质粒转化入E.coliBL21(DE3)中。
1.2.4重组质粒的诱导表达:分别将两种转化重组质粒的BL21(DE3)单菌落接种于含抗生素的LB培养液中,37℃ 过夜培养,次日以1∶100接种于20 mL 含抗生素的培养液中扩大培养,于37℃ 250 r/min培养至吸光度(A600nm)达0.5后,加入IPTG至终浓度1 mmol/L。 pET28a-GRA7/BL21于25℃ 110 r/min继续培养4 h,pET32a-GRA7/BL21于37℃ 250 r/min继续培养4 h离心,分别收集菌体,加入蛋白上样缓冲液重悬菌体煮沸后进行SDS-PAGE电泳分析表达产物。
1.2.5Western blotting分析:将表达产物进行SDS-PAGE电泳后通过半干法转至PVDF膜上,进行Western blotting分析,一抗为本室制备的弓形虫PRU株慢性感染小鼠血清,以1∶100稀释;二抗为HRP-羊抗小鼠IgG,以1∶5 000稀释;用化学发光法ECL显迹。
2 结果
2.1 GRA7基因获取
提取弓形虫基因组DNA,经高保真PCR扩增GRA7基因,产物经1.0%琼脂糖凝胶电泳,可见单一条带,其大小约710 bp,与理论值相符。测序结果与已发布的弓形虫RH株GRA7基因cDNA序列同源性为100%。
2.2 GRA7 重组质粒的构建和鉴定
两种重组质粒分别经PCR鉴定,阳性重组克隆能扩增出710 bp左右的目的片段;用EcoRⅠ和BamHⅠ双酶切后可见大小为710 bp目的片段以及载体条带(pET28a(+)为5 300 bp左右、pET32a(+)为5 900 bp左右)(图1-A,B),证明GRA7基因已成功克隆入pET28a(+)与pET32a(+)载体,且测序结果显示插入序列无误。
2.3 重组GRA7蛋白的表达
重组质粒pET32a-GRA7转入大肠杆菌BL21(DE3)中经IPTG诱导后,重组GRA7蛋白以融合蛋白的形式在大肠杆菌BL21胞内表达。经SDS-PAGE电泳分析发现,融合蛋白相对分子量约为45 kDa,与理论值相符。空载体pET32a(+)与重组质粒pET32a-GRA7在诱导前均未出现明显特异的表达蛋白条带(图2)。
重组质粒pET28a-GRA7转入大肠杆菌BL21(DE3)中经IPTG诱导后,GRA7以非融合蛋白的形式在大肠杆菌BL21胞内表达,经SDS-PAGE电泳检测,未在预期29 kDa处发现特异蛋白条带,不排除是因为蛋白表达量少,肉眼不可见,进一步Western blotting分析。
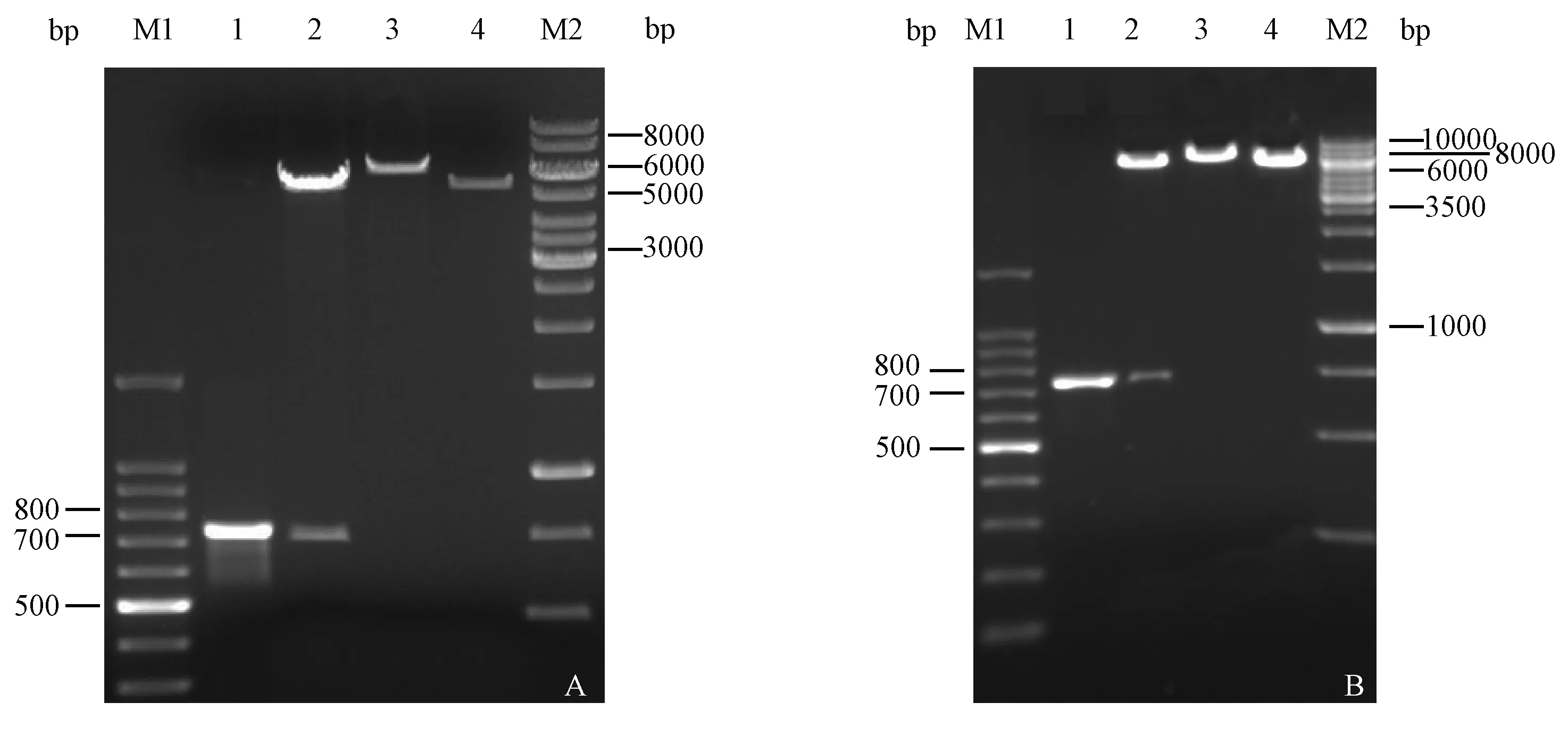
图1 重组质粒的酶切及PCR鉴定Fig.1 Restriction and PCR analysis of the recombinant plasmidA. pET28a-GRA7鉴定. M1:100 bp DNA ladder;1:pET28a-GRA7 PCR结果;2:pET28a-GRA7 BamHⅠ 和 EcoRⅠ双酶切; 3:pET28a-GRA7 BamHⅠ单酶切;4:pET28a(+)BamHⅠ单酶切;M2:1 kbp DNA ladder. B. pET32a-GRA7鉴定. M1. 100 bp DNA ladder;1. pET32a-GRA7 PCR结果;2. pET32a-GRA7 BamHⅠ 和EcoRⅠ双酶切;3. pET32a-GRA7 BamHⅠ单酶切;4. pET32a(+)BamHⅠ单酶切;M2. 1 kbp DNA ladder.A.Analysis of pET28a-GRA7.M1:100 bp DNA ladder; 1: PCR product of plasmid pET28a-GRA7; 2: pET28a-GRA7 digested by BamHⅠ and EcoRⅠ; 3: Plasmid pET28a-GRA7 digested by BamHⅠ; 4: Plasmid pET28a(+)digested by BamHⅠ; M2: 1 kbp DNA ladder.B.Analysis of pET32a-GRA7.M1: 100 bp DNA ladder; 1: PCR product of plasmid pET32a-GRA7; 2: pET32a-GRA7 digested by BamHⅠ and EcoRⅠ; 3: Plasmid pET32a-GRA7 digested by BamHⅠ; 4: Plasmid pET32a(+) digested by BamHⅠ; M2: 1 kbp DNA ladder.
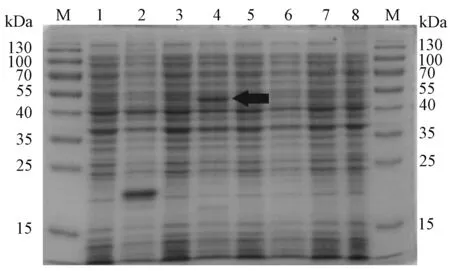
图2 重组GRA7蛋白的SDS-PAGE电泳分析Fig.2 SDS-PAGE analysis of recombinant proteinM:蛋白标志物;1:诱导前pET32a(+)/BL21;2:诱导后pET32a(+)/BL21;3:诱导前pET32a-GRA7/BL21;4:诱导后pET32a-GRA7/BL21;5:诱导前pET28a(+)/BL21;6:诱导后pET28a(+)/BL21;7:诱导前pET28a-GRA7/BL21;8:诱导后pET28a-GRA7/BL21.M:Prestained Protein Ladder;1: Total cell lysate of pET32a(+)/BL21 uninduced; 2: Total cell lysate of pET32a(+)/BL21 induced; 3:Total cell lysate of pET32a-GRA7/BL21 uninduced; 4: Total cell lysate of pET32a-GRA7/BL21 induced; 5: Total cell lysate of pET28a(+)/BL21 uninduced;6: Total cell lysate of pET28a(+)/BL21 induced; 7: Total cell lysate of pET28a-GRA7/BL21 uninduced; 8: Total cell lysate of pET28a-GRA7/BL21 induced.
2.4 重组蛋白的免疫反应性分析
以弓形虫PRU株慢性感染小鼠血清与重组GRA7蛋白进行Western blotting分析,结果显示pET32a-GRA7诱导表达的重组蛋白能被弓形虫慢性感染小鼠血清特异性识别(图3)。pET28a-GRA7诱导表达的蛋白与弓形虫慢性感染小鼠血清在预期位置未见明显特异条带。

图3 pET32a-GRA7重组蛋白的Western blotting分析Fig.3 Wesrern blotting analysis of recombinant protein pET32a-GRA71:pET32a-GRA7/BL21诱导前;2:pET32a-GRA7/BL21诱导后.1:pET32a-GRA7 uninduced; 2:pET32a-GRA7 induced.
3 讨论
快速准确地诊断弓形虫感染是弓形虫病研究的重要内容。利用基因工程技术方法获取高纯度的特异蛋白作为诊断抗原,有助于提高弓形虫病诊断的敏感性和特异性。弓形虫GRA7蛋白在宿主与弓形虫的相互作用中起重要作用(Cesbron-Delauw,1994),其在体内和体外实验中证实具有较强的免疫反应性和免疫原性。郑斌等(2005)的研究表明,GRA7在不同株的弓形虫间具有基因的高度保守性,故GRA7可作为理想的诊断抗原。机体抗弓形虫保护性免疫主要为γ-干扰素(IFN-γ)、白细胞介素2(IL-2)等细胞因子介导的Th1型细胞免疫。Vercammen等(2000)和Cong等(2011)研究发现,GRA7蛋白能免疫诱导CD8+T细胞产生IFN-γ,为GRA7蛋白成为疫苗候选分子提供了有力依据。
本实验克隆得到的弓形虫RH株GRA7基因序列与GenBank登录的弓形虫RH株GRA7基因序列(登录号DQ459443.2)一致。本研究构建的重组质粒pET32a-GRA7能在大肠杆菌BL21(DE3)中表达GRA7融合蛋白, Western blotting分析发现该重组蛋白能被弓形虫慢性感染血清特异识别,为弓形虫GRA7蛋白的诊断和疫苗研究奠定基础。
本实验成功构建重组质粒pET28a-GRA7,但经SDS-PAGE电泳分析,在理论值29 kD附近未发现肉眼可见的特异性表达条带。Western blotting分析结果显示未见特异条带。据报道,Sadeghiani等(2009)成功构建重组质粒pET28b-GRA7并高效表达蛋白,且该蛋白对弓形虫急性感染的血清有强烈的反应。pET28b(+)与pET28a(+)基因序列基本相同,只存在一个核苷酸的差异,前者在BamHⅠ酶切位点前增加一个胞嘧啶。该文献的重组蛋白诱导表达方法可为我们进一步探索pET28a-GRA7的表达提供借鉴。
