旋毛虫成虫可溶性虫体蛋白对葡聚糖硫酸钠诱导的小鼠急性结肠炎的影响*
2013-11-26王云云杨小迪杨雅平黄京京诸欣平
王云云 杨小迪,2 杨雅平 黄京京 诸欣平**
(1.首都医科大学基础医学院人体寄生虫学教研室,北京 100069;2. 蚌埠医学院人体寄生虫学教研室,安徽蚌埠 233000)
炎症性肠病(Inflammatory bowel disease,IBD)是一组易反复发作的免疫失调性肠道疾病,包括溃疡性结肠炎(Ulcerative colitis,UC)和克罗恩病(Crohn’s disease,CD)。其发病机制较复杂,环境、遗传和免疫等多种因素导致了IBD的发生,其中免疫反应异常是较为重要的因素(Scaldaferrietal.,2007;Qinetal.,2012)。近年来,一些研究证实,不同种类的蠕虫感染或蠕虫相关蛋白均可在一定程度上缓解肠道炎症(Wangetal.,2008;Elliottetal.,2009;Johnstonetal.,2010)。Motomura等(2009)报道,旋毛虫肌幼虫虫体蛋白可在无活虫感染的情况下调控宿主肠道免疫。而旋毛虫成虫寄生于宿主肠道,直接与宿主相互作用,但旋毛虫成虫虫体蛋白(Soluble adult proteins,SAP)是否能替代活虫感染对宿主肠道免疫进行调节,目前尚无报道,因此,本研究选用旋毛虫SAP,探讨其对葡聚糖硫酸钠(Dextran sulphate sodium, DSS)诱导的C57BL/6小鼠结肠炎的影响,并对其作用机制进行初步研究。
1 材料与方法
1.1 实验动物和试剂来源
雌性C57BL/6小鼠(体重18~22 g)、雌性ICR小鼠(体重22~25 g)、雌性Wistar大鼠(体重250~300 g),均为清洁级动物购自北京维通利华实验动物技术有限公司。DSS(分子量40 000)购自德国Applichem公司,细胞因子ELISPOT检测试剂盒及鼠抗CD3、CD28单克隆抗体均购自美国BD Phamingen公司。
1.2 虫株
实验所用旋毛虫种为本实验室ICR小鼠保种传代的黑龙江猪源旋毛虫Trichinellaspiralis。
1.3 旋毛虫成虫虫体匀浆蛋白制备
根据文献报道的方法(涂涛等,2001),收集旋毛虫成虫。通过研磨超声和反复冻融使虫体彻底粉碎,13 000 g离心后取上清经0.45 μm滤膜去除杂质,即为SAP。用BCA(Bicinchoninic acid) 试剂盒测定蛋白含量,分装,-80 ℃保存。
1.4 DSS小鼠结肠炎模型的建立及动物分组
36只小鼠随机均分为3组:对照组(PBS组)、肠炎组(PBS+DSS组)、虫体蛋白治疗组(SAP+DSS组),每组12只。肠炎组小鼠给予3% DSS溶液,连续饮用7 d,第5 d起小鼠逐渐出现血便、稀便,证明急性结肠炎诱发成功(Wirtzetal.,2007)。PBS组给予双蒸水。治疗组,在诱发肠炎的同时,每天经腹腔注射25 μg SAP,PBS组和肠炎组注射PBS。实验期间,根据每天小鼠体重下降、粪便性状及血便有无情况进行疾病活动指数评分(Disease activity index,DAI)(Muranoetal.,2000),见表1。第7 d将小鼠处死取材检测相关指标。

表1 疾病活动指数标准Tab.1 Disease activity index (DAI) standard
正常大便:成形大便;松散大便:不黏附于肛门的糊状、半成形大便;稀便:可黏附于肛门的稀水样状。
Normal stools: well formed pellets; Loose: pasty stools which do not stick to the anus; diarrhea: Liquid stools that stick to the anus.

表2 结肠大体检查评分标准Tab.2 Macroscopic inflammation score

表3 组织病理学评分标准Tab.3 Microscopic inflammation score
1.5 小鼠结肠大体与组织病理观察
实验第7 d,取出小鼠结肠,用PBS溶液冲洗肠腔,取近直肠的部分结肠在甲醛溶液中固定,经石蜡包埋、切片(5 μm),进行HE染色。同时将结肠纵向剖开,根据文献报道的方法,结合肠道粘连、结肠溃疡、肠壁厚度及粘膜水肿情况等指标进行宏观检查评分(Bobin-Dubigeonetal.,2001), 见表2。显微镜下观察组织切片,并根据粘膜是否完整、腺体隐窝消失程度、是否有炎性细胞浸润等指标进行组织损伤微观评分(Dielemanetal.,1998),见表3。
1.6 分离培养脾和肠系膜淋巴结(MLN)细胞及ELISPOT方法检测细胞因子
诱导小鼠结肠炎后第7 d,处死小鼠,无菌取脾和MLN,根据文献报道的方法(姚君等,2010),提取淋巴细胞。经台盼兰染色计算活细胞数并调整到适宜的细胞浓度。将细胞加至ELISPOT 96孔板中,以anti-CD3和anti-CD28蛋白(终浓度为1 μg/mL)作为共刺激蛋白,在37℃、5% CO2孵箱中培养48 h,检测相应细胞因子的分泌水平。
1.7 统计学方法
实验数据用SPSS 11.5统计软件处理,各组资料用(均值±标准差)表示,采用方差分析q检验比较各组资料间的差异,将P<0.05做为差异具有统计学显著性的标准。
2 结果
2.1 小鼠疾病活动指数(DAI)评分
建立肠炎模型的7 d中,正常对照组小鼠活动正常,未见稀便或血便,DAI评分无明显变化;肠炎组小鼠在饮用3%DSS溶液第5 d起粪便中逐渐出现血便和稀便,伴有小鼠活动减少、倦怠,体重下降明显,随时间延长DAI评分逐渐增高,与文献报道一致(Muranoetal.,2000);而SAP治疗组小鼠活动良好,少见稀便和血便,DAI评分低于肠炎组,两组从第5 d起出现显著性差异(P<0.01,n=12)。见图1。
2.2 小鼠结肠大体与宏观、微观评分及组织病理学变化
取小鼠结肠纵向剖开进行宏观和微观观察及评分(图2)。与正常组相比,肠炎组结肠可见明显充血,肠壁增厚,镜下可见若干粘膜缺损区。而SAP治疗组的小鼠结肠炎症较轻,粘膜结构完整,肠壁增厚不明显。治疗组较肠炎组宏观及微观评分明显降低,两组相比有显著性差异(P<0.01,n=12)。
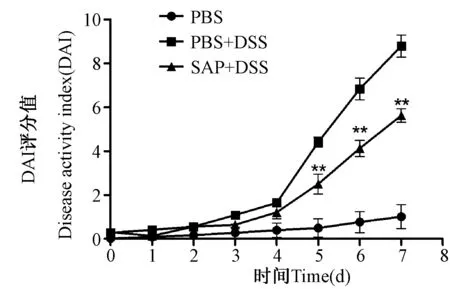
图1 DSS诱导的小鼠结肠炎各组DAI评分的变化Fig.1 Changes of DAI from DSS-induced colitis of each groupDAI:疾病活动指数Disease activity index;DSS:葡聚糖硫酸钠 Dextran sulphate sodium;SAP:成虫可溶性虫体蛋白 Soluble adult protein.(下同The same below.)**表示治疗组与肠炎组相比有显著性差异(P<0.01,n=12),以均值±标准差表示(下同)**Indicates the significant differences between the therapy and colitis group (P<0.01,n=12).The values are presented as the mean ±SD(the same below).

图2 DSS诱导的小鼠结肠炎各组结肠大体与组织病理评分Fig.2 The macroscopic and microscopic score of colons from each groupA:小鼠结肠大体评分; B:小鼠组织病理学评分。A: the macroscopic score; B: microscopic score.
HE染色的结果显示,正常对照组结肠粘膜层仅见一些散在分布的淋巴细胞,腺体隐窝排列整齐(图3-A)。肠炎组结肠上皮粘膜损伤明显,腺体隐窝结构基本破坏,杯状细胞丢失,粘膜及粘膜下层见大量炎性细胞浸润(图3-B)。SAP治疗组小鼠结肠粘膜损伤明显减轻,上皮结构较完整,腺体隐窝排列较整齐,只有较少的炎性细胞浸润(图3-C)。
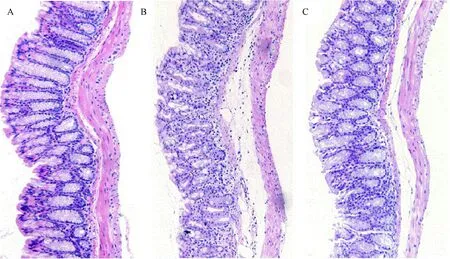
图3 DSS诱导的小鼠结肠炎组织病理学变化(HE染色,50×)Fig.3 Photomicrographs of histologically changes in colons(H&E staining,50×)A:PBS组;B:PBS+DSS组;C:SAP+DSS组.A: PBS group;B: PBS+DSS group;C: SAP+DSS group.
2.3 小鼠脾和肠系膜淋巴结细胞细胞因子水平的测定
利用ELISPOT方法检测细胞因子分泌情况显示,与对照组相比,肠炎组脾和MLN细胞中IFN-γ的分泌均显著增加,而治疗后,脾和MLN淋巴细胞分泌的IFN-γ均明显下降;而IL-4(P<0.05,n=12)、IL-10(P<0.01,n=12)的分泌都显著升高(图4~5)。
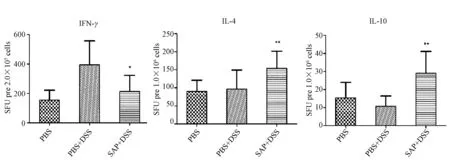
图4 DSS诱导的小鼠结肠炎各组脾淋巴细胞细胞因子IFN-γ、IL-4、IL-10分泌水平Fig.4 The level of cytokine IFN-γ、IL-4、IL-10 induced by anti-CD3and anti-CD28 from spleen lymphocyte*,**表示治疗组与肠炎组相比有显著性差异(* P<0.05,**P<0.01,n=12),以均值±标准差表示(下同).*,**The significant differences between the therapy and colitis group (* P<0.05,**P<0.01,n=12.The values are presented as the mean ±SD (the same below).
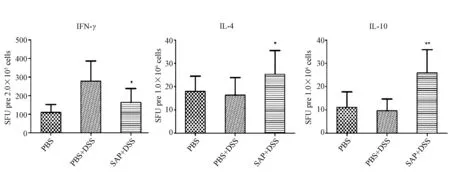
图5 DSS诱导的小鼠结肠炎各组肠系膜淋巴结细胞因子IFN-γ、IL-4、IL-10分泌水平Fig.5 The level of cytokine IFN-γ、IL-4、IL-10 induced by anti-CD3and anti-CD28 from MLN lymphocyte
3 讨论
近年来,大量的流行病学、实验室及临床试验表明:蠕虫感染可以抑制包括IBD在内的多种免疫失调性疾病(Wangetal.,2008)。大多数IBD实验模型,表现为Th1细胞介导的免疫反应(Qinetal.,2012)。蠕虫感染后,可诱导宿主产生Th2型为主的免疫反应,通过抑制Th1型免疫反应,有效缓解肠道炎症(Elliottetal.,2009; Johnstonetal.,2010)。蠕虫的这种特性与伴随宿主共同进化过程中产生的免疫调节分子有关(Hewitsonetal.,2009)。寄生蠕虫产生的异体蛋白、脂质和排泄分泌物质,一方面可诱导宿主产生IL-4、IL-9、IL-13等 Th2型细胞因子,从而有效抑制IFN-γ、IL-12、IL-2、IL-1β等Th1型细胞因子的产生,缓解肠道炎症;亦可通过诱导产生调节性细胞因子IL-10、TGF-β等使紊乱的免疫反应重新达到平衡(Ruyssersetal.,2009)。
研究证实,旋毛形线虫经口感染可以减轻结肠炎症,血清中IL-12及结肠组织中IFN-γ mRNA表达水平减低,而刺激脾分泌的IL-4、IL-13水平上调(Khanetal.,2002)。Motomura等(2009)报道,旋毛虫肌幼虫虫体抗原可替代活虫感染,通过上调结肠组织中 IL-13及TGF-β的水平,下调IL-1β的水平,从而改善肠道炎症。而旋毛虫成虫寄生于宿主肠道,通过多种抗原物质影响宿主的肠道免疫应答,但此时期的虫体抗原是否亦可替代活虫感染调节宿主免疫,目前尚未见报道。本研究选择用旋毛虫SAP治疗小鼠急性结肠炎,结果显示,SAP治疗后,小鼠肠炎症状得到缓解。同时检测到,脾淋巴细胞和MLN细胞Th1型细胞因子IFN-γ表达水平下降,Th2型细胞因子IL-4和调节性细胞因子IL-10表达量均上调。表明旋毛虫SAP对肠炎的抑制作用可能是通过调节小鼠外周和肠道局部免疫炎症因子的分泌失衡来实现的,与文献报道蠕虫相关蛋白缓解肠炎涉及的细胞免疫机制基本一致(Hewitsonetal.,2009)。但是蠕虫对免疫失调疾病的作用机制是复杂多样的,因此,仍需对旋毛虫SAP缓解肠炎的免疫学机制进行更深入的研究。
