α-淀粉酶AmyP对有机溶剂和表面活性剂的耐受性
2013-10-25刘源涛郑昀昀
刘源涛,汪 颖,郑昀昀,彭 惠
(安徽大学生命科学学院安徽省微生物与生物催化工程技术中心,安徽 合肥 230039)
淀粉降解酶已经占到全球酶制剂销量的30%,成为市场份额最大的一类酶[1]。α-淀粉酶(α-amylases,E.C 3.2.1.1)是最重要的淀粉降解酶之一,可以把淀粉降解为系列寡糖,早期主要应用在淀粉液化工艺中[2]。最近几年,随着一些具有耐有机溶剂、耐表面活性剂、耐碱或耐盐等特色的α-淀粉酶的发现,α-淀粉酶的应用范围扩大到了纺织、造纸、洗涤、医药等行业[3-4]。进一步挖掘和开发具有新型催化特色的α-淀粉酶成为研究的热点。最近,安徽大学生命科学学院从海洋宏基因组文库中筛选获得了一个新型的α-淀粉酶(AmyP)[5]。AmyP 的氨基酸序列与已知的 α-淀粉酶相似性极低(不超过20%),而且又具有新型的进化地位,因此,探索AmyP是否具有某些独特的催化特性具有重要的价值。通过探索各类有毒物质的耐受情况,发现AmyP具有良好的有机溶剂和表面活性剂耐受性,为了解这个新的α-淀粉酶以及开发新型的酶制剂奠定基础。
1 材料与方法
1.1 材料
α-淀粉酶AmyP是在基因工程菌中重组表达和纯化的蛋白。重组表达载体pET32a-AmyP由本实验构建[5],转化大肠埃希菌 BL21(DE3)(Novagen公司)后,16℃诱导表达12 h,AmyP蛋白通过Ni2+亲和层析(GE Health公司)一步纯化。分析纯的有机溶剂购自国药集团;麦芽三糖购自百灵威;表面活性剂、可溶性淀粉和3,5-二硝基水杨酸等试剂购自上海生工。
1.2 方法
1.2.1 α-淀粉酶的酶活测定 采用3,5-二硝基水杨酸(DNS)法测定可溶性淀粉降解后释放出的还原糖的量,以葡萄糖为标准[6]。一个标准反应体系包含100 μL适当稀释的纯酶和500 μL 1%可溶性淀粉。酶和淀粉均配置在100 mmol/L柠檬酸缓冲液(pH 6.5)中,50℃反应5 min,立刻置于冰冷的0.3 mol/L Na2CO3溶液中终止反应,随后加入DNS试剂测定还原糖的量。一个标准酶活(U)定义为每分钟释放出1 μmol还原糖所需的酶量。蛋白浓度采用Bradford法测定,牛血清白蛋白作为标准。
1.2.2 有机溶剂对AmyP的影响 有机溶剂的毒性与其极性系数log Pow值(溶剂在辛醇/水双相系统中的分配系数的对数值)密切相关。选择不同log Pow值的有机溶剂,加入标准反应体系中,终浓度为20%(体积比)。以无添加的样品组作为空白对照。
1.2.3 表面活性剂对AmyP的影响 选取阴离子型的表面活性剂SDS、阳离子型的表面活性剂CTAB、非离子型的表面活性剂 Tween-20、Tween-80和Triton X-100为检测AmyP表面活性剂耐受性的试剂。将终浓度依次为0.5%、1%、2%和3%的表面活性剂与纯酶在10℃浴锅中孵育30 min,转速 150 r/min,然后取 100 μL 酶液测定残留的酶活。以无添加的样品组作为空白对照。
1.2.4 水解产物的高压液相色谱(HPLC) 测定AmyP水解可溶性淀粉的产物时,将反应时间延长为30 min,以确保充分反应。水解产物采用HPLC(Agilent 1260)进行定量测定,使用的糖柱为Carbomix Ca-NP柱(250 mm×4.5 mm)(Sepax Technologies,Inc.,USA),检测手段为示差检测,流动相为 MilliQ级的纯水,流速0.1 mL/min,柱温为80℃。标准品为葡萄糖(G1)、麦芽糖(G2)和麦芽三糖(G3)。
2 结果与分析
2.1 有机溶剂对AmyP活性的影响
通常情况下,有机溶剂会使酶蛋白变性,从而丧失催化活性。选取8种 log POW值从4.5到-0.24的有机溶剂(20%,体积比),它们对纯化的重组表达的AmyP活性的影响如表1所示。
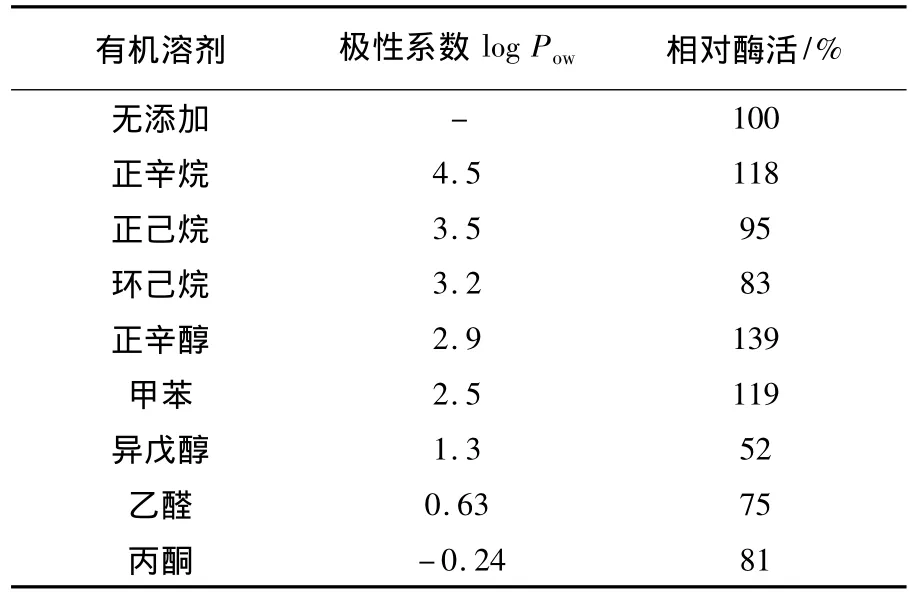
表1 不同有机溶剂对AmyP活性的影响Table 1 The effects of various organic solvents on the activity of AmyP
没有添加有机溶剂的样品组(纯酶为154 U/mL)的酶活定义为100%。可见,在反应体系中存在有机溶剂的条件下,AmyP依然保持了50%以上的活性,这表明AmyP对各种有机溶剂均具有良好的耐受性。一般认为log Pow值在1.5~4.0之间的有机溶剂毒性较强,而低于1.5或高于4.0的有机溶剂毒性较弱[7]。AmyP对各种有机溶剂的耐受性强弱显然与有机溶剂的毒性无显著相关。尤其值得注意的是,在正辛醇、正辛烷和甲苯存在时,AmyP的活性不但没有下降,反而提高为139%、118%和119%。最近几年,随着耐受有机溶剂的淀粉酶在制药行业的开发应用,一些具有这种新特性的α-淀粉酶被陆续报道。例如来自Bacillus agaradhaerens Mi-10-62 菌 株[8]、Thalassobacillus sp.LY18 菌株[9]、Haloarcula sp.S-1 菌株[10]等微生物中的 α-淀粉酶。这些 α-淀粉酶在有机溶剂存在的条件下,虽然活性显示出不同程度的下降,但是依然维持了部分活性。据我们所知,已知文献报道中只有1个来自Nesterenkonia sp.F菌株的α-淀粉酶在有机溶剂存在时显示出更高的活性[11]。因此,AmyP在有机溶剂存在的生物技术中有潜在的优良应用前景。
2.2 正辛醇对AmyP水解产物的影响
AmyP是一个较为罕见的糖化型α-淀粉酶,其可溶性淀粉的水解产物不是系列寡糖,而是仅为葡萄糖(G1)、麦芽糖(G2)和麦芽三糖(G3)[5]。无添加条件下,HPLC测定这3个水解产物的相对比例为G1∶G2∶G3=13∶37∶50(图1 A)。添加了正辛醇后,水解产物的相对比例改变为G1∶G2∶G3=28∶34∶38,葡萄糖的含量明显增多,麦芽三糖的含量相对减少(图1 B)。此外,正辛烷和甲苯对AmyP的水解产物无明显影响。虽然未见有机溶剂改变α-淀粉酶水解产物的报道,但是来自Brachybacterium sp.LB25菌株的麦芽三糖淀粉酶在DMSO或乙醇的影响下麦芽三糖的产量会明显增加[12];来自 Pseudomonas aeruginosa 的蛋白酶在甲醇、乙醇和异丙醇等不同有机溶剂存在时的水解产物各不相同[13]。
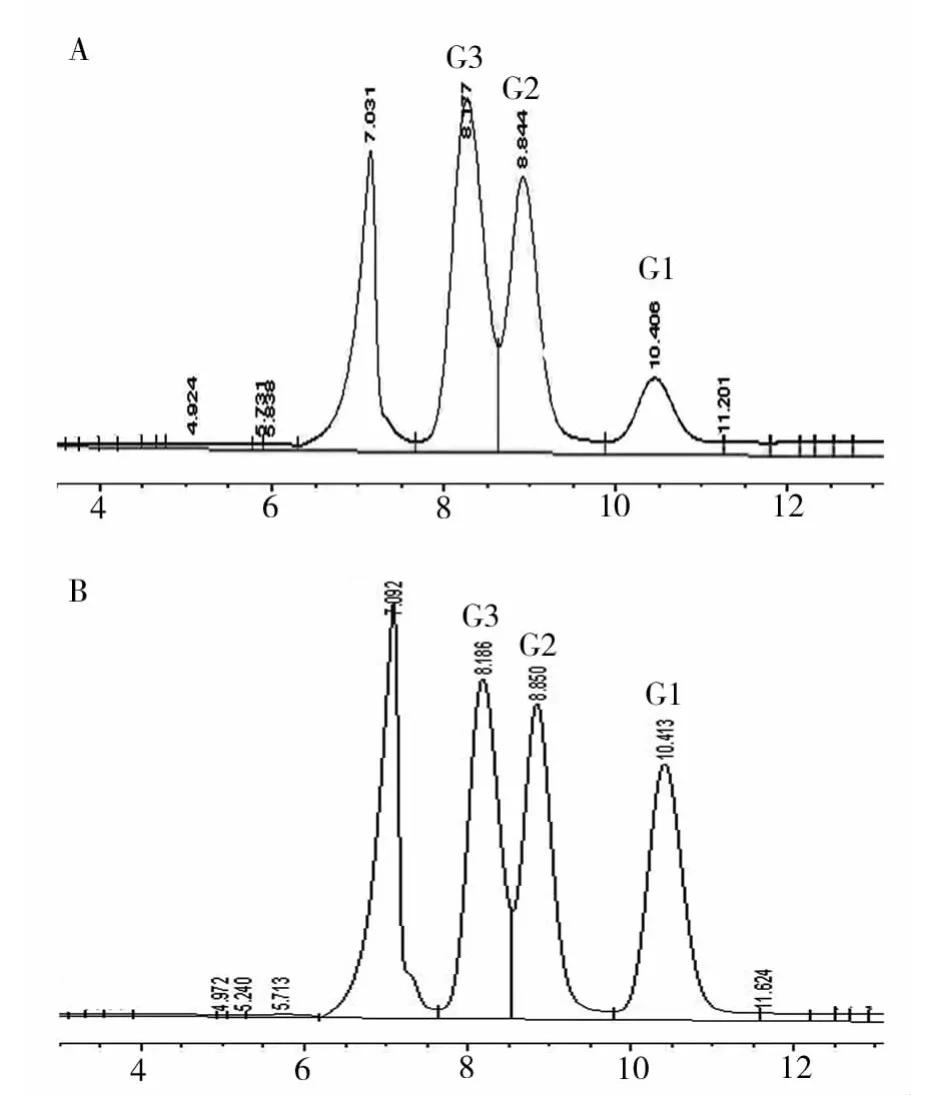
图1 HPLC分析无添加(A)和添加正辛醇(B)后AmyP的淀粉水解产物Fig.1 HPLC analysis of starch-hydrolysis by AmyP in the absence(A)or presence(B)of n-octanol G1、G2 and G3 refer to glucose,maltose and maltotrios
2.3 表面活性剂对AmyP的影响
由于某些具有有机溶剂耐受性的酶类同时也具有表面活性剂耐受性[9],因此选取常见的5种表面活性剂对AmyP进行了测定,结果如图2所示。AmyP对3种非离子型的表面活性剂耐受性很好,不仅无活性丧失,而且活性均有不同程度的提高。Tween-20的效果尤其明显,1%的Tween-20可以提高酶活124%。但是,AmyP对阴/阳离子型的表面活性剂耐受性不佳。随着阴/阳离子型的表面活性剂浓度的增加,AmyP的活性快速下降。通常,非离子型的表面活性剂毒性较低,而阴/阳离子型的毒性较强。因此,AmyP的表面活性剂耐受性强弱与表面活性剂的毒性基本吻合。这种特征与来自Thalassobacillus sp.LY18菌株[9]和 B.mojavensis A21 菌株[14]的 α-淀粉酶类似。比较B.mojavensis A21菌株来源的α-淀粉酶在Tween-20(5%)、Tween-80(5%)和 SDS(1%)处理后分别保留85%、83%和71%的酶活[14],显然AmyP的表面活性剂耐受性更高。此外,表面活性剂对AmyP的水解产物无明显影响。

图2 表面活性剂对AmyP稳定性的影响Fig.2 Effect of surfactants agents on the stability of AmyP
3 讨论
α-淀粉酶 AmyP不仅对 log Pow值从4.5到-0.24的各种有机溶剂均具有良好的耐受性,而且耐受性强弱与有机溶剂的毒性无显著相关。正辛醇、正辛烷和甲苯可以提高AmyP的活性。正辛醇还可以改变AmyP的淀粉水解产物,使葡萄糖的含量增加,麦芽三糖的含量降低。AmyP对非离子型的表面活性剂Tween-20、Tween-80和Triton X-100展示出优良的耐受性,对阴离子型的SDS和阳离子型CTAB耐受性稍差。这些数据表明来自海洋宏基因组文库的AmyP是一个同时具有有机溶剂和表面活性剂耐受性的新型α-淀粉酶。
[1]Hmidet N,Maalej H,Haddar A,et al.A novel α-amylase from Bacillus mojavensis A21:purification and biochemical characterization[J].Appl Biochem Biotechnol,2010,162:1018-1030.
[2]Gupta R,Gigras P,Mohapatra H,et al.Microbial α-amylases:a biotechnological perspective[J].Process Biochem,2003,38:1599-1616.
[3]Jobling S.Improving starch for food and industrial applications[J].Curr Opin Plant Biol,2004,7:210-218.
[4]Van Der M,Uitdehaag JCM,Leemhuis H,et al.Properties and applications of starch converting enzymes of alpha amylase family[J].J Biotechnol,2002,94:137-155.
[5]Liu Y,Lei Y,Zhang XC,et al.Identification and phylogenetic characterization of a new subfamily of α-amylase enzymes from marine microorganisms[J].Mar Biotechnol,2012,14:253-260.
[6]Mitsuiki S,Mukae K,Sakai M,et al.Comparative characterization of raw starch hydrolyzing α-amylases from various Bacillus strains[J].Enzyme Microb Tech,2005,37:410-416.
[7]Osborne S J,Leaver J,Turner MK,et al.Correlation of biocatalytic activity in an organic-aqueous two-liquid phase system with solvent concentration in the cell membrane[J].Enzyme Microb Technol,1990,12:281-291.
[8]Pandey S,Singh SP.Organic solvent tolerance of an α-amylase from haloalkaliphilic bacteria as a function of pH,temperature,and salt concentrations[J].Appl Biochem Biotechnol,2012,166:1747-1757.
[9]Li X,Yu HY.Characterization of an organic solvent-tolerant αamylase from a halophilic isolate,Thalassobacillus sp.LY18[J].Folia Microbiol,2012,57:447-453.
[10]Fukushima T,Mizuki T,Echigo A,et al.Organic solvent tolerance of halophilic α-amylase from a haloarchaeon,Haloarcula sp.strain S-1[J].Extremophiles,2005,9:85-89.
[11]Shafiei M,Ziaee AA,Amoozegar MA.Purification and characterization of a halophilic α-amylase with increased activity in the presence of organic solvents from the moderately halophilic Nesterenkonia sp.strain F[J].Extremophiles,2012,16:627-635.
[12]Doukyu N,Yamagishi W,Kuwahara H,et al.Purification and characterization of a maltooligosaccharide-forming amylase that improves product selectivity in water-miscible organic solvents,from dimethylsulfoxide-tolerant Brachybacterium sp.strain LB25[J].Extremophiles,2007,11:781-788.
[13]Tang XY,Wu B,Ying HJ,et al.Biochemical properties and potential applications of a solvent-stable protease from the highyield protease producer Pseudomonas aeruginosa PT121[J].Appl Biochem Biotechnol,2010,160(4):1017-1031.
[14]Hmidet N,Maalej H,Haddar H,et al.A novel α-amylase from Bacillus mojavensis A21:purification and biochemical characterization[J].Appl Biochem Biotechnol,2010,162:1018-1030.