红斑丹毒丝菌SpaA蛋白保护区域的免疫学检测
2013-10-25刘丹丹恩特马克布拉提白杨振龙吾鲁木汗那孜尔别克
刘丹丹,恩特马克·布拉提白,杨振龙,吾鲁木汗·那孜尔别克
(吉首大学生物资源与环境科学学院,湖南 吉首 416000)
丹毒丝菌根据DNA-DNA杂交和PCR分为红斑丹毒丝菌(Erysipelothrix rhusiopathiae)和扁桃体丹毒丝菌(E.tonsillarum),前者有 1a、1b、2、4、5、6、8、9、11、12、15、16、17、19、21 和 N 等 16 种血清型,后者有 3、7、10、14、20、22 和 23 等 7 种血清型,另外还有分类地位未确定的血清型13和18的菌株,但它们在遗传发育上属于丹毒丝菌属[1]。其中红斑丹毒丝菌是猪丹毒、禽类的败血症、人类丹毒、鱼类的脏器出血和肾脏肿大等疾病的致病菌,给养殖业造成巨大的经济损失,也给人民的食品卫生和人体健康带来威胁[2-4]。目前,预防猪丹毒的灭活苗和弱毒苗只能预防特急性、急性和风疹性疾病,而无法预防该菌引起的慢性疾病,且在疫苗应用中仍有疫情再次爆发,至今世界各地尚未彻底消灭本病[5-6]。因此,研究红斑丹毒丝菌菌体表面的保护性抗原,为猪丹毒亚单位疫苗的研制提供理论依据。Kitajima等[7]用NaOH提取法制备血清型2红斑丹毒丝菌的菌体表面蛋白并检测其保护作用,结果表明该蛋白疫苗能保护SPF猪受同源菌株和异源菌株的致死性感染,并发现64~67 ku的菌体表面蛋白分别能与攻毒前免疫血清和康复期免疫血清发生特异性反应,暗示了这些蛋白可能具有交叉保护作用。Galan和Timoney[8]用抗体从血清型1红斑丹毒丝菌的基因组文库中筛选出具有保护作用的2个克隆,并分别制备它们的抗体,Western blot结果显示这些抗体分别能与猪丹毒丝菌的43、64和66 ku表面蛋白结合,表明这些蛋白可能是本菌保护性抗原。Makino等[9]用单抗从血清型2红斑丹毒丝菌基因组文库中克隆出编码64 ku表面保护性抗原A(surface protective antigen A,SpaA)的全基因序列,用原核表达系统分别表达重组rSpaA和缺失C端8个重复序列的ΔSpaA,小鼠保护试验结果显示rSpaA能完全保护小鼠受强毒株Tama-96的致死性感染,而ΔSpaA免疫组小鼠攻毒后全部死亡,表明SpaA的保护作用与其C端的重复序列有关。Imada等[10]用PCR从血清型1红斑丹毒丝菌Fujisawa基因组DNA中克隆出编码SpaA蛋白N端342个氨基酸的spaA-N基因片段,用原核表达系统表达了重组蛋白SpaA-N并检测其保护作用,结果表明SpaA-N免疫组小鼠对同源菌株和异源菌株82-875攻毒的保护率均为100%。后来Shimoji等[11]为了确定 SpaA的免疫保护区域,用PCR从菌株Fijisawa基因组DNA中分别克隆出编码信号肽除外的成熟SpaA和其C端8个重复序列的基因片段,用原核表达系统分别表达重组蛋白SpaA和SpaA-C,保护试验结果表明SpaA免疫组小鼠和SpaA-C免疫组小鼠对同源菌株攻毒的保护率分别为100%和20%。吾鲁木汗等[12]对血清型2红斑丹毒丝菌C43311株spaA-N基因进行了原核表达和纯化,保护试验结果表明重组SpaA-N免疫组小鼠对强毒株C43065攻毒的保护率为100%。上述国内外研究结果表明,SpaA是红斑丹毒丝菌的主要交叉保护性抗原,用SpaA可以研制猪丹毒的蛋白疫苗,但是关于其C端重复序列的保护作用还存在争议。所以,本研究为了阐明SpaA的免疫保护区域,用大肠埃希菌原核表达系统分别表达血清型2红斑丹毒丝菌C43065株的重组SpaA、SpaA-N和SpaA-C,并检测了它们对小鼠的保护作用。
1 材料与方法
1.1 材料
1.1.1 菌株和质粒 血清型2红斑丹毒丝菌C43065株购自中国兽医微生物菌种保藏管理中心;大肠埃希菌DH5α和BL21为本实验室保存;表达载体pET32a购自Novagen公司。
1.1.2 主要试剂及实验动物 PCR扩增试剂盒、限制性内切酶BamHⅠ和HindⅢ、T4 DNA连接酶、胶回收试剂盒、质粒 DNA提取试剂盒、DNA marker和Protein marker均为大连TaKaRa公司产品;Brain Heart Infusion(BHI)培养基为Difco公司产品;IPTG为Promega公司产品;Ni-IDA SefinoseTMkit、HRP标记的羊抗兔IgG、HRP标记的羊抗鼠IgG、邻苯二胺(DAB)均购于上海生工生物工程公司。5周龄雌性昆明白小鼠和新西兰白兔购自湖南斯莱克景达实验动物有限公司。
1.2 方法
1.2.1 目的基因的扩增和克隆 根据红斑丹毒丝菌 C43065株 spaA 基 因(AccessionNo.EF688017)和表达载体pET32a的多克隆位点,参照潘宏升等[13]介绍的方法设计PCR引物(表1),引物由大连TaKaRa公司合成。用引物SpaA-1和SpaA-2经PCR从C43065株基因组DNA中扩增编码信号肽除外的成熟SpaA的spaA基因,PCR扩增程序:94℃ 5 min;94℃ 30 s,56℃ 30 s,72℃1.8 min;35个循环;72℃ 10 min。用引物SpaA-3和 SpaA-4经 PCR从 C43065株基因组DNA中扩增编码SpaA蛋白N端342个氨基酸序列的spaA-N片段,PCR扩增程序:94℃ 5 min;94℃ 30 s,56 ℃ 30 s,72 ℃ 1.2 min;35 个循环;72℃10 min。用引物SpaA-5和 SpaA-6经PCR从C43065株基因组DNA中扩增编码SpaA蛋白C端160个氨基酸(20个氨基酸的8个重复序列)序列的spaA-C片段,PCR扩增程序:94℃ 5 min;94 ℃ 30 s,56℃ 30 s,72℃ 50 s;35个循环;72℃10 min。用胶回收试剂盒纯化PCR产物,将PCR产物和表达载体pET32a分别用BamHⅠ/HindⅢ进行双酶切,用T4 DNA连接酶连接后转化至感受态DH5α,菌液经PCR验证为阳性者用试剂盒提取质粒DNA,酶切,电泳鉴定,将阳性者进一步测序。
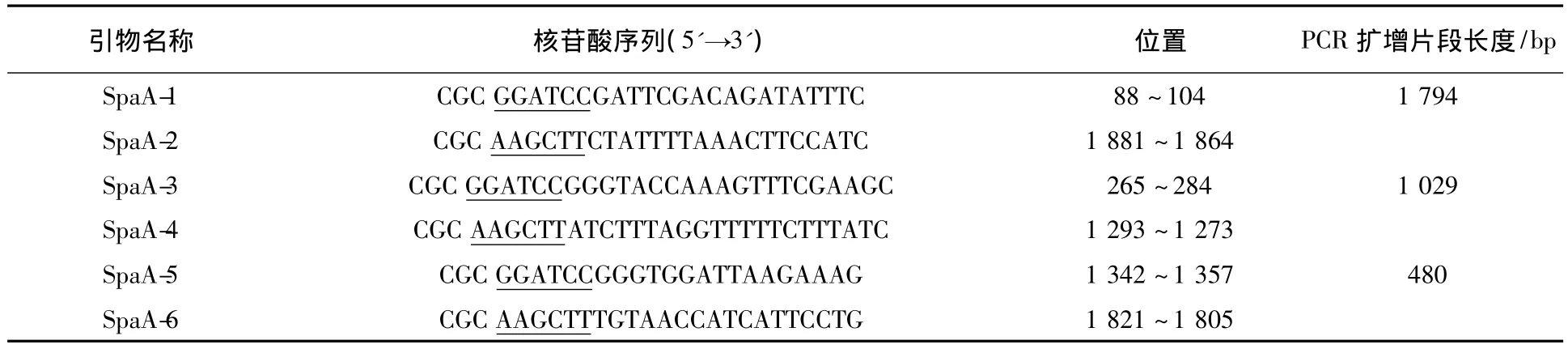
表1 引物的序列、位置及扩增片段的长度Table 1 Sequences and locations of the primers and length of expected fragments
1.2.2 重组蛋白的表达和纯化 参照季爱加等[14]的方法对重组菌进行诱导表达。将重组质粒pET-spaA、pET-spaA-N和 pET-spaA-C分别转化大肠埃希菌BL21,菌液浓度培养至OD600值为0.6 时,0.3 mmol/L IPTG 诱导表达4 h,用12.5%SDS-PAGE电泳检测目的蛋白的表达。将重组菌扩大培养并经IPTG诱导表达,离心收集菌体,PBS重悬后冰浴超声破碎菌体,离心后的上清过滤,用 Ni2+离子亲和层析柱纯化重组蛋白,用PEG6000干粉对纯化蛋白进行浓缩并按Bradford法测定蛋白含量。
1.2.3 免疫血清的制备 将纯化的重组蛋白SpaA、SpaA-N和SpaA-C分别与弗氏完全佐剂等体积混匀,背部皮下注射新西兰白兔,注射剂量为200 μg/只;隔1周用重组蛋白和等体积弗氏不完全佐剂混合加强免疫2次。最后一次免疫后7 d经颈动脉采血及分离血清。按照Lo等[15]的方法用大肠埃希菌BL21菌体的超声波破碎液从免疫血清中吸附除去针对大肠埃希菌抗原的抗体。
1.2.4 重组蛋白免疫原性的Western blot检测按照Kitajima等[7]报道的NaOH抽提法制备红斑丹毒丝菌C43065株的NaOH提取抗原。将重组SpaA、SpaA-N、SpaA-C和NaOH提取抗原经SDSPAGE电泳分离后,通过半干式电转仪将蛋白条带转移至硝酸纤维素膜上,用5%脱脂奶粉溶液4℃封闭过夜,与抗重组蛋白免疫血清(1∶500)室温孵育2 h,然后与HRP标记的羊抗兔IgG(1∶1000)室温孵育1 h,每步完成后均严格洗膜,最后加DAB显色液显色。
1.2.5 免疫保护试验 根据吾鲁木汗等[12]检测的红斑丹毒丝菌C43065株对小鼠的LD50值(11 CFU),确定本次小鼠免疫保护试验的攻毒剂量为250 LD50。将45只5周龄雌性昆明系小鼠随机分为9组,5只/组。4组小鼠分别用重组 SpaA、SpaA-N、SpaA-C和NaOH提取抗原与弗氏完全佐剂以1∶1的比例进行乳化后,经背部皮下注射,50 μg/只;4 组小鼠分别用重组 SpaA、SpaA-N、SpaA-C和NaOH提取抗原与弗氏完全佐剂以1∶1的比例进行乳化后,经背部皮下注射,100 μg/只;剩余1组小鼠注射生理盐水作为非免疫对照组。隔2周,用等剂量抗原和等体积的弗氏不完全佐剂混匀加强免疫2次,第3次免疫后2周,用250 LD50(2.73×103CFU)红斑丹毒丝菌C43065株对各试验组小鼠进行腹腔攻毒,连续观察12 d,记录各组小鼠死亡数,计算各免疫组的保护率。
1.2.6 攻毒前小鼠免疫血清的抗体效价 第3次免疫后7 d,用尾静脉采血法从各试验组小鼠中采血及分离血清,用间接ELISA法检测攻毒前小鼠血清的抗体效价。用0.05 mol/L碳酸盐缓冲液(pH 9.6)制备蛋白含量为100 μg/mL的重组SpaA溶液并包被ELISA板,4℃包被过夜,用含0.05%Tween20的PBS(PBS-T20)缓冲液洗涤3次,用含1%脱脂奶粉和1%BSA的PBS-T20封闭液于37℃封闭2 h,将待测的血清用封闭液进行稀释后加入ELISA板孔中,37℃孵育2 h,用PBST20缓冲液洗涤3次。将HRP标记的羊抗鼠IgG用封闭液进行1∶1000稀释,加入ELISA板孔中并于37℃孵育1 h,用PBS-T20缓冲液洗涤3次,加入OPD显色液室温反应30 min,加入2 mol/L H2SO4溶液终止反应后,用酶标仪测定OD492的吸光值,并用Fisher’s精确检验分析各组小鼠血清抗体水平的差异。
2 结果与分析
2.1 目的基因的PCR扩增
用引物对SpaA-1/SpaA-2、SpaA-3/SpaA-4和SpaA-5/SpaA-6经PCR从红斑丹毒丝菌C43065株基因组DNA中分别扩增出大小约为1.8、1.0和0.48 kb的片段(图1),与预期的目的基因片段大小基本一致。
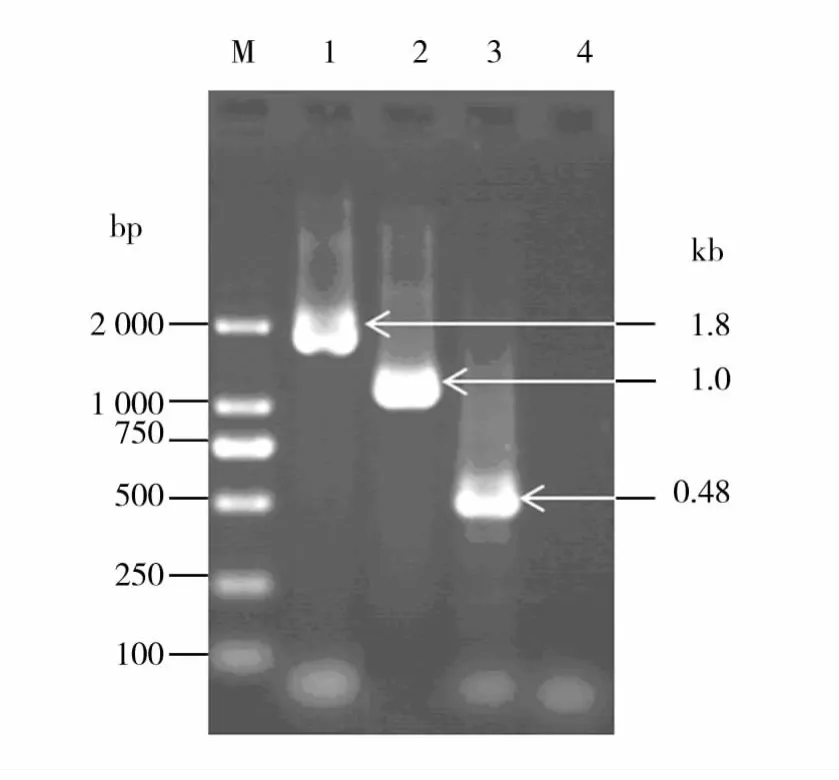
图1 红斑丹毒丝菌spaA基因及其N端序列和C端序列的PCR扩增Fig.1 Amplification of the spaA gene and its N-terminal region and C-terminal region of E.rhusiopathiae by PCR
2.2 重组表达质粒的酶切鉴定
琼脂糖凝胶电泳结果显示,用BamHⅠ和HindⅢ双酶切重组质粒pET-spaA、pET-spaA-N和pET-spaA-C 后观察到大小约为 1.8、1.0 和 0.48 kb的DNA片段(图2),与预期值相符。DNA测序结果表明这3条DNA片段大小分别为1794、1029和480 bp,分别编码597个氨基酸的成熟SpaA、342个氨基酸的N端保护序列SpaA-N和160个氨基酸的C端重复序列SpaA-C。
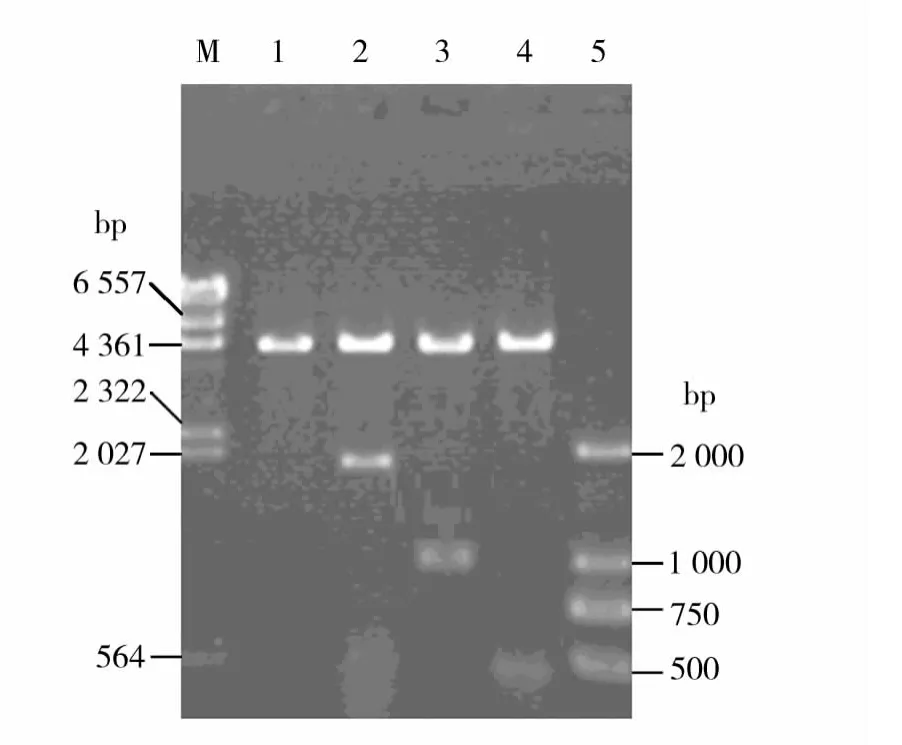
图2 重组质粒DNA的酶切鉴定Fig.2 Restriction analysis of recombinant plasmids digested with BamHⅠand HindⅢ
2.3 重组蛋白的表达和纯化
将重组菌用0.3 mmol/L的IPTG诱导4 h后,超声波破碎菌体,离心收集上清,SDS-PAGE检测目的蛋白的表达。结果显示在重组菌pET-spaA/BL21、pET-spaA-N/BL21 和 pET-spaA-C/BL21的超声波破碎液中分别观察到分子量约为86、58和38 ku的蛋白条带(图3)。由于表达载体多克隆位点上游有一个Trx编码序列(其产物分子量为20 ku)分别与SpaA、SpaA-N和SpaA-C融合表达,所以重组蛋白的分子量与理论值相符。采用镍离子亲和层析柱纯化得到了重组蛋白SpaA、SpaA-N和 SpaA-C,表达量分别为 42%、45%和48%(图3)。纯化后重组蛋白 SpaA、SpaA-N、SpaA-C和NaOH提取抗原的含量分别为1.34、1.65、1.42 和 0.9 mg/mL。
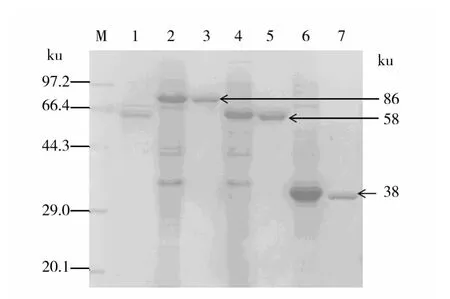
图3 SDS-PAGE检测重组蛋白的表达和纯化Fig.3 SDS-PAGE analysis of recombinant proteins and purified proteins
2.4 重组蛋白的免疫原性检测
2.4.1 重组蛋白 SpaA的免疫原性 Western blot结果显示(图4),抗重组SpaA免疫血清分别能与天然SpaA、重组SpaA、SpaA-N和SpaA-C发生特异性反应。分别在64、86、58和38 ku处有4条明显的蛋白条带(图4),表明重组蛋白SpaA具有良好的免疫原性。

图4 重组蛋白SpaA免疫原性的Western blot检测Fig.4 Immunogenicity of recombinant protein SpaA by Western blot
2.4.2 重组蛋白SpaA-N的免疫原性 Western blot结果显示(图5),抗重组SpaA-N免疫血清能与天然SpaA、重组SpaA和SpaA-N特异性结合,分别在65、86和58 ku处有3条明显的蛋白条带,但该免疫血清不能与38 ku的重组SpaA-C结合,表明重组蛋白SpaA-N具有良好的免疫原性和特异性。
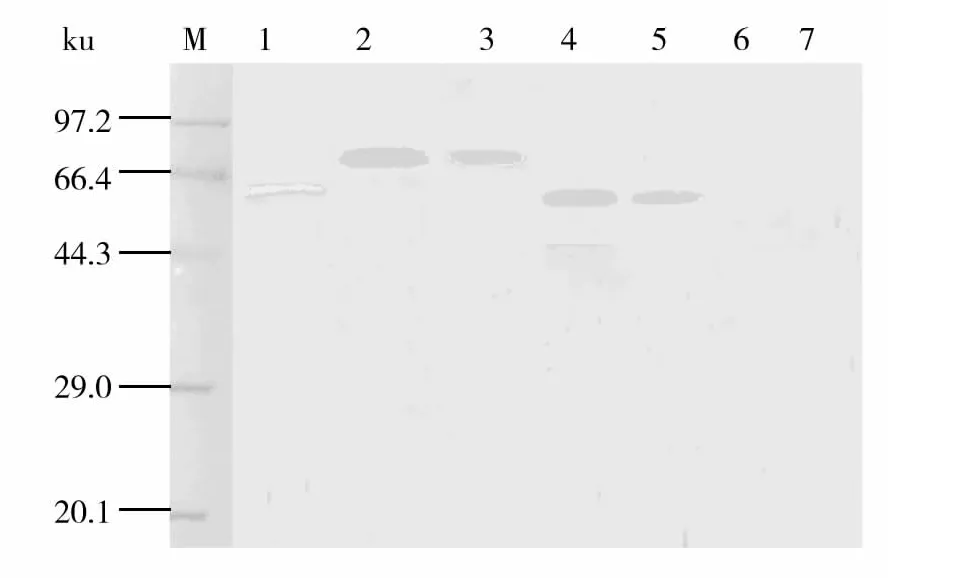
图5 重组蛋白SpaA-N免疫原性的Western blot检测Fig.5 Immunogenicity of recombinant protein SpaA-N by Western blot
2.4.3 重组蛋白 SpaA-C的免疫原性 Western blot结果显示(图6),抗重组SpaA-C免疫血清分别能与天然SpaA、重组SpaA和SpaA-C特异性结合,但该免疫血清不能与58 ku的重组SpaA-N结合,表明重组蛋白SpaA-C具有良好的免疫原性和特异性。

图6 重组蛋白SpaA-C免疫原性的Western blot检测Fig.6 Immunogenicity of recombinant protein SpaA-C by Western blot
2.5 攻毒前小鼠免疫血清的抗体效价
第3次免疫后7 d,各试验组小鼠经尾静脉采血及分离血清,以10 μg的重组SpaA为包被抗原,用间接ELISA检测攻毒前各试验组小鼠血清的抗体效价。ELISA检测结果表明,在不同免疫剂量的重组SpaA组、重组SpaA-N、重组SpaA-C组和NaOH提取抗原组小鼠血清中的抗体效价无显著差异(P<0.05),表明它们均能刺激小鼠体液免疫系统产生较高水平的免疫抗体。
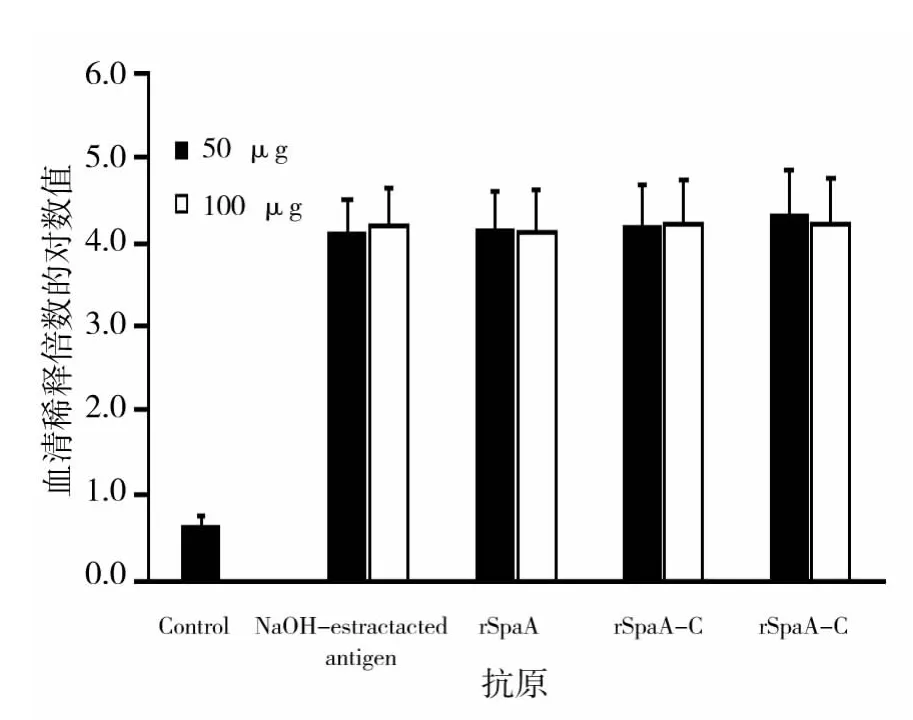
图7 攻毒前小鼠血清抗体效价的间接ELISA检测Fig.7 Antibody responses in the sera of mice immunized with NaOH-extracted protein,recombinant proteins SpaA,SpaA-N and SpaA-C
2.6 免疫保护试验
用不同类型的蛋白疫苗对小鼠皮下进行3次免疫后,再用250 LD50的C43065株对小鼠进行腹腔接种感染。生理盐水对照组和rSpaA-C组小鼠在攻毒后表现出虚弱、食欲下降、毛发起皱以及精神沉郁等症状,第2天开始死亡,到第6天全部死亡。NaOH提取抗原组、重组 SpaA组和重组SpaA-N组所有小鼠没有出现严重的发病症状,表明重组SpaA和SpaA-N均能完全保护小鼠受强毒株C43065的致死性感染(表2)。本研究表明SpaA的保护作用与其N端的342个氨基酸序列有关,而与其C端的160个氨基酸序列无关。

表2 重组蛋白SpaA、SpaA-N和SpaA-C对小鼠的保护作用Table 2 Protections in mice by immunized recombinant proteins SpaA,SpaA-N and SpaA-C
3 讨论
临床研究表明,血清型1和2的红斑丹毒丝菌是引起猪丹毒的致病菌,而其余血清型的红斑丹毒丝菌在猪败血症、荨麻疹、关节炎、淋巴结炎和心内膜炎中偶尔出现[16-17]。因此,在国内外用血清型1和2的菌株分别研制猪丹毒的弱毒苗和灭活苗,而这些疫苗只能预防特急性、急性和风疹性疾病,但无法预防该菌引起的慢性疾病[5-6]。Wang等[18]的综述中阐述血清型1和2红斑丹毒丝菌菌体表面的43、64和66 ku蛋白在猪丹毒的免疫预防中发挥重要的作用。Imada等[10]和吾鲁木汗等[12]的研究表明血清型1和血清型2红斑丹毒丝菌SpaA的保护作用与其N端342个氨基酸序列有关,而Makino等[9]的研究表明血清型2菌株SpaA的保护作用与其C端的160个氨基酸序列有关。上述研究结果表明SpaA是本菌的主要交叉保护性抗原,可以作为预防猪丹毒的亚单位疫苗,但是关于其C端160个氨基酸序列的保护作用还存在争议。所以,本研究为了阐明SpaA的保护区域,用大肠埃希菌表达系统分别对血清型2红斑丹毒丝菌的SpaA及其N端342个氨基酸序列和C端160个氨基酸序列进行表达和纯化,并检测它们对小鼠的保护作用。
小鼠保护试验结果显示重组SpaA和SpaA-N的保护率均为100%,而重组SpaA-C虽然具有较强的免疫原性但没有保护作用。Shimoji等[11]报道的重组SpaA-C对小鼠的保护率为20%,但是表达的重组SpaA-C是一个由181个氨基酸残基构成的多肽,与本研究表达的重组SpaA-C有21个氨基酸的差异。推测Shimoji等报道的SpaA-C的20%保护率可能与其N端的21个氨基酸序列有关。后来Makino等[19]发现SpaA的结构及其C端160个氨基酸序列(由20个氨基酸的8个重复序列)和肺炎链球菌胆碱结合蛋白之间有很高的同源性,而SpaA通过其C端重复序列能够与枯草芽胞杆菌和肺炎链球菌等革兰阳性菌细胞壁的脂磷壁酸(LTA)结合,这暗示了LTA-SpaA复合物可能在红斑丹毒丝菌致病过程中发挥重要的作用。本研究结果表明SpaA-N可以作为预防猪丹毒的亚单位疫苗,但SpaA-C致病作用及其致病机理尚未清楚。
[1]Takahashi T,Fujisawa T,Tamura Y,et al.DNA relatedness among Erysipelothrix rhusiopathiae strains representing all twenty-three serovars and Erysipelothrix tonsillarum[J].Int J Syst Bacteriol,1992,42(3):469-473.
[2]Fthenakis G,Christodoulopoulos G,Leontides L,et al.Abortion in ewes associated with Erysipelothrix rhusiopathiae[J].Small Ruminant Research,2006,63(1-2):183-188.
[3]Colavita G,Vergara A,Ianieri A.Deferment of slaughtering in swine affected by cutaneous erysipelas[J].Meat Sci,2006,72(2):203-205.
[4]Hassanein R,Sawada T,Kataoka Y,et al.Pathogenicity for mice and swine of Erysipelothrix isolates from the tonsils of healthy cattle[J].Vet Microbiol,2003,91(2-3):231-238.
[5]Eamens G,Forbes W,Djordjevic S.characterisation of Erysipelothrix rhusiopathiae isolates from pigs associated with vaccine breakdowns[J].Vet Microbiol,2006,115(4):329-338.
[6]Eamens G,Chin J,Turner B,et al.Evaluation of Erysipelothrix rhusiopathiae vaccines in pigs by intradermal challenge and immune responses[J].Vet Microbiol,2006,116(1-3):138-148.
[7]Kitajima T,Oishi E,Amimoto K,et al.Protective effect of NaOH-extracted Erysipelothrix rhusiopathiae vaccine in pigs[J].J Vet Med Sci,1997,60(1):9-14.
[8]Galan GE,Timoney JF.Cloning and expression in Escherichia coli of a protective antigen of Erysipelothrix rhusiopathiae[J].Infect Immun,1990,58(9):3116-3121.
[9]Makino S,Yamamoto K,Murakami S,et al.Properties of repeat domain found in a novel protective antigen,SpaA,of Erysipelothrix rhusiopathiae[J].Microb Pathog,1998,25(2):101-109.
[10]ImadaY,Goji N,Ishikawa H,et al.Truncated surface protective antigen(SpaA)of Erysipelothrix rhusiopathiae serotype 1a elicits protection against challenge with serotypes 1a and 2b in pigs[J].Infect Immun,1999,67(9):4376-4382.
[11]Shimoji Y,Mori Y,Fischetti V.Immunological characterization of a protective antigen of Erysipelothrix rhusiopathiae:identification of the region responsible for protective immunity[J].Infect Immun,1999,67(4):1646-1651.
[12]吾鲁木汗·那孜尔别克,张磊,何翠,等.猪丹毒丝菌天然SpaA和重组SpaA-N免疫保护效果的评价[J].微生物学报,2010,50(3):367-372.
[13]潘宏升,田素飞,年华,等.耐甲氧西林金黄色葡萄球菌的分子流行病学研究[J].微生物学杂志,2011,31(1):34-38.
[14]季爱加,宁喜斌.原核表达载体pET28a-EGFP的构建与表达[J].微生物学杂志,2011,31(4):69-73.
[15]Lo M,Boyce JD,Wilkie IW,et al.Characterization of two lipoproteins in Pasteurella multocida[J].Microbes and Infection,2004,6(1):58-67.
[16]Opriessnig T,Hoffman LJ,Harris DL,et al.Erysipelothrix rhusiopathiae:genetic characterization of midwest US isolates and live commercial vaccines using pulsed-field gel electrophoresis[J].J Vet Diagn Invest,2004,16(2):101-107.
[17]Takahashi T,Nagamine N,Kijima M,et al.Serovars of Erysipelothrix strains isolated from pigs affected with erysipelas in Japan[J].J Vet Med Sci,1996,58(6):587-589.
[18]Wang Q,Chang BJ,Riley TV.Erysipelothrix rhusiopathiae[J].Vet Microbiol,2010,140(3):405-417.
[19]Makino SI,Yamamoto K,Asakura H,et al.Surface antigen,SpaA,of Erysipelothrix rhusiopathiae binds to Gram-positive bacterial cell surfaces[J].FEMS Microbiol Lett,2000,186(2):313-317.