结核分枝杆菌Rv0733-6His抗原羊驼单域重链抗体的筛选与鉴定
2013-10-25蔡家麟陈建霞曾思良廖万清余秀珍
潘 欣,蔡家麟,王 颖,陈建霞,曾思良,方 伟,陈 敏,廖万清,余秀珍,张 俊,宋 维
(1.上海俊维寓医馆,上海 200433;2.第二军医大学,上海 200433;3.上海交通大学基础医学院,上海 200025;4.上海市肺科医院,上海 200433)
由重链可变区结合抗原的单一结构域构成的抗体称为单域重链抗体(variable domain of the heavy-chain of heavy-chain antibody,VHH),VHH具有分子量小、稳定性高、体内组织渗透性好、可溶性好、易表达、抗原识别表位独特等特性[1],在胞内应用作为治疗性抗体中和病原体抗原、提高巨噬细胞杀菌的潜力日渐凸显。结核分枝杆菌H37Rv菌株中的Rv0733抗原基因名为adk,抗原名为腺苷酸激酶,分子量约20.09 ku,对该菌在细胞内的核苷酸代谢发挥作用[2]。本研究以已纯化的原核表达的Rv0733-6His融合抗原[3]为包被抗原,从课题组已构建达到109的羊驼非免疫单域重链抗体库[4]中筛选针对该抗原的特异性重链可变区抗体,并构建 VHH-FC人源化抗体,通过ELISA和Western的方法验证其亲和力。
1 材料与方法
1.1 材料
1.1.1 质粒、菌株、抗原与细胞 pCANTAB5E质粒和辅助噬菌体M13KO7为美国Amersham Biosciences公司产品;携带人Fc片段的pET-22b-IFH质粒、携带pCANTAB5E-VHH噬菌体抗体库的大肠埃希菌TG1菌株、XL1-Blue菌株、60 ku-6His、Rv0733-6His融合抗原和人白血病单核THP-1细胞为上海交通大学基础医学院王颖课题组保存。牛型结核分枝杆菌(Mycobacterium bovis)、无毒疫苗株卡介苗(Bacille Calmette-Guerin,BCG)为上海市肺科医院保存。BL21(DE3)PLySs感受态细胞为日本TaKaRa公司产品。
1.1.2 主要试剂与仪器 辣根过氧化物酶(horseradish peroxidase,HRP)标记的鼠抗噬菌体M13主要衣壳蛋白单克隆抗体为美国GE Healthcare公司产品,HRP标记的山羊抗人IgG二抗和键合了Alexa 594的羊抗人IgG为美国Jakson公司产品,IRDye 700羊抗人IgG(H+L)红色荧光二抗为美国Licor Biosciences公司产品,质粒抽提试剂盒和胶回收试剂盒为美国Axygen公司产品,限制性内切酶为美国New England Biolabs公司产品,2×聚合酶链式反应预混试剂为日本TaKaRa公司产品,异丙基-β-D-硫代半乳糖苷(IPTG)、His-Select镍亲和琼脂糖微珠和佛波酯(phorbol myristate acetate,PMA)为美国 Sigma公司产品,16%多聚甲醛为美国Polysciences公司产品,Image-iT FX信号增强剂为美国Invitrogen公司产品。3 ku超滤离心管为美国Millipore公司产品,Olympus IX81荧光显微镜购于日本Olympus公司,Odyssey双色红外荧光成像系统购于美国Licor Biosciences公司。
1.2 方法
1.2.1 噬菌体VHH抗体库的制备 取1 mL携带pCANTAB5E-VHH噬菌体抗体库的冻存TG1菌液,在400 mL 2×YTAG培养基中37℃振摇培养至A600为0.6。按 MOI=20∶ 1的比例加入辅助噬菌体M13KO7,最终浓度为1010pfu/mL,室温静置20 min。37℃振摇培养1 h,加入卡那霉素至终浓度为50 μg/mL,并加IPTG至终浓度为0.1 mmol/L。于30℃振摇培养10 h。4℃、8000 r/min离心10 min,收获培养上清,加入1/5体积预冷的含20%PEG 8000的2.5 mol/L NaCl溶液混匀,冰浴60 min。4℃、12000 r/min离心20 min,弃上清,噬菌体沉淀重悬于PBS缓冲液中,即为VHH抗体库溶液,4℃保存备用。
1.2.2 噬菌体VHH抗体库的筛选 将Rv0733-6His融合抗原用pH 9.6的碳酸盐缓冲液稀释为10 μg/mL,以1 mL包被免疫管,4℃过夜。PBS洗3次后,用含2%BSA的PBS于37℃封闭1 h。将1 mL噬菌体抗体库加至封闭后的免疫管中,37℃结合1 h。用PBST(含0.05%Tween20的PBS)洗10次,PBS洗5次。分2次洗脱,每次加入1 mL 甘氨酸洗脱缓冲液(0.1 mol/L HCl,0.2 mol/L甘氨酸,pH 2.2),室温摇动10 min,吸出洗脱液,用1 mol/L Tris中和至pH 7.4。吸出洗脱液合并于4℃保存。将洗脱的噬菌体用10倍体积的XL1-Blue菌室温感染30 min,转入37℃振摇培养1 h,离心,弃上清,用原培养基1/10体积的新鲜培养基重悬沉淀,取10 μL菌液做梯度稀释,分别取 100 μL 梯度为 10-4、10-5、10-6和 10-7的菌液涂LB板,做2个复板,次日计数菌落形成单位(colony-forming unit,cfu),计算得到的库容。其余菌液涂于含10 μg/mL四环素和50 μg/mL氨苄青霉素的双抗2×YTAG培养板,37℃培养过夜。刮下的菌落一部分用于保留菌种,一部分按1.2.1方法制备VHH抗体库溶液投入第2轮筛选。按照抗原包被浓度依次递减(第2轮筛选所用抗原浓度为 5 μg/mL,第 3 轮为 2.5 μg/mL)的方法反复进行3轮淘筛,随机从每一轮筛选后的双抗2×YTAG培养板上挑选20个克隆,送上海华津生物科技有限公司测序,以监测筛选过程中插入片段终止密码子出现的几率,若超过50%则重新筛选。阳性测序结果使用DNAMAN软件进行序列比对分析。
1.2.3 ELISA检测单克隆VHH抗体的结合活性在2 mL规格的96孔培养板中,每孔加入300 μL 2×YTAG,挑单菌落接种各孔。封膜后,37℃静置培养过夜。次日,取新的96孔板,各孔加入300 μL 2 ×YTAG,加入 50 μL(1∶7)过夜培养的菌液,37 ℃振摇培养 1 ~1.5 h 至 A600≈0.6。每孔加入50 μL含有M13KO7(滴度 >1012pfu/mL)的YT培养基,室温静置60 min,37℃ 振摇培养1 h,然后加入100 μL含终浓度为50 μg/mL卡那霉素和终浓度为0.1 mmol/L IPTG的2×YT培养基,30℃培养过夜。将96孔培养板呈现的噬菌体3300 r/min离心30 min。上清分别加入BSA至终浓度2%,Tween-20至终浓度0.1%,37℃静置预封闭15 min,为预封闭的呈现Rv0733-VHH抗体的噬菌体。用1 μg/mL的Rv0733-6His融合抗原按100 μL/孔包被ELISA酶标板,酶标板仅包被PBS的孔设为空白对照,包被用pCANTAB5E制备的噬菌体的孔为阴性对照,4℃过夜;PBST洗后,每孔用200 μL含2%BSA 和0.1%Tween-20的PBS于37℃封闭1 h;PBST洗后,每孔加入100 μL预封闭的呈现Rv0733-VHH抗体的噬菌体,37℃孵育2 h;PBST洗后,每孔加入100 μL 1∶5000稀释的HRP标记的鼠抗M13二抗,37℃孵育1 h;洗板后,每孔加入100 μL邻苯二胺(ophenylenediamine,OPD)底物,暗处显色 30 min,每孔再加入50 μL 2 mol/L硫酸终止反应,于490 nm测定OD值。实验组OD490值高于阴性组2.1倍以上为阳性,保留对应序号的菌株。
1.2.4 Rv0733-VHH抗体的人源化改造 用质粒抽提试剂盒抽提经Rv0733-6His抗原筛选到的阳性菌株中的pCANTAB5E-VHH质粒,并以此为模板用PCR方法扩增其中的VHH片段。上游引物引入 NheⅠ酶切位点,序列为 TAATTAG CTAGCGGAGACGGTGACCTGGGT;下游引物引入BamHⅠ酶切位点,序列为 AATAAGGATCCGA TGGCCCAGGTGCAGCT。PCR反应中 pCANTAB5E-VHH质粒使用10 ng,反应混合物中含1×聚合酶链式反应预混试剂和300 nmol/L上下游引物,反应条件为94℃ 5 min;94℃ 30 s,55℃25 s,72℃ 1 min,30个循环。PCR产物经琼脂糖凝胶电泳回收。应用NheⅠ和BamHⅠ限制性内切酶及DNA重组技术将酶切后的PCR扩增产物插入携带人Fc片段和6His标签的酶切线性化的pET-22b-IFH载体中,构建成 pET-22b-Rv0733-VHH-IFH原核表达载体,送上海华津生物科技有限公司测序,确认读框正确。
1.2.5 Rv0733-VHH-Fc-6His人源化融合抗体的原核表达与纯化 携带pET-22b-Rv0733-VHHIFH质粒的菌种接种200 mL LB培养基(含50 μg/mL氨苄青霉素),37℃振摇至A600为0.6后,加入终浓度为0.1 mmol/L的IPTG,30℃振摇6 h,进行诱导表达。7000 g离心3 min,收集细菌沉淀;用20 mL细菌裂解液(50 mmol/L NaH2PO4,300 mmol/L NaCl,10 mmol/L 咪唑,pH 8.0)重悬菌体沉淀,超声法充分裂解细菌;4℃ 8000 g离心30 min,取上清,为粗提蛋白,经 0.45 μm 过滤器过滤后,加入1 mL镍亲和琼脂糖微珠,4℃ 旋转混合过夜;次日用含20 mmol/L咪唑的PBS缓冲液(50 mmol/L NaH2PO4,300 mmol/L NaCl,20 mmol/L咪唑,pH 8.0)充分洗涤,离心弃上清,以去除未与镍亲和琼脂糖微珠结合或结合不紧密的杂蛋白;最后用含300 mmol/L咪唑的PBS缓冲液(50 mmol/L NaH2PO4,300 mmol/L NaCl,300 mmol/L咪唑,pH 8.0)洗脱目的蛋白。将洗脱纯化的蛋白经3 ku超滤离心管超滤,去除咪唑等小分子,再用0.22 μm过滤器浓缩过滤,滤液加入终浓度为40%的无菌甘油,制成纯化Rv0733-VHHFc-6His蛋白样品,置-80℃冰箱备用。
1.2.6 Rv0733-VHH-Fc-6His人源化融合抗体的鉴定 分别将粗提和纯化后的融合抗体用Bradford方法进行蛋白定量,取等量总蛋白进行10%SDS-PAGE电泳,考马斯亮蓝G-250染色,评估纯化前后的效果。Rv0733-6His和60 ku-6His融合蛋白经12%SDS-PAGE电泳分离,电转移到聚偏二氟乙烯膜(polyvinylidenefluoride,PVDF),用含3%BSA的PBS封闭液室温缓慢振摇封闭1 h后,再与1∶1000稀释的Rv0733-VHH-Fc-6His人源化融合抗体4℃孵育过夜。洗膜后与1∶5000稀释的荧光标记的IRDye 700羊抗人二抗室温避光振摇孵育1 h。通过双色红外荧光成像系统扫描成像。
1.2.7 免疫荧光检测Rv0733-VHH-Fc-6His与胞内BCG的结合能力 将人白血病单核THP-1细胞以3×106细胞/孔的密度接种于放有无菌盖玻片的6孔板内,加入终浓度为50 ng/mL的PMA,孵育24 h后,THP-1细胞分化为巨噬细胞。培养于7H9液体培养基中的BCG用完全1640培养基洗后,用无菌玻璃珠充分研磨。以10∶1(细菌∶细胞)的比例用BCG感染分化后的THP-1细胞,在37℃ 5%CO2孵箱中放置10 h后,用PBS洗3次,4%多聚甲醛固定 30 min,PBS洗后,用含0.5%Triton X-100的 PBS透化30 min,用 ImageiT FX信号增强剂封闭30 min。PBS洗后,加入1∶500稀释的Rv0733-VHH-Fc-6His一抗室温孵育2 h。PBS洗后,加入1∶1000稀释的键合了Alexa 594的羊抗人IgG二抗室温孵育1 h。洗后干燥的爬片用含DAPI的中性树胶在载玻片上装片,指甲油封片。
2 结果与分析
2.1 羊驼非免疫重链单域抗体库的筛选富集效果
用结核分枝杆菌Rv0733-6His融合抗原对羊驼非免疫重链单域抗体库按抗原包被浓度依次递减方法进行3轮固相筛选,库容量从109缩减为4×103,结合活性(OD 值)从 0.3 ~0.6 提升为2.5~2.8(表1)。为了动态监控筛选富集效果,在每轮筛选的文库中随机挑取20个克隆进行测序,若阳性克隆出现高于10个,并且终止密码数量小于10%,则直接投入单克隆VHH抗体的ELISA结合活性筛选。ELISA筛选时设定阳性孔OD值和阴性孔比值为2.1且阳性孔读数大于0.2、阴性孔读数小于0.1为阈值,本研究从1024个克隆中筛选到13个阳性克隆(有3个重复序列)共10个独立序列(图1)。
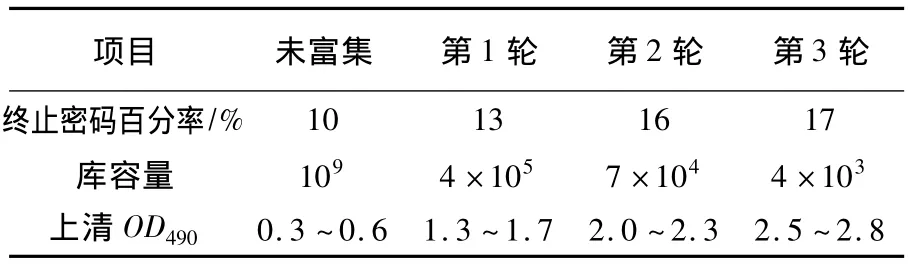
表1 羊驼非免疫重链单域抗体库富集效果Table 1 Enriched effect of non-immune Llama variable heavy chain phage display antibody library
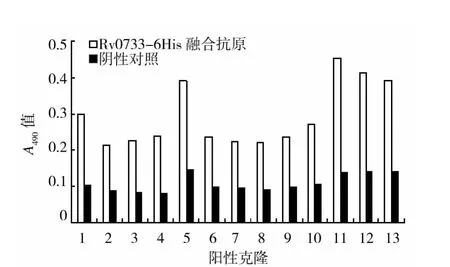
图1 ELISA检测与Rv0733-6His融合抗原有特异结合活性的VHH抗体分子Fig.1 ELISA detection the Rv0733-6His fusion protein binding specificity to the molecules of variable domain of heavy chain of heavy-chain antibody
2.2 Rv0733-6His-VHH抗体的序列分析
将筛选得到的13个阳性克隆用DNAMAN软件进行序列分析,结果提示筛选到的 Rv0733-6His-VHH抗体片段的长度并不统一,长短差异主要来自CDR3区的不同。13个阳性克隆的DNA编码序列的同源性分析见图2,蛋白序列的同源性比对分析(重复的序列已被删除)见图3。

图2 Rv0733-VHH噬菌体抗体库中13个克隆DNA同源比对树状图Fig.2 Phylogenetic tree of the genes of ten clones from Rv0733-VHH phage display library

图3 Rv0733-VHH抗体库中10个克隆编码蛋白序列比对Fig.3 Amino acids sequence aligment of ten clones from Rv0733-VHH phage display library
2.3 Rv0733-VHH-Fc-6His人源化融合抗体的原核表达、纯化及鉴定
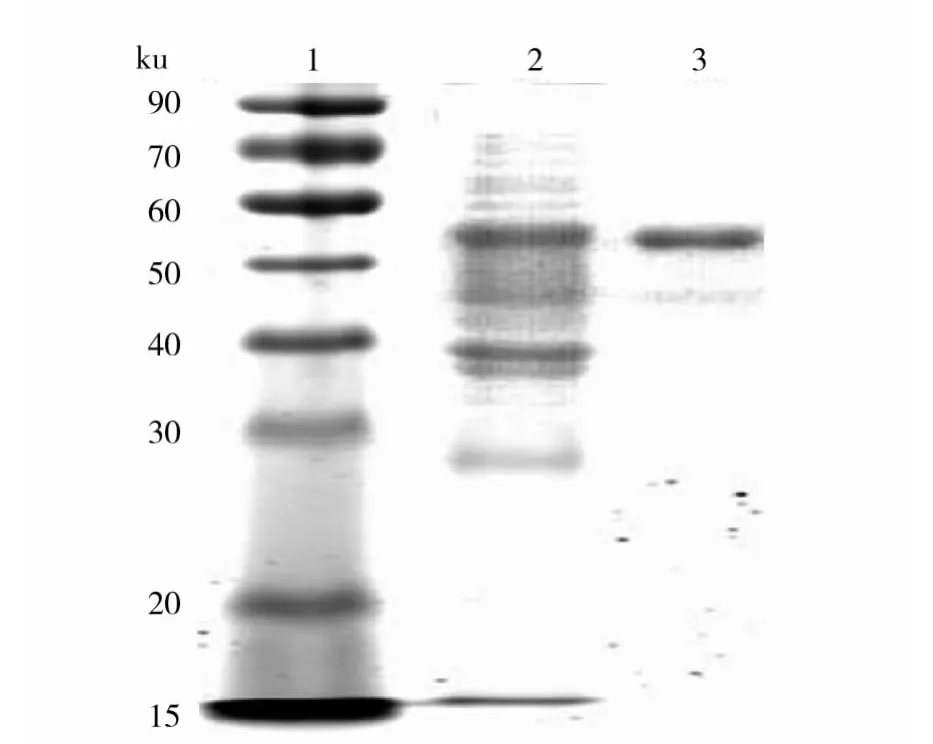
图4 SDS-PAGE检测Rv0733-VHH-Fc-6His融合蛋白的表达和纯化Fig.4 Expression and purification of Rv0733-VHH-Fc-6His fusion protein detected with SDS-PAGE
用质粒抽提试剂盒抽提8c1号克隆的pCANTAB5E-VHH-8c1质粒,PCR扩增 VHH序列,经NheⅠ/BamHⅠ酶切后插入用相应酶切线性化的原核表达载体 pET-22b-IFH,转化 BL21(DE3)PLySs感受态细菌,获得重组融合蛋白Rv0733-VHH-Fc-6His的原核表达载体pET-22b-Rv0733-VHH-IFH。取测序正确的单克隆菌种经IPTG诱导后大量表达。将细菌裂解上清及用镍亲和琼脂糖微珠亲和层析法纯化的目的蛋白进行10%SDS-PAGE电泳,结果可见相对分子质量50 ku和60 ku附近的浓染条带,与理论值(54.63 ku)大小相符(图4)。
将Rv0733-6His和60 ku-6His融合蛋白进行Western Blot检测,由于IRDye 700羊抗人IgG二抗可与一抗的 Fc段结合,而 Rv0733-VHH-Fc-6His一抗可以与Rv0733-6His抗原结合,在20.93 ku的位置得到了目的条带Rv0733-6His融合蛋白;由于60 ku处未显示结合条带,提示Rv0733-VHH-Fc-6His一抗不与60 ku-6His蛋白结合,也即筛选表达纯化的Rv0733-VHH-Fc-6His抗体具有Rv0733抗原结合专一性,未显示与6His标签结合的特异性(图5)。
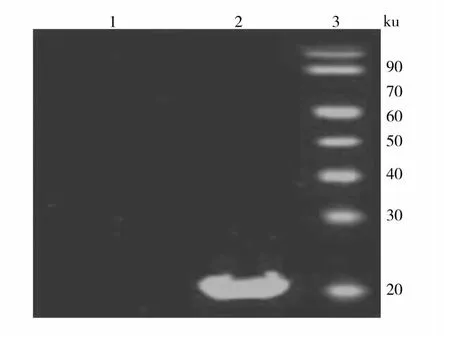
图5 Rv0733-VHH-Fc-6His抗体的抗原结合特异性检测Fig.5 Analysis the specificity of Rv0733-VHH-Fc-6His antibody binding with target antigen
2.4 Rv0733-VHH-Fc-6His可与吞入胞内的BCG结合
由于结核分枝杆菌和卡介苗(BCG)均可表达Rv0733,因此本研究选择较为经济的BCG来验证Rv0733-VHH-Fc-6His的结合活性。THP-1细胞经PMA诱导后发生巨噬细胞样变化,可吞噬BCG活菌,经10 h感染,可见细胞内发红色荧光的BCG可与发蓝色荧光的细胞核共定位。提示BCG表达在细菌表面的Rv0733可与纯化的Rv0733-VHH-Fc-6His抗体结合(图6)。
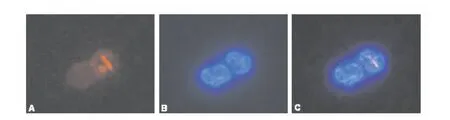
图6 Rv0733-VHH-Fc-6His抗体可结合胞内的BCGFig.6 Rv0733-VHH-Fc-6His binding with BCG in differentiated THP-1 cells
3 讨论
本研究曾用Rv0733-6His抗原包被酶标板分别检测34例结核患者和35例健康体检者血清,2组之间 t检验无显著差异(P=0.306),提示Rv0733抗原(腺苷酸激酶)在结核患者体内不能激发显著的体液免疫,因此其虽然为膜抗原,但不适合用作临床诊断标志;然而由于结核分枝杆菌在宿主体内主要寄居在巨噬细胞内,该抗原对胞内结核分枝杆菌核酸的生物合成起重要作用,本研究设想若能筛选到Rv0733抗原的VHH抗体,利用其分子量小、渗透能力强的特性[5]来中和胞内菌产生的抗原,或可提高吞噬细胞清除胞内菌的能力。
通常采用标准的免疫程序(完全和不完全弗氏佐剂先后与50 μg~1 mg免疫原混合分3~4次免疫动物)免疫单只骆驼科动物,可获得滴度较好的特异性VHH[6]。受羊驼价格因素影响,本研究主要采用源自上海动物园非免疫羊驼血液构建的羊驼非免疫单域重链抗体库。从非免疫动物构建的文库中筛选到的VHH通常仅占免疫所得的10%[7]。由于本研究使用的噬菌体抗体库存在无法预测的阅读框和终止密码,过多的终止密码将阻止融合gⅢ基因的表达[8],干扰VHH在噬菌体表面的展示。因此,为有效控制噬菌体抗体库筛选过程中抗体片段终止密码的大量增加,本研究将初始菌浓度调整为 A600在0.05~0.10之间,增菌时间控制在A600达到0.6,从而较好地把握了大库容非免疫抗体库筛选成功的关键,将富集的噬菌体克隆终止密码控制在20%以内。本研究从1024个克隆中筛选到10个长短不同的独立序列,其差异主要体现在VHH高度异变的CDR3区域序列长短的不同。由于VHH缺乏CH1区,也即缺乏糖基化位点[9],适合采用原核系统表达来探讨VHH与传统抗体差异显著的CDR区的功能性折叠是否可与相关抗原结合。为便于纯化、检测并避免Rv0733-6His融合抗原中的6His标签在筛选过程中可能引发的非特异性结合对后续研究产生干扰,本研究选择了携带有人Fc片段和6His标签的原核表达载体对筛选到的编号为8c1的克隆进行了原核表达。免疫印迹结果提示,原核表达纯化的Rv0733-VHH-Fc-6His融合抗体可以特异性地结合Rv0733-6His融合抗原,免疫荧光显微结果提示该融合抗体可以与胞内的BCG在细菌表面表达的Rv0733结合,提示从羊驼非免疫单域重链抗体库中筛选到的Rv0733-VHH具备结合胞内牛型结核分枝杆菌相关抗原的潜力。
Rv0733-VHH是否能在胞内结合结核分枝杆菌相关抗原提高巨噬细胞除菌能力,还有待继续深入研究。
[1]潘欣,潘伯驹,蔡家麟,等.单域抗体研究进展[J].生命科学,2012,24(5):404-410.
[2]Meena LS,Dhakate SR,Sahare PD.Elucidation of Mg2+binding activity of adenylate kinase from Mycobacterium tuberculosis H37Rv using fluorescence studies[J].Biotechnol Appl Biochem,2012,59(6):429-436.
[3]蔡家麟,潘欣,王颖,等.结核分枝杆菌融合抗原 Rv3914-6His的原核表达、纯化与抗原性检测[J].微生物学杂志,2013,33(4):12-17.
[4]吴标,王树军,夏立亮,等.羊驼非免疫重链单域抗体库的构建和鉴定[J].现代免疫学,2011,3l(5):353-357.
[5]Vincke C,Loris R,Saerens D,et al.General strategy to humanize a camelid single-domain antibody and identification of a universal humanized nanobody scaffold[J].J Biol Chem,2009,284(5):3273-3284.
[6]Riechmann L,Muyldermans S.Single domain antibodies:comparison of camel VH and camelised human VH domains[J].J Immunol Methods,1999,231(1-2):25-38.
[7]Harmsen MM,De Haard HJ.Properties,production,and applications of camelid single-domain antibody fragments[J].Appl Microbiol Biotechnol,2007,77(1):13-22.
[8]Pande J,Szewczyk MM,Grover AK.Phage display:concept,innovations,applications and future[J].Biotechnol Adv.,2010,28(6):849-858.
[9]Saccodossi N,De Simone EA,Leoni J.Structural analysis of effector functions related motifs,complement activation and hemagglutinating activities in Lama glama heavy chain antibodies[J].Vet Immunol Immunopathol,2012,145(1-2):323-331.