抑制组蛋白去乙酰化酶6对帕金森病细胞模型中α-突触核蛋白寡聚体的影响☆
2013-09-14王飞杜芸兰卫立辛李焰生
王飞杜芸兰卫立辛李焰生
α-突触核蛋白异常聚集形成的寡聚体在帕金森病(Parkinson's disease,PD)的发病过程中起重要作用,它使胞浆内游离的多巴胺增多,也可以诱导线粒体功能紊乱,最终导致多巴胺能神经元死亡[1]。已有研究显示,在PD果蝇模型中,组蛋白去乙酰化酶6(histone deacetylase 6,HDAC6)基因的敲除能加重神经元的退行性变,这可能与α-突触核蛋白寡聚体水平的升高有关[2]。因此,本实验拟制作异常蛋白质聚集的PD模型,观察抑制HDAC6对α-突触核蛋白寡聚体及热休克蛋白(heat shock protein,HSP)的影响,以探究HDAC6缺乏是否通过调节HSP的表达而影响寡聚体的水平。本研究结果将为明确HDAC6在PD发病中的作用以及探索其应用价值提供实验依据。
1 材料与方法
1.1 细胞培养人神经母细胞瘤SK-N-SH细胞培养于DMEM高糖培养液中,含10%胎牛血清及1%青/链霉素。细胞置于37℃、5%CO2培养箱中,每3~4 d换液,单层细胞汇合至80%~90%时使用0.05%胰蛋白酶消化传代。
1.2 α-突触核蛋白基因稳定转染SK-N-SH细胞α-突触核蛋白重组质粒经PCR鉴定、测序后大量抽提质粒DNA,并使用Lipofectamine 2000(Invitrogen,美国)将其转入SK-N-SH细胞。之后用含500 μg/mL G418的完全培养基进行筛选,待细胞克隆成团,将其挑至96孔板中培养,鉴定,扩大培养。转染细胞培养于含250 μg/mL G418的完全培养基中。
1.3 噻唑蓝(MTT)比色法检测细胞存活率将lactacystin(Calbiochem,德国)、tubacin(Enzo,美国)溶于二甲亚砜(dimethylsulfoxide,DMSO)中备用。转染细胞接种于96孔培养板中,并设DMSO对照组、lactacystin组、tubacin+lactacystin组和tubacin组。lactacystin 组终浓度为 5 μmol/L[3],tubacin 组设 1 μmol/L、5 μmol/L、10 μmol/L、20 μmol/L四个浓度组。24 h后,每孔换100μL新鲜培养液,并加入20 μL MTT(5 mg/mL),继续培养 4 h后去除培养液,每孔加入100μL DMSO,摇床低速振荡10 min,酶标仪检测490 nm处吸光度。
1.4 蛋白免疫印迹法(Western blot)检测α-突触核蛋白及其寡聚体、HSP70及HSP27的表达水平提取各组细胞蛋白,煮沸5 min后按每组40 μg上样,进行聚丙烯酰胺凝胶电泳,然后转印至聚偏二氟乙烯(Poly vinylidene fluoride,PVDF)膜,室温封闭 1 h后加抗α-突触核蛋白(1:1000,sigma,美国)、HSP70(1:1000,Cell Signaling Technology,美国)或HSP27(1:5000,Santa Cruz,美国)抗体,4 ℃孵育过夜。次日洗膜后加入相应二抗(1:5000~1:10000,Li-cor,美国),室温孵育1 h后,红外荧光扫描检测膜上蛋白的表达。
1.5 斑点印迹杂交法(Dot blot)检测寡聚体水平取各组蛋白各3 μL点于硝酸纤维素膜上,风干后室温封闭 1 h,加抗寡聚体(1:3000,Invitrogen,美国)抗体,4℃孵育过夜。次日洗膜后,加入相应二抗,室温孵育1 h,用红外荧光扫描检测寡聚体的水平。
1.6 统计学方法应用SPSS17进行处理,数据以均数±标准差方式表示,行方差齐性检验与单因素方差分析(one-way analysis of variance,ANOVA),多组之间均数两两比较采用Student-Newman-Keuls(SNK)法。检验水准α=0.05。
2 结果
2.1 稳定转染细胞α-突触核蛋白表达的鉴定Western blot结果显示α-突触核蛋白转染组较空载体转染组α-突触核蛋白表达水平明显增高(P<0.05),提示α-突触核蛋白基因成功转入SKN-SH细胞并表达(见图1)。
2.2 不同浓度HDAC6抑制剂对细胞存活率的影响 与DMSO对照组相比,lactacystin组细胞活力明显降低,加入tubacin后的细胞存活率进一步降低。不同浓度tubacin组(1 μmol/L、5 μmol/L、10 μmol/L)组间相比,浓度越高,细胞存活率越低(P<0.05),但 1 μmol/L tubacin+lactacystin 组与lactacystin组、20 μmol/L tubacin+lactacystin组与10 μmol/L tubacin+lactacystin组细胞存活率的差异无统计学意义(P>0.05)。故选用10 μmol/L作为后续实验tubacin的用药浓度。不含lactacystin的不同浓度tubacin处理的细胞组与DMSO对照组相比,细胞存活率的差异无统计学意义(P>0.05,见图2)
2.3 抑制HDAC6对寡聚体及α-突触核蛋白寡聚体水平的影响与DMSO对照组相比,lactacystin使寡聚体增多,抑制HDAC6后lactacystin组细胞寡聚体水平进一步升高。同样,只用HDAC6抑制剂处理的细胞与DMSO对照组细胞相比,寡聚体水平无明显统计学差异(见图3)。
α-突触核蛋白单体分子量为19kD,病理状态下折叠为不同分子量的寡聚体形式。使用western blot检测4组细胞中α-突触核蛋白寡聚体水平,结果显示α-突触核蛋白寡聚体的变化与总寡聚体的变化趋势相一致,见图4。上述差异均有统计学意义(P<0.05,见图4)。

图1 Western blot鉴定α-突触核蛋白的表达 。
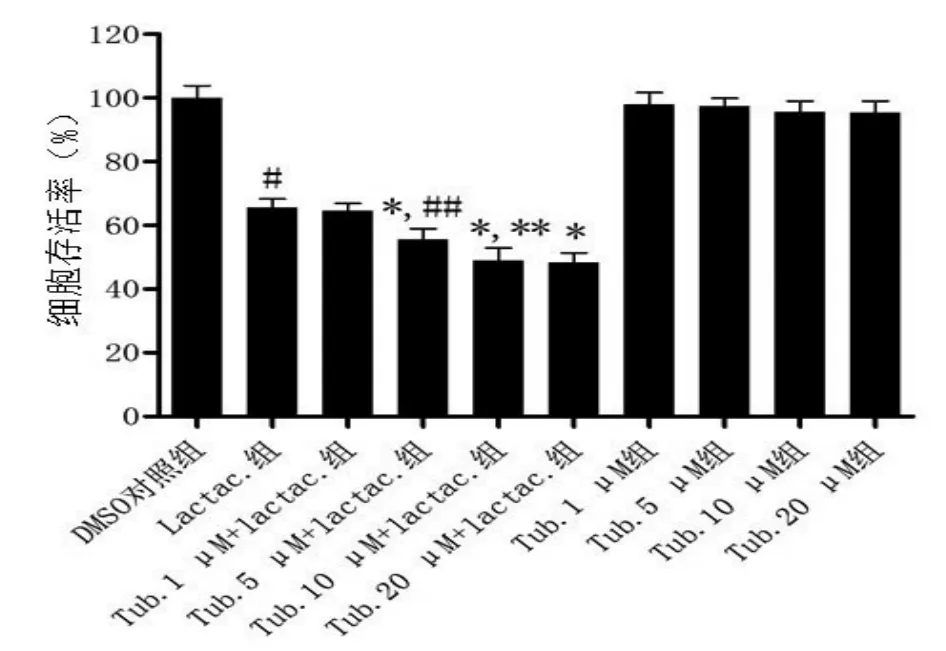
图2 MTT检测不同浓度HDAC6抑制剂对细胞存活率的影响。
2.4 抑制HDAC6对HSP70及HSP27表达水平的影响 与DMSO对照组相比,lactacystin组的HSP70及HSP27表达水平升高(P<0.05),但加入tubacin后其表达水平均较lactacystin组显著降低(P<0.05)。单用Tubacin处理的对照组细胞与DMSO对照组细胞相比,HSP表达量无明显差异(P>0.05,见图5)。

图3 Dot blot检测抑制HDAC6对寡聚体水平的影响。
3 讨论
帕金森病的主要病理表现为中脑黑质多巴胺能神经元选择性丢失和残存神经元中出现包涵体[4]。包涵体的主要成分是α-突触核蛋白,其异常聚集形成的寡聚体是引起神经退行性变的毒性形式[5],故以影响α-突触核蛋白寡聚体的因素为靶点的研究具有重要价值。
本研究采用的PD细胞模型中,胞内含有大量α-突触核蛋白寡聚体,体现了PD的病理学特征,说明此模型可以为后续深入研究PD发病机制及可能治疗靶点提供新的平台。在本研究中,PD模型细胞的HDAC6活性被抑制后,α-突触核蛋白寡聚体水平升高、细胞存活率降低,说明抑制HDAC6将加重损害。与此结果相似的是,Du等[2]在PD果蝇模型中通过免疫荧光染色也发现,HDAC6敲除使α-突触核蛋白寡聚体数量增多,从而诱导多巴胺能神经元的丢失。但本实验使用的蛋白免疫印迹法将α-突触核蛋白寡聚体量化,能更加直观、深入地体现其表达水平的变化,且PD模型细胞来源于人,实验结果可能更真实地反映各因子在PD发病及进展过程中的改变。
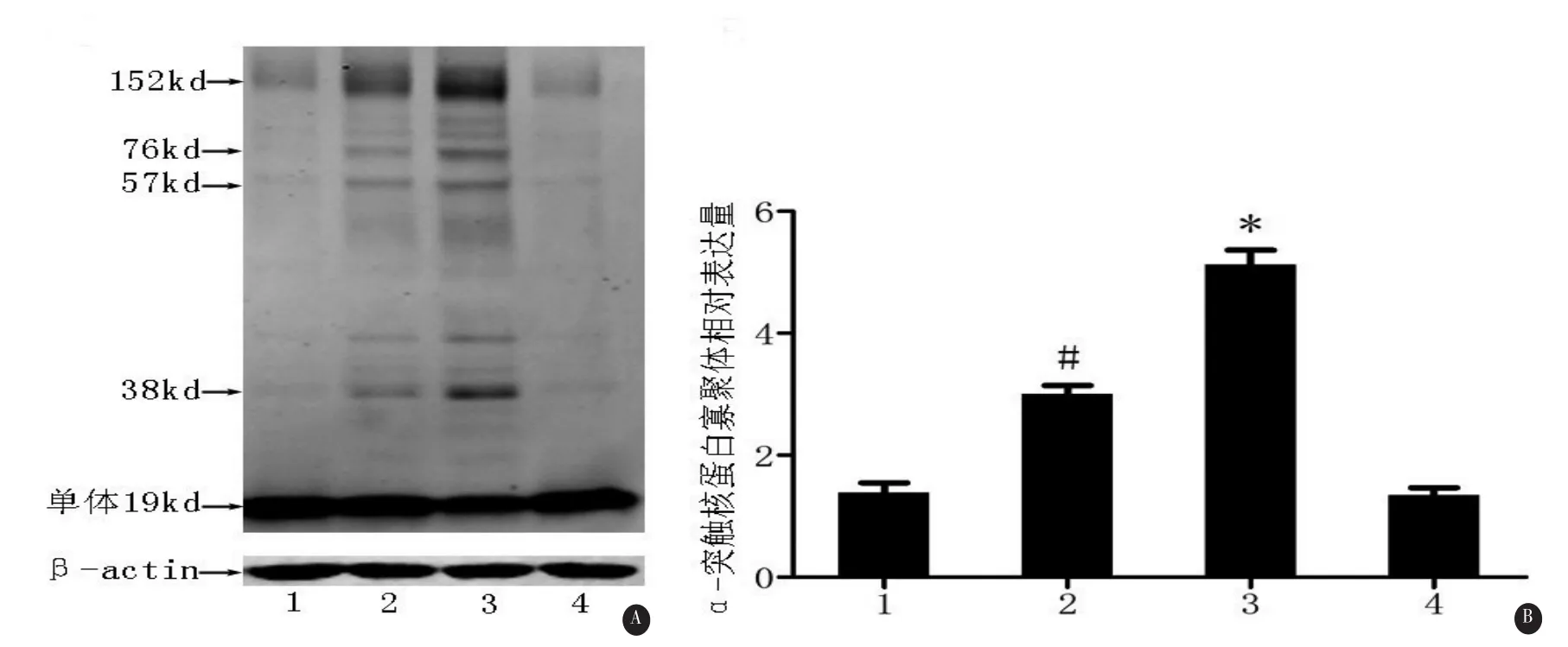
图4 Western blot检测抑制HDAC6对α-突触核蛋白寡聚体水平的影响。
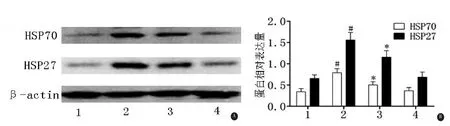
图5 Western blot检测抑制HDAC6对HSP70及HSP27表达水平的影响。
本研究还发现,PD细胞模型的HSP70及HSP27表达水平均明显升高,而抑制HDAC6则使两者的水平有不同程度减少。由于HSP70、HSP27可以抑制α-突触核蛋白聚集导致的神经元死亡[6,7],我们推测,抑制HDAC6可能通过下调HSP的表达减少了异常蛋白质的修复和清除,从而使α-突触核蛋白异常聚集增加。
在对其他神经变性疾病中的研究中,发现HDAC6抑制剂具有双向作用,一方面可以抑制异常聚集蛋白质的降解,产生神经毒性;另一方面促进了线粒体、吞噬结构的转运及脑源性神经营养因子的释放,从而起保护作用[8,9]。HDAC6抑制剂在PD中是否也可以通过其他途径影响多巴胺能神经元尚不可知。因此,对此方面的探索将可能成为PD研究领域中的新方向。
综上所述,本研究结果显示HDAC6抑制剂使异常蛋白质聚集的PD细胞模型中HSP70和HSP27的水平明显降低、α-突触核蛋白寡聚体数量增多、细胞存活率下降。结合研究发现HDAC6在蛋白质降解受阻的PD模型中表达水平的升高[10],我们可以推测,PD模型中HDAC6水平的升高可能通过调节HSP的表达参与错误折叠蛋白结构的调整或修复,是一种细胞保护反应。因此,对HDAC6的研究将为深入研究PD的发病机制提供潜在的新靶点和新思路,具有重要意义。但上调HDAC6的水平对此PD模型是否有保护作用尚不可知,这也将成为我们进一步的研究方向。
[1]Soper JH,Kehm V,Burd CG,et al.Aggregation of α-synuclein in S.cerevisiae is associated with defects in endosomal trafficking and phospholipid biosynthesis[J].J Mol Neurosci.2011,43(3):391-405.
[2]Du G,Liu X,Chen X,et al.Drosophila histone deacetylase 6 protects dopaminergic neurons against α-synuclein toxicity by promoting inclusion formation[J].Mol Biol Cell,2010,21(13):2128-2137.
[3]Emadi S,Kasturirangan S,Wang MS,et al.Detecting morphologically distinct oligomeric forms of alpha-synuclein[J].J Biol Chem,2009,284(17):11048-11058.
[4]杨旭,杨云鹏,马英,等.pVAX1-IL4/SYN-B核酸疫苗对鱼藤酮慢性帕金森病小鼠的治疗作用[J].中国神经精神疾病杂志,2012,38(2):87-91.
[5]张国华,徐杰,吴达荣,等.利福平对鱼藤酮诱导大鼠的抗多巴胺神经元凋亡作用[J].中国神经精神疾病杂志,2012,38(1):10-13.
[6]Klucken J,Shin Y,Masliah E,et al.Hsp70 reduces alpha-synuclein aggregation and toxicity[J].J Biol Chem.2004,279(24):25497-25502.
[7]Zourlidou A,Payne Smith MD,Latchman DS.HSP27 but not HSP70 has a potent protective effect against alpha-synucleininduced cell death in mammalian neuronal cells[J].J Neurochem.2004,88(6):1439-1448.
[8]Chen S,Owens GC,Makarenkova H,et al.HDAC6 regulates mitochondrial transport in hippocampal neurons[J].PLoS One,2010,5(5):e10848.
[9]Dompierre JP,Godin JD,Charrin BC,et al.Histone deacetylase 6 inhibition compensates for the transport deficit in Huntington's disease by increasing tubulinacetylation[J].J Neurosci,2007,27(13):3571-3583.
[10]Su M,Shi JJ,Yang YP,et al.HDAC6 regulates aggresome-autophagy degradation pathway of α-synuclein in response to MPP+-induced stress[J].J Neurochem.2011,117(1):112-120.
