脑源性神经营养因子经Akt/eNOS通路在大鼠蛛网膜下腔出血后早期脑损伤中的表达☆
2013-09-14黄伟朱继熊海兵徐睿郑锋
黄伟朱继熊海兵徐睿郑锋
蛛网膜下腔出血(subarachnoid hemorrhage,SAH)后早期脑损伤(early brain injury,EBI)的转归对患者预后有明显影响,其中全脑缺血是发生EBI的重要组成部分。脑源性神经营养因子(brain derived neurotrophic factor,BDNF)是一种脑保护因子,有利于脑损伤的修复,对神经元起保护作用[1],同时还是一种新的促血管新生因子[2],其通过激活PI3K/Akte/eNOs/eNO信号通路以促进内皮细胞增殖血管[3],而此通路同时也是VEGF调控血管新生的重要信号转导通路[4,5]。目前有研究发现,BDNF在脑缺血的治疗中发挥重要作用[6]。本实验旨在检测BDNF在SAH后早期脑损伤中表达,并进一步检测eNOs与VEGF的表达,从而初步探讨BDNF可能在SAH后EBI中发挥作用的机制及通路。
1 材料与方法
1.1 研究对象 健康雄性SD大鼠72只,体质量250~300g,由重庆医科大学实验动物中心提供。大鼠随机分为假手术组(sham组)、SAH后12h、24h、48h组,每组18只。每组6只用于聚合酶链式反应,6只用于蛋白质印迹分析,6只用于测量大鼠脑含水量。前期实验已证实sham组各时间点中BDNF、VEGF和eNOs的表达无统计学差异,故均于术后48h处死。Anti-BDNF、Anti-eNOs和VEGF Receptor均购于美国Cell Signaling Technology公司,Trizol试剂盒、RT-PCR检测试剂盒购自Takara公司。
1.2 SAH模型的制备 采用改良的视交叉前池注血法建立大鼠SAH模型[6]。将动物固定于脑立体定位仪上;沿颅顶正中矢状线切开皮肤,钝性分类肌肉及骨膜,于冠状缝前5.0mm,中线旁开3.0 mm处,以电动牙科钻钻孔。显露额极,用4号针头小心将脑膜挑破,见脑脊液流出时,将PE 10导管尖端从额极紧贴前颅窝底蛛网膜下腔向双耳连线中点送入,进入深度为10 mm。连接注射器回抽,见清亮脑脊液,证实未造成脑组织损伤。从股动脉插管抽取自体动脉血250µL,经PE10导管在12 s内缓慢注入蛛网膜下腔。拔出导管,以骨蜡封闭骨孔,缝合头皮,并维持头低位30 min。对照组动物按上述方法操作,但蛛网膜下腔置管后注入等量生理盐水。
1.3 VEGF、BDNF和eNOs的mRNA的检测 按照Trizol试剂盒说明提取海马组织总RNA。紫外分光光度法测定RNA的含量,琼脂糖凝胶电泳检测其完整性。采用两部法RT-PCR试剂盒配置反应体系。VEGF、BDNF和eNOs引物均由Takara公司设计并合成。BNDF的上游引物:AGGAATACAAAAATTACCTGGATGC,下游引物:ACGATTGGGTAGTTCGGCATT,扩增片段为309bp。VEGF的上游引物:GCAATGATGAAGCCCTGGAGT,下游引物:TTCTCCGCTCTGAACAAGGCT,扩增片段为264bp。eNOs的上游引物:GGCGTCTTCAGAGCTGTACAC,下 游 引 物 :CTAAGGCGGTTGGTCACTTCATA,扩增片段为320bp。内参的上游引物:CCTGAAGTACCCCATTGAACAC,下游引物:CTCATTGCCGATAGTGATGACC,扩增片段为562bp。RT-PCR产物在5%琼脂糖凝胶上电泳,紫外灯下拍照,采用Quantity-One图像处理系统分析比较电泳条带相对光密度值。
1.4 大鼠海马组织VEGF、BDNF和eNOs的蛋白分析 取大鼠海马组织100 mg,裂解、离心、定量。提取含30µg蛋白的样品进行SDS-PACE凝胶电泳。然后转印至硝酸纤维膜,浸入封闭液中(37℃,2 h)。加入一抗并4℃冰箱孵育过夜,以即用型缓冲液(TBST)洗膜3次,每次10~15 min;加入辣根过氧化物酶标记驴抗羊IgG(二抗),摇床上37℃孵育90 min,以TBST洗膜3次,加入新鲜配制的底物反应液,轻摇至显色后,去离子水漂洗终止显色。成像后由Quantity-One软件系统计算VEGF、BDNF及eNOs与β-actin的光密度值,二者比值作为该样品VEGF、BDNF和eNOs蛋白的表达量。
1.5 大鼠脑含水量(brain water content,BWC)的测定 BWC的测定采用干湿重法[7]。不同时相点大鼠处死后迅速断头取脑,去除皮质表面的软脑膜、小脑、脑干,取双侧大脑皮层及海马,取小脑组织作为正常对照,并称取湿重(Wet Weight),然后放入110℃电热干烘箱中烘干至恒重,再称干重(Dry Weight)(两次Dry Weight之差<0.001 mg)。根据如下公式计算:BWC=(湿重一干重)/湿重×100%。
1.6 统计学分析 运用SPSS 17.0处理,多组间均数的比较采用单因素方差分析,用LSD-t检验比较两两之间的差异,变量之间采用Pearson相关分析,检验水准α=0.05。
2 结果
2.1 大鼠海马组织VEGF、BDNF和eNOs mRNA表达变化 SAH组VEGF、BDNF和eNOsmRNA的浓度在各时间点呈现动态变化,SAH后12h大鼠海马组织VEGF、BDNF和eNOsmRNA较Sham组开始明显增高(与Sham组相比,P<0.05);SAH后24h海马组织VEGF、BDNF和eNOs表达达到高峰(与Sham组相比,P<0.05);SAH后48h大鼠海马组织VEGF、BDNF和eNOsmRNA活性开始下降,但仍高于Sham组水平(P<0.05),见图1、表1。
2.2 大鼠海马组织VEGF、BDNF和eNOs蛋白表达水平变化 SAH组VEGF、BDNF和eNOs的蛋白浓度在各时间点呈现动态变化,SAH后12h大鼠海马组织VEGF、BDNF和eNOs蛋白表达较Sham组开始明显增高(P=0.031);SAH后24h海马组织VEGF、BDNF和eNOs表达达到高峰(与Sham组相比,P=0.019);SAH 后 48h大鼠海马组织VEGF、BDNF和eNOs蛋白表达活性开始下降,但仍高于Sham组水平(P=0.027),见图2、表2。
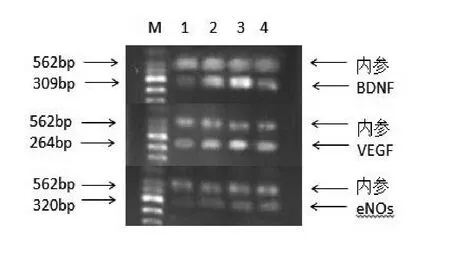
图1 RT-PCR显示Sham组及SAH后各个时间点VEGF、BDNF和eNOsmRNA的表达。

表1 大鼠海马组织VEGF、BDNF和eNOs mRNA的表达
2.3 SAH后大鼠脑损伤的变化 SAH后12h大鼠脑含水量(BWC)较Sham组开始明显增高(P<0.05);SAH后24h脑含水量达到高峰(与Sham组相比,P<0.05);SAH后48h大鼠脑含水量开始下降,但仍高于Sham组水平(P<0.05),见表2。
2.4 BDNF表达量与大鼠脑含水量的相关性 SAH后大鼠海马组织BDNF蛋白表达量与大鼠脑含水量两者间呈正相关(r=0.885,P<0.01)。

图2 Western Blot显示Sham组及SAH后各个时间点VEGF、BDNF和eNOs蛋白表达及。
2.5 BDNF、VEGF和eNOs三者蛋白表达量间的相关性 运用Pearson相关假设检验表明,在SAH发生后,BDNF和VEGF两者蛋白表达变化呈明显正相关(rBV=0.904,P<0.01)。eNOs与 BDNF及VEGF之间蛋白表达变化呈明显正相关(rNV=0.953,P<0.01;rBN=0.897,P<0.01)。
3 讨论
自发性SAH是一种破坏性疾病,具有很高死亡率,约40%的患者初次出血后在48h内死亡[8],其主要原因是颅内动脉瘤破裂出血(约80%)[9]。现在认为,早期脑损伤(EBI)[10]相比于脑血管痉挛(cerebral vasospasm,CVS)在患者预后中具有更重要的地位,它指的是从初次出血那刻起到迟发型血管痉挛发生前脑组织内发生的一系列变化[11]。在EBI中有许多机制的改变,包括颅内压(intracranial pressure,ICP)升高、脑血流量(cerebral blood flow,CBF)减少、脑灌注压(cerebral perfusion pressure,CPP)降低、血管收缩、血管腔内阻塞等等。这些都会造成全脑缺血,从而引起细胞凋亡或坏死,造成血脑屏障(blood brain barrier,BBB)破坏、脑水肿,最终导致EBI[12]。因此,对于脑缺血的治疗在SAH患者预后中具有至关重要作用。海马区神经元对缺血区有选择性敏感,所以海马成为脑损伤研究的一个典型脑区[13]。
BDNF是一种神经营养因子,其能对抗高浓度氨基酸的神经毒性,下调N—甲基一D一天冬氨酸(N-methyl-D-aspartate,NMDA)受体功能,诱导钙结合蛋白的表达而稳定细胞内Ca2+浓度,减少自由基生成,抑制细胞凋亡[14],减轻脑缺血缺氧性损害,促进损伤神经元再生等。新近研究发现BDNF还是一种新的促血管新生因子[2],能通过激活PI3K/Akt、MEK1/ERK信号通路以促进内皮细胞增殖及维持血管稳定性[3]。本实验发现,发生SAH后早期脑损伤12h后,BDNF表达量开始升高,在24h时达到高峰,并于48h后开始下降,但仍明显高于对照组,其表达变化与脑含水量变化呈正相关,提示BDNF在SAH后早期脑损伤中很可能起有重要作用。同时eNOs表达量与BDNF为正相关,说明BDNF在脑损伤中是通过Akt/eNOs通路发挥作用。据Yao RG等[15]研究发现,在发生脑缺血时,BDNF很可能是通过PI3K/Akt/eNOs通路以抑制脑细胞凋亡,因此很可能BDNF在SAH后发生全脑缺血时也同样经此通路发挥修复作用,但还需在后续实验中用阻断剂Ly294002阻断BDNF介导的Akt磷酸化过程,测量脑损伤变化以证明。

表2 大鼠海马组织VEGF、BDNF和eNOs的蛋白表达和脑含水量
VEGF是一种促血管内皮细胞生长因子[16],其在脑血管病中的作用已得到充分肯定,在SAH后大脑修复过程中起重要作用。有报道指出[17],PI3K/Akt/eNOS途径活化后,释放的eNO可上调VEGF mRNA的表达。本实验中,发现VEGF的mRNA和蛋白表达量同样在SAH后明显增高,BDNF与VEGF表达量成正相关,提示BDNF与VEGF两者在SAH后早期脑损伤中有密切关系。eNOs与VEGF表达正相关,提示当发生SAH后早期脑损伤时,BDNF很有可能即是通过活化的PI3K/Akt/eNOS/eNO途径,增加VEGF合成,促进血管生成。
本实验还发现,在早期脑损伤后,实验组BDNF表达量仍维持在较高水平,因此BDNF除了在发生SAH后早期发挥作用外,在随后迟发性脑血管痉挛过程中可能仍有重要作用,这还需要进一步研究。
[1]Almeida RD,Manadas BJ,Melo CV,et al.Neuroprotecti on by BDNF against glutamate-induced apoptotic cell death is medieted by ERK and PI3-kinase pathways[J].J Cell Death Differ,2005,12(10):1329-1343.
[2]胡豫,孙春艳,王雅丹,等.脑源性神经营养因子在多发性骨髓瘤患者血浆中的表达增高及其意义的初步探讨[J].中国实验血液学杂志,2005,13(1):104-109.
[3]王雅丹,胡豫,孙春艳,等.Akt、ERK1/2活化在脑源性神经营养因子促血管新生中的作用[J].中国病理生理杂志,2007,23(5):833-838.
[4]Suzuma K,Naruse K,Suzuma I,et al.Vascular endothelial growth factor induces expression of connective tissue growth factor via KDR,Fltl,and phosphatidy linositol 3-kinase-Akt-dependent path ways in retinal vascular cells[J].J Biol Chem,2000,275(52):40725-40731.
[5]Babaei S,Teichert-Kuliszewska K,Zhang QW,et al.Angiogenic actions of angiopoietin-1 require endothelium-derived nitric oxide[J].Am J Pathol,2003,162(6):1927-1936.
[6]Ansar S,Svendgaard NA,et al.Neurokinin-1 receptor antagonism in a rat model of subarachnoid hemorrhage:prevention of upregulation of contractile ETB and 5-HT1B receptors and cerebral blood flow reduction[J].J Neurosurg,2007,106(5):881.
[7]Xi G,Hua Y,et al.Systemic complement depletion diminishes perihematomal brain edema in rats[J].Stroke.2011,32(1):162.
[8]Zhang YH,Wang TH,et al.The role of BDNF in brain ischemia pulmonary edema[J].Medical Science Edition,2012,43(6):893-896.
[9]Friedrich V,Flores R,Muller A,et al.Reduction of neutrophil actibity decreases early microvascular injury after subarachnoid haemorrhage[J].J Neuroinflammation,2011,19(8):103-104.
[10]Tariq A,Ai J,Chen G,et al.Loss of long-term potentiation in the hippocampus after experimental subarachnoid hemorrhage in rats[J].Neuroscience,2010,165(2):418-426.
[11]Wang Z,Shi XY,Yin J,et al.Role of autophagy in early brain injury after experimental subarachnoid hemorrhage[J].J Mol Neurosci,2011,28(6):252-256.
[12]张磊,黄清海,刘建民.动脉瘤破裂自发性蛛网膜下腔出血厚的早期脑损伤[J].中华脑血管病杂志,2009,10(8):248-253.
[13]Leeds P,Leng Y,Chalecka-franaszek E,et al.Neurotrophins protect against cytosine arabinoside-induced apoptosis of immature rat cerebellar neurons[J].J Neurochem Int,2005,46(1):61-72.
[14]Almeida RD,Manadas BJ,Melo CV,et al.Neuroprotecti on by BDNF against glutamate-induced apoptotic cell death is medieted by ERK and PI3-kinase pathways[J].J Cell Death Differ,2005,12(10):1329-1343.
[15]Yao RQ,Qi DS,Yu HL,et al.Quercetin attenuates cell apoptosis in focal cerebral ischemia rat brain via activation of BDNFTrkB-PI3K/Akt signaling pathway[J].Neurochem Res,2012,37(12):2777-2786.
[16]徐睿,朱继,万伟峰,等.VEGF单核苷酸多态性与自发性蛛网膜下腔出血后脑血管痉挛发生的相关性研究[J].中国神经精神疾病杂志,2011,37(1):37-41.
[17]Dulak J,Jozkowicz A,Dembinska-Kiec A,et al.Niteicoxide induces the synthesis of vascular endothelial growth factor by rat vascular smooth muscle cells[J].Arterioscler Thromb Vasc Biol,2000,20(3):659-666.
