双侧丘脑底核脑深部电刺激治疗中晚期帕金森病疗效(术后2年随访)☆
2013-09-14钱浩刘金龙符小丽冼文彪柯春龙刘妍梅陈杰郑一帆叶小帆陈曦陈玲裴中黎锦如刘焯霖
钱浩刘金龙符小丽冼文彪柯春龙刘妍梅陈杰郑一帆叶小帆陈曦陈玲 裴中黎锦如刘焯霖
脑深部电刺激术(deep brain stimulation,DBS)被广泛应用于帕金森病(Parkinson's disease,PD)等锥体外系疾病的治疗,丘脑底核(subthalamic nucleus,STN)DBS由于其效果确切,能改善几乎所有的主要帕金森病症状及手术副作用少[1,2]等优势使STN成为治疗中晚期PD的常用靶点。本研究通过对在中山大学附属第一医院接受双侧STN DBS治疗的中晚期PD患者进行2年随访,评价双侧STN-DBS术对PD运动症状及非运动症状的疗效,现报告如下。
1 资料与方法
1.1 临床资料33例PD患者于2006年8月至2011年10月在中山大学附属第一医院行双侧STN DBS术,其中16例随访至术后2年,本研究主要对这16例患者的随访资料进行总结分析。手术纳入标准及排除标准参见本课题组已发表的文章[3-5]及专家共识[6]。此项目通过了我院伦理委员会,并征得患者及家人的书面同意。
1.2 研究方法手术流程、手术方法及疗效评估等见已发表文章[3-4]。由神经科PD专科门诊筛选适合手术的患者,收入院先在神经内科进行严格的术前评估,符合纳入标准的患者再转入神经外科进行DBS手术;术中由神经内、外科及影像科共同定位。神经内科负责术后1个月的开机(初始程控)、此后的跟踪随访、DBS的参数调节及抗PD药的调整;康复科负责术后运动功能的康复指导。主要随访量表包括统一帕金森病评定量表(UPDRS)、Hoehn&Yahr(H&Y)分级、帕金森病生活质量问卷(PDQ-39)、Schwab&England日常生活活动量表、汉密顿抑郁量表(HAMD)、汉密顿焦虑量表(HAMA)、简易精神状态检查量表(MMSE)、蒙特利尔认知评估量表(MOCA)及帕金森病睡眠评估量表中文版(PDSS-CV),每次随访均于上午进行,先在开机未服药状态下(停药至少12h以上),后在开机服药状态下(药效较好时)分别评定,再与术前未服药及术前服药状态的运动评分做比较。
1.3 统计学分析采用SPSS 13.0进行统计处理,采用自身配对设计,进行描述性分析,各指标用x±s表示,STN DBS手术前后各随访指标的变化以改善率用百分数的形式表示,改善率(%)=(术后分值-术前分值)的绝对值×100%/术前分值,采用配对t检验或Wilcoxon秩和检验,相关性采用Pearson相关分析。检测水准α=0.05。
2 结果
2.1 一般情况16名患者中,男10例,女6例;年龄42~72岁,平均(59.5±8.5)岁;病程5~14年,平均(8.9±2.9)年;H&Y分级为2~4级。患者均有双侧肢体症状及剂末现象,13例有异动症,无开关现象,3例曾在外院行一侧苍白球毁损术。术前左旋多巴冲击试验改善率44.0%~82.2%,平均67.03%±11.96%。
2.2 UPDRSⅢ总分及各亚项评分患者症状在术后2年均有明显改善,与术前未服药状态相比,术后2年的UPDRSⅢ总分及震颤(20~21项)、强直(22项)、运动迟缓(23~26项)、中轴症状(27~30项)各亚项评分在开机未服药及开机服药状态下均明显下降,差异有统计学意义(P<0.05)。其中开机未服药状态下以强直改善率最高(55.1%),中轴症状改善率最低(28.1%);开机服药状态下震颤改善率最高(81.8%),中轴症状改善率最低(57.8%),见表1。与术前服药状态相比,术后2年开机未服药及开机服药状态下UPDRSⅢ总分及各亚项评分改善差异均无统计学意义(表1)。
2.3 运动并发症 16例患者术后2年觉醒状态下“关”期时间由术前的(6.3±0.8)h/d减少至(2.8±0.6)h/d(P=0.008)。UPDRS IV-39项(“关”平均所占觉醒状态时间的比例)术后得分也显著降低(P=0.003)。UPDRS IV-32项(异动症持续时间)术前、术后得分差异无统计学意义(表2),但患者异动的程度减轻。
2.4 H&Y分级术后2年开机未服药状态下H&Y分级为2.7±0.5、开机服药状态下为2.2±0.4,与术前未服药状态(3.0±0.6)相比差异均有统计学意义(P<0.01)。与术前服药状态(2.3±0.5)相比差异均无统计学意义。
2.5 PDQ-39及Schwab&England日常活动分级评分 术后的PDQ-39总分(P<0.01)及运动(P<0.01)、日常生活活动(P<0.01)、情绪(P<0.01)、沟通(P<0.05)各亚项得分较术前显著改善,总分改善率为49.4%。同样Schwab&England日常活动分级评分术前未服药状态60%,术后开机未服药状态70%,且差异有统计学意义(P=0.01)(表3)。术前服药状态90%,术后开机服药状态95%,差异无统计学意义(P>0.05)。
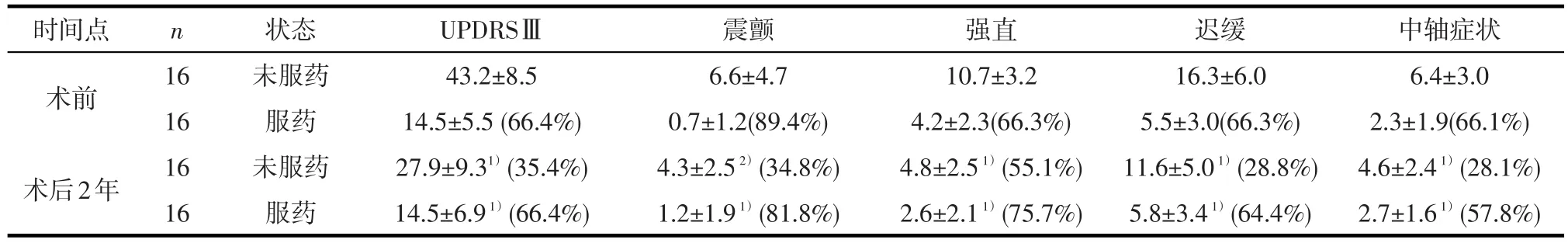
表1 16例PD患者术前与术后2年(开机)UPDRSⅢ运动总分及各亚项评分比较(x±s)

表2 16例PD患者术前及术后2年运动并发症持续时间及评分
2.6 非运动症状各相关量表评分情绪方面,患者术后2年HAMD(P>0.05)、HAMA(P>0.05)评分较术前有所减低;认知功能方面,MMSE(P>0.05)、MOCA(P>0.05)评分有所增高;PDSS-CV[7](P>0.05)评分较术前稍增高,PSQI(P>0.05)无明显变化,但这几项评分手术前后均无统计学差异,见表3。
2.7 术后程控参数调整16例患者均为双侧、单极刺激,使用的参数范围:脉宽(73±15)μs(60~90μs),60μs较多;频率(146±19)Hz(130~185 Hz),以130 Hz较多。所有患者术后经过多次电压调整,开机后前半年平均调整(3~7)次,后半年(0~3)次,术后第2年平均调整(0~3)次。电压随时间而增加,开机时平均电压为(1.6±0.2)V,术后2年平均电压(2.3±0.3)V,P=0.0008。
2.8 药量16例患者术后2年药量较术前均有明显减少,日左旋多巴等效剂量(Daily Levodopa Equivalent Dose,LEDD)由术前的平均(756.5±255.2)mg减少至术后2年的(420.8±300.1)mg(P<0.001),减少了44.4%。
2.9 手术副反应 患者术后早期均有不同程度的症状改善,持续时间约至术后1周~2周,称“微毁损效应”。2例术后早期出现不同程度的视、听幻觉,3 d后自行缓解。术后5d针道少量出血1例,术后1周囊袋积液1例,经短期保守治疗后好转出院。2例患者术后6个月~1年体质量增加(5~10kg)。2例开机后原有异动加重,通过参数及药物剂量调整后于术后3~6个月逐渐消失或缓解。无颅内血肿、头皮感染、电极位置不当、脑脊液漏等并发症,无与装置有关的并发症。
3 讨论
3.1 STN DBS可改善PD的运动症状 STN DBS对PD的运动症状改善肯定,一个纳入37项研究(927例患者)的meta分析[8]结果显示术后“开机+未服药”状态下UPDRSⅢ评分较术前“未服药”状态改善了52%,我们前期的临床研究6个月[3]及1年[4]还有meta分析[9]结果均显示STN DBS对震颤、强直、运动迟缓及中轴症状都有改善。与术前未服药状态相比,术后2年单纯开机未服药的上述各项评分仍有所改善(震颤34.8%、强直55.1%、迟缓28.8%、中轴症状28.1%),说明单纯DBS可显著改善帕金森病患者的震颤、强直、迟缓及中轴症状,而且这种作用是持续的。术后开机服药状态较术前未服药状态的改善率(震颤81.8%、强直75.7%、迟缓64.4%、中轴症状57.8%)明显高于术后开机未服药状态,说明DBS与药物联合作用较单纯DBS效果更佳,术后仍需要使用抗帕金森病药物才能达到最佳的效果。而同在服药状态下,术前术后的差别不明显,即术后开机联合药物治疗较术前单纯药物治疗并无统计学差异,也就是STN DBS仅在术前未服抗PD药物的状态下有优势,这就是DBS持续作用的结果,是口服脉冲式给药不能比拟的。与术前服药状态相比,术后2年开机未服药状态下UPDRSⅢ总分及各亚项评分改善差异均无统计学意义,说明STN DBS持续刺激可达到与药物作用同样的效果,但相对于单纯药物作用而言,STN DBS减少了症状波动。STN DBS术后本组患者中轴症状的改善率相对低,提示STN DBS对中轴症状疗效不佳。更有5年长期随访研究表明中轴症状的评分较术前更差[10],可能与病情逐渐进展有关。本组患者中暂未发现中轴症状的评分明显变差的情况,可能与我们术前已排除中轴症状明显的患者及随访时间不够长有关。

表3 16例PD患者术前及术后2年生活质量及各非运动症状评分比较
3.2 STN DBS可改善PD患者的生活质量DBS能有效提高患者日常生活能力[11]。术后2年PDQ-39总分(P=0.0007)和Schwab&England(P=0.01)日常生活活动量表评分与术前相比均有显著改善,其中PDQ-39的运动(P=0.001)、日常生活活动(P=0.0034)、情绪(P=0.001)、沟通(P=0.0028)各因子分有显著改善,这与一项关于认知、情绪、社会状态较PD的躯体症状感受更影响整体生活质量的研究[12]具有一致性;另外,也有研究发现有运动并发症的PD患者常常有较高的PDQ-39得分,运动、日常生活活动、羞耻感、沟通方面会更差[13]。STN-DBS也可能是通过减少运动并发症从而改善患者的生活质量,但本组数据尚未发现PDQ-39得分的改善与运动并发症、运动症状或精神情绪相关评分的改善间存在相关性。
3.3 STN DBS对PD患者非运动症状的影响 PD患者的非运动症状包括了消化系统、泌尿系统、心血管系统、记忆、精神情绪、睡眠等多方面的症状,其中多汗、便秘、流涎、夜尿、睡眠障碍是PD患者最常见的非运动症状[14]。在认知功能上,有研究认为长期的DBS治疗可能引起认知功能异常[15]。但也有长达5年的随访研究未发现患者有认知功能的改变[9]。这可能与每个中心纳入患者的标准不同,所采用认知评定量表不同以及PD自身病情进展有关。在精神情绪方面,有研究发现DBS对焦虑、抑郁有改善作用[16],也有研究认为DBS会影响边缘通路从而引发或加重患者的情绪问题,出现抑郁甚至自杀倾向[17]。本组数据情绪相关量表评分与术前相比术后有所改善,但差异无统计学意义,而PDQ-39的情绪状态因子分术后有改善(P<0.05)。这一方面可能与样本量较小有关,另一方面也可能与术前严格筛选病例有关。更有最近的一项研究发现术前有抑郁病史的PD患者DBS术后运动症状的改善较无抑郁病史的患者差,所以术前排除严重焦虑、抑郁对手术疗效的保证仍是十分必要的[18]。在睡眠方面,睡眠障碍是PD患者最常见非运动症状之一,严重影响患者日常生活质量。有研究认为STN-DBS可改善PD患者的睡眠障碍[19],部分研究利用PSG发现DBS治疗可使PD患者总的睡眠时间增加,睡后觉醒次数减少,推测可能与DBS治疗后抗PD药物减少、运动功能及精神情绪的改善有关,也可能是电极刺激直接影响PPN等与睡眠觉醒相关核团的兴奋性有关[20]。但本组研究STN-DBS术后睡眠相关量表的评定却没有改变,其影响有待进一步的随访研究。本组数据在各个量表上术后2年较术前虽有所改善,但均无统计学意义,这可能一方面与我们术前就已经排除了存在严重焦虑、抑郁及认知障碍的PD患者有关,另一方面可能与样本量较小有关。
3.4 DBS可减少抗PD药物的剂量本研究显示STN DBS能显著减少抗PD药物的使用,术后2年的每日左旋多巴等效剂量(LEDD)减少44.4%,这个数值与其他类似报道接近,DBS术后患者多可减少药量达1/2-2/3[21]。DBS手术减少药量的机制尚不明确,可能是由于DBS改善PD的运动症状,那么抗PD的药物需要量相应降低。通常情况下,随着PD患者自然病程增长,病情加重,药量会逐渐增加,因此DBS联合药物治疗较单纯药物治疗的优势明显,而且UPDRSIII的改善率与抗PD用药的减少存在明显的正相关关系。同时,为进一步减少运动并发症,STN DBS术后患者多倾向于使用半衰期长的抗帕金森药物。本研究提示术后患者较多使用多巴控释剂型及多巴胺受体激动剂。
3.5 DBS参数可调控、安全性高本组患者在术后开机至术后2年期间,前半年要求参数调整的次数明显高于以后的时间。开机早期患者对刺激未适应,需要较多次的调整,随着时间延长,调整次数明显减少。电压在术后随时间延长有所增加,可能与病情逐渐加重有关。本组患者开机电压平均为(1.6±0.2)V,术后2年电压平均(2.3±0.3)V,均低于国内外同类报道[22]。一方面可能与亚洲患者体型较小有关,另一方面可能与手术靶点选择准确有关,STN核内的刺激往往较核外刺激所需电压低,且对运动功能改善更好[23]。较低的电压能有效延长电池寿命,对于减轻患者经济负担有重要意义。另外,UPDRSIII的改善率与电压的增加存在明显的正相关关系,提示STN DBS的电刺激对于改善运动症状的重要作用。
本组患者中未出现不可逆的神经功能缺损。手术所致经针道少量出血1例和囊袋积液1例经保守治疗后均好转;未发现对认知有负性作用;未发现焦虑抑郁或焦虑抑郁加重。术后刺激所致的异动症加重者经药物、参数调整也逐渐减轻或消失;2例患者术后半年~1年出现体质量增加(5~10)Kg,DBS术后体质量增加的机制可能与术后震颤、强直或异动的减少从而减少能量消耗有关,或是STN DBS刺激外侧下丘脑影响了患者基础代谢率[24]。未见装置所导致的副作用。
双侧STN DBS作为中晚期帕金森病患者的一种外科治疗手段,术后两年随访显示,对运动症状的疗效肯定,能有效减少药物用量,提高患者日常生活能力,对非运动症状如情绪、认知、睡眠等也有所改善,双侧STN-DBS手术安全性高,具有可调控的优势,术前严格筛选手术适应证者,排除有严重焦虑、抑郁、认知障碍的患者,有助于减少术后并发症、提高手术成功率。
致谢 衷心感谢上海交通大学医学院附属瑞金医院神经内科陈生弟教授及王刚博士为本研究无偿提供中文版帕金森病睡眠评估量表(PDSSCV)。
[1]Bronstein JM,Tagliati M,Alterman RL,et al.Deep brain stimulation for Parkinson disease:an expert consensus and review of key issues[J].Arch Neurol,2011,68(2):165-165.
[2]Guridi J,Rodríguez-Oroz MC,Clavero P,et al.Critical review of the subthalamic stimulation in Parkinson's disease[J].Neurocirugia,2009,20(6):521-32.
[3]钱浩,陈玲,刘金龙,等.双侧丘脑底核脑深部电刺激术可改善中晚期帕金森病患者的症状[J].中国神经精神疾病杂志,2009,35(4):203-207
[4]陈杰,刘金龙,陈曦,等.双侧丘脑底核脑深部电刺激治疗中晚期帕金森病的疗效的研究[J].中华医学杂志(中文版),2011,91(5):291-295
[5]张振馨.帕金森病的诊断[J].中华神经科杂志,2006,39(6):408-409
[6]中国帕金森病脑深部电刺激疗法专家组.中国帕金森病脑深部电刺激疗法专家共识[J].中华神经科杂志,2012,45(7):1-3
[7]Gang Wang,Qi Cheng,Jie Zeng,et al.Sleep disorders in Chinese patients with Parkinson's disease:validation study of a Chinese version of Parkinson's disease sleep scale[J].Neurol Sci,2008,271(1-2):153-157.
[8]Kleiner-Fisman G,Herzog J,Fisman DN,et al.Subthalamic nucleus deep brain stimulation:Summary and meta-analysis of outcomes[J].Movement Disorders.2006,21(S14):S290-304.
[9]冼文彪,裴中,周旭毓,等.双侧丘脑底核脑深部电刺激术治疗帕金森病有效性和安全性的meta分析[J].中国神经精神疾病杂志,2009,35(4):289-294.
[10]Fasano A,Romito LM,Daniele A,et al.Motor and cognitive outcome in patients with Parkinson's disease 8 years after subthalamic implants[J].Brain,2010.133(9):2664-2676.
[11]Volkmann J,Albanese A,Kulisevsky J,et al.Long-Term Effects of Pallidal or Subthalamic Deep Brain Stimulation on Quality of Life in Parkinson’s Disease[J].Mov Disord,2009,24(8):1154-1161.
[12]Lee MA,Walker RW,Hildreth AJ,et al.Individualized assessment of quality of life in idiopathic Parkinson's disease[J].Mov Disord,2006,21(11):1929-1934.
[13]Chapuis S,Ouchchane L,Metz O,et al.Impact of the motor complications of Parkinson's disease on the quality of life[J].Movement Disorders,2005,20(2):224-230.
[14]Martinez-Martin P,Schapira AHV,Stocchi F,et al.Prevalence of nonmotor symptoms in Parkinson's disease in an international setting;study using nonmotor symptoms questionnaire in 545 patients[J].Movement Disorders,2007,22(11):1623-1629.
[15]Aybek S,Gronchi-Perrin A,Berney A,et al.Long-term cognitive profile and incidence of dementia after STN-DBS in Parkinson's disease[J].Mov Disord,2007,22(7):974-981.
[16]Witt K,Daniels C,Reiff J,et al.Neuropsychological and psychiatric changes after deep brain stimulation for Parkinson's disease:a randomised,multicentre study[J].The Lancet Neurology,2008,7(7):605-614.
[17]Soulas T,Gurruchaga JM,Palfi S,et al.Attempted and completed suicides after subthalamic nucleus stimulation for Parkinson's disease[J].Neurol Neurosurg Psychiatry,2008,79(8):952-954.
[18]Okun MS,Wu SS,Foote KD,et al.Do Stable Patients with a Pre-Morbid Depression History Have a Worse Outcome Following DBS for Parkinson's Disease[J].Neurosurgery,2011,69(2):357-360.
[19]Amara AW,Watts RL,Walker HC.The effects of deep brain stimulation on sleep in Parkinson's disease[J].Therapeutic Advances in Neurological Disorders,2011.4(1):15-24.
[20]Lim AS,Moro E,Lozano AM,et al.Selective enhancement of rapid eye movement sleep by deep brain stimulation of the human pons[J].Annals of neurology,2009,66(1):110-114.
[21]相媛媛,张杨,吴林,等.帕金森病脑深部电刺激治疗的程控体会[J].中国神经精神疾病杂志,2009,35(4):216-219
[22]Hamani,C,Richter E,Schwalb JM,et al.Bilateral subthalamic nucleus stimulation for Parkinson's disease:a systematic review of the clinical literature[J].Neurosurgery,2005,56(6):1313-1321.
[23]Tripoliti E,Zrinzo L,Martinez-Torres I,et al.Effects of contact location and voltage amplitude on speech and movement in bilateral subthalamic nucleus deep brain stimulation[J].Movement Disorders,2008,23(16):2377-2383.
[24]Montaurier C,Morio B,Bannier S,et al.Mechanisms of body weight gain in patients with Parkinson's disease after subthalamic stimulation[J].Brain,2007,130(7):1808-1818.
