新生大鼠大脑皮层神经元的原代培养
2013-06-28翁启芳
翁启芳
(海南医学院生理学教研室,海南 海口 571199)
新生大鼠大脑皮层神经元的原代培养
翁启芳
(海南医学院生理学教研室,海南 海口 571199)
目的 成功建立简便易行的原代神经元培养模型的方法。方法 无菌操作条件下,培养皿或培养板经L-多聚赖氨酸包被过夜,用15%完全培养液混悬神经元,以细胞密度为5×104细胞/mL的浓度种植,24h后倒置相差显微镜观察神经元贴壁后即用阿糖胞苷(10μmol/L)以抑制神经胶质细胞及非神经细胞的增殖,每48h进行每皿或每孔半量换液。结果 神经元贴壁生长较多,神经胶质或成纤维细胞被抑制,在半量换液中可清除,获得相对单纯的神经元。结论 简便易行的原代皮层神经元培养方法,可以得到相对单纯体外培养的神经元模型。
皮层神经元;原代培养;细胞模型
从新生动物或动物胚胎(如大鼠或小鼠)的脑组织取出局部区域的脑细胞,制成单细胞种植在培养容器后不再移植的过程,常称为原代神经元培养[1]。新生动物皮层神经元是一种高度分化的细胞[2],且神经元体外离散分离培养所需要的营养条件相比较其他组织细胞培养较为困难。原代皮层神经元培养模型的成功建立,是近代神经科学研究中最重要的基础方法之一。本文主要介绍简便易行的新生大鼠皮层神经元原代培养的流程。
1 实验用品的配置
1.1 基本的器械设备
无菌操作室、操作净化台、CO2培养箱、倒置相差显微镜、冰箱、水纯化系统、高压消毒锅;外科剪、细镊子、移液管、吸管、烧杯、离心管、培养皿、培养板。
1.2 主要的培养基质
有常用分子量为140,000的0.1mg/mL L-多聚赖氨酸、D - Hank’s 液,高糖培养液(干粉DMEM配置),10%胎牛血清或马血清[3]、0.125%胰蛋白酶溶液。
2 神经元培养
2.1 培养板准备
一般在细胞培养前1d,将使用的培养皿(35mm)或培养板涂上一层(浓度0.1mg/mL)L-多聚赖氨酸过夜,置于超净台中备用。
2.2 取材
根据实验目的选取新生大鼠(1~3d)的大脑组织。
2.3 培养步骤
①胰酶消化:新生的Wistar大鼠无菌断头取出全部大脑皮层组织,在4℃的D-Hank’s液(pH7.0)中用外科剪剪碎皮层组织制成细胞悬液;0.125%胰蛋白酶37℃水浴箱预热5min,然后加入无菌玻璃试管收集的细胞悬液内消化5min,并以15%完全培养液(胎牛血清15mL+DMEM培养液配置85mL)终止胰酶消化。②细胞计数:细胞悬液预先经100~200目尼龙网过滤后收集至50mL离心管中以1000g× 6min离心,弃去离心后的上清液,用15%完全培养液混悬离心后沉淀的细胞并进行细胞计数测定。③接种:以细胞密度为5×104细胞/mL的浓度,接种种植于预先用L-多聚赖氨酸包被过的培养皿或培养板,并置于37℃下5%CO2的培养箱中孵育。④获取单纯神经元:放置培养箱中的培养皿或培养板中的神经元经过24h后即可稳定的贴壁生长,24h后在每孔板内加入阿糖胞苷(10μmol/L)可以及时抑制神经胶质细胞的快速生长,从而获得相对单纯的原代皮层神经元(图1)。
3 神经元识别
通过显微镜下观察细胞外形进行细胞的识别[4]。培养器中的神经元以贴壁方式进行生长,无悬浮感,细胞体呈圆形或梭形,有明显的核仁,突起明显,立体感强,常见细胞膜外有光“晕”(图2)。培养细胞中成纤维细胞或胶质细胞,如“地毯”似贴壁(图3,红色箭头),神经元贴壁较慢,落在“地毯”上生长迁移和分化。所以在种植24h后观察培养的神经元存活较多后即可加入阿糖胞苷以抑制神经胶质细胞的快速生长,从而获得较单纯的神经元。神经元的体外培养时间不宜过长,如用15%胎牛血清+85%DMEM培养液种植的神经元生长最适宜时间在10d内。若种植神经元密度过多(图4),也将导致神经元分解代谢的物质会影响正常神经元的生长并加速神经元的死亡,如神经元突起缩回呈椭圆悬浮状或细胞胞浆裂解匀质小块状(图5)。
4 小 结
1956年Nakai首创了神经组织的分离细胞培养方法[5]。神经元的体外培养模型于现代医学和神经科学中已被广泛应用,例如脑缺氧和缺血损伤、阿尔之海默病及兴奋性神经毒等多种神经系统疾病的研究。成功建立体外原代皮层神经元培养的模型,可进一步作为药物作用神经元靶点及药物结合特异性受体功能作用的研究,是探讨多种神经元损伤致病机理及治疗手段最好的研究方法之一。
[1] 张卓然.培养细胞学与细胞培养技术[M].上海:上海科学技术出版社,2004:467-468.

图1 种植神经元24h (10×40)
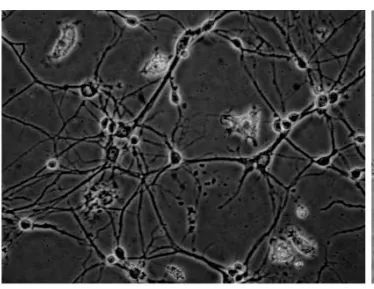
图2 种植神经元第8d (10×40)
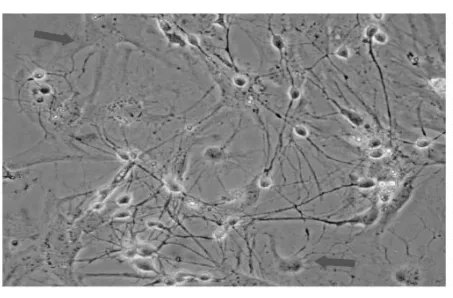
图3 种植神经元第8d (10×40)

图4 种植神经元第8d (密度过多,10×40)
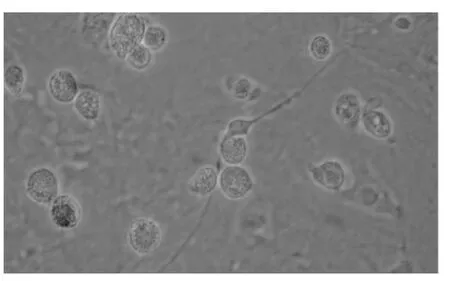
图5 种植神经元>10d (10×40)
[2] 《中国组织工程研究与临床康复》杂志社学术部.组织工程研究中神经细胞的培养[J].中国组织工程研究与临床康复,2011, 15(50):9466-9467.
[3] 于丽华,赵书平,席先成,等.不同种类血清对新生大鼠大脑皮层神经细胞培养的影响[J].实用医药杂志,2002,19(3):53-56.
[4] 李玉,但齐琴,习杨彦彬.成年小鼠海马神经细胞培养及其鉴定[J].昆明医学院学报,2011,32(6):29-32.
[5] 于样,金英.神经细胞培养方法在缺血性脑损伤研究中的应用[J].锦州医学院学报,2003,24(1):53-56.
R-33
B
1671-8194(2013)20-0087-02
