NNK和B[a]P在卷烟烟气复杂基质中的联合遗传毒性
2013-03-14木潆朱茂祥潘秀颉杨陟华齐绍武
木潆,朱茂祥,潘秀颉,杨陟华,齐绍武
1 湖南农业大学 烟草工程技术研究中心,长沙410128;2 军事医学科学院 放射与辐射医学研究所,北京 100850
近年来,卷烟安全性问题受到日益显著的重视。卷烟烟气是由数千种化合物组成的一种混合物[1]。卷烟烟气具细胞毒性、遗传毒性及诱变性,这些化合物之间的相互作用会影响单一物质对卷烟烟气毒性的贡献。谢剑平等[2]研究发现:在卷烟烟气众多有害成分中,对卷烟主流烟气危害性影响最大的7项有害成分指标为∶ CO、HCN、NH3、甲基亚硝胺吡啶基丁酮(NNK)、苯并[a]芘(B[a]P)、苯酚、巴豆醛。当前常规卷烟安全性评价的方法最常用的是对焦油、一氧化碳和烟气烟碱三项指标的评价[3],很少涉及到卷烟烟气有害物之间的相互作用关系、烟气吸入后对人体的毒性作用及其作用机制等问题的研究, 这显然是不全面的。相关研究表明[4-9],卷烟烟气和烟气冷凝物均可以导致细胞微核的出现。卷烟烟气冷凝物可以导致培养的哺乳动物细胞出现染色体畸变[10-14]。微核试验作为推断化合物染色体损伤的遗传毒性检测方法,具有快速、简便、经济等特点,在环境化合物快速筛选和大量职业暴露人群检测方面得到广泛应用。微核检测的敏感性、特异性和准确性优于其它染色体畸变分析,因此许多国家和国际组织将其规定为新药、食品添加剂、农药、化妆品等毒理学安全性评价的必做实验[15]。微核检测方法主要集中于镜检法(常规微核试验、胞质分裂阻滞法、荧光原位杂交试验与DNA 探针、抗着丝粒抗体染色)和自动化法(图像分析系统检测和流式细胞仪检测)[16]。
B[a]P、NNK为两种卷烟烟气重要代表有害物,具一定的致癌性[17-18],已成为近年来有关烟草致癌研究的热点,卷烟主流烟气化学成分中B[a]P、NNK的含量情况如下表1所示[2]。笔者以肯塔基参比卷烟3R4F为研究对象,以B[a]P、NNK为目标化合物,采用广泛应用于细胞诱变性试验的镜检微核法[19],结合三者对人体支气管上皮细胞的毒性作用,分析B[a]P、NNK在卷烟烟气复杂基质中的联合作用,以期为卷烟烟气的安全性评价提供参考。
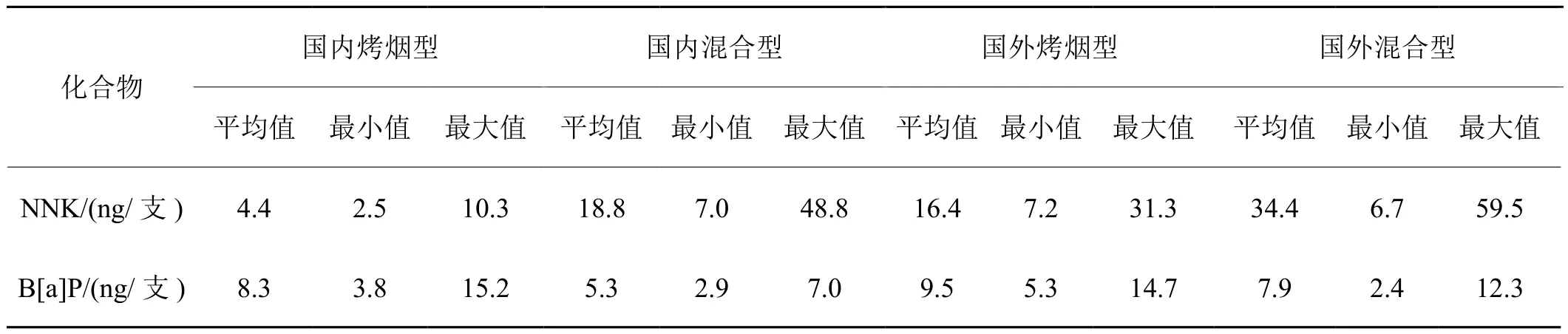
表1 163种不同类型卷烟样品中NNK和B[a]P成分比较[2]
1 材料与方法
1.1 材料
肯塔基参比卷烟3R4F(美国肯塔基大学);LHC-8培养液( Biofluids Inc公司);胰蛋白酶、B[a]P (纯度≥96%,Sigma公司);NNK (纯度≥99.0%,Alfar Aesar公司);细胞松弛素B(Applichem公司);DAPI(罗氏试剂);甲醇溶液;洁净工作台(北京冠鹏净化设备有限公司);TS100倒置显微镜(Nikon公司 );BB15型 CO2孵 箱 (Thermo公 司 );Milli-Q50超纯水仪(Millipore公司);JJ100型单通道吸烟机(中国烟草总公司郑州烟草研究院)。
1.2 细胞培养
腺病毒-12/SV40病毒永生化的人支气管上皮细胞(BEAS-2B),用无血清的LHC-8培养基,在37℃、5% CO2和95%湿度条件下培养箱中培养[19]。
1.3 卷烟烟气凝聚物(CSC)的制备
设定抽烟机抽吸周期为 60 s、抽吸长度为 2 s,抽吸容量为 30 mL。连接密封的两个玻璃气体采样收集器,第一个收集器内装有 5.0 mL 95%的乙醇,另一个收集器内装有 5.0 mL 双蒸水,用打火机点燃卷烟样品,将燃烧产生的烟气通过橡皮导管通入气体收集管,依照早已设定的抽吸速率,连续不停地收集10 支卷烟抽吸产生的烟气于收集器内。等最后一支抽吸完后,将两个收集器中的液体充分混匀,定容至10.0 mL 容量瓶中摇匀,分装在 0.5 mL EP管中用封口膜封口,后放入液氮罐中储藏备用。卷烟烟气冷凝物CSC的浓度为10mg/mL[20]。
1.4 实验方法
1.4.1 微核试验方法
笔者先采用细胞毒性测试检测出三种受试物的IC50[20]。收集处于指数生长期的BEAS-2B细胞,制成细胞悬液(1.4×105个/mL),接种于35×10mm小皿(2mL/皿),在相对湿度95%、5%CO2、37℃下培养24 h后按剂量染毒,设置空白对照组、处理组(1/10 IC50、1/5 IC50、IC50三个浓度)、阳性对照组,每组设三个平行试验。取一定体积的细胞培养液(内含2.8×105个细胞),于离心涂片机(500rpm,5min,低加速度)进行涂片,将上述玻片浸入100%甲醇(10min),于黑暗环境中放置直至染色,固定后的玻片浸入DAPI液(10min),然后于400X荧光显微镜下进行微核计数。每一组培养液分析2000个单核细胞(非凋亡或死亡)的细胞微核数,每组培养液重复两次(等于4000个细胞)计算微核率。(微核观察需注意一下条件:微核为近圆形,同细胞主核染色近乎相同,Size≤1/3细胞主核,微核与主核接触但并不与之重叠)[21]。
1.4.2 联合作用细胞毒性的测定与分析
采用线性回归分析CSC、B[a]P、NNK三者之间的联合作用。即计算出三种受试物(三个剂量)分别诱发细胞微核率后,选择各个受试物低剂量(1/10IC50),再与另外两种受试物混合后作用BEAS-2B细胞。根据联合染毒诱发的细胞微核率,计算出CSC、B[a]P、NNK两两作用和三者联合作用的预期值[22],并与实际值相比较。实际值小于预期值,表明受试物之间为协同作用;实际值大于预期值,表明受试物之间为拮抗作用;实际值与预期值接近,表明受试物之间无明显协同作用。
2 结果与分析
2.1 单独作用遗传毒性试验结果
由表2可知, CSC、NNK和B[a]P均可诱发细胞微核率增高,并有较好的剂量效应关系。相同细胞存活剂量条件下,诱发细胞微核形成能力比较:B[a]P>NNK>CSC。
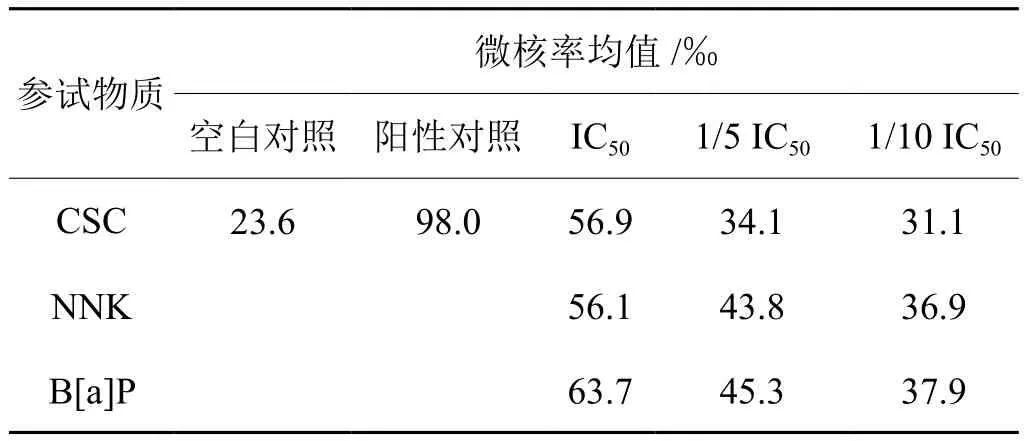
表2 CSC、NNK、B[a]P单独作用诱发BEAS-2B细胞微核率
2.2 联合作用遗传毒性
2.2.1 B[a]P与CSC联合作用诱发细胞微核率
由图1可知,固定低剂量B[a]P(1/10 IC50)与不同浓度CSC联合作用,固定低剂量CSC(1/10 IC50)与不同浓度B[a]P联合作用,随着剂量的增加,细胞微核率均呈现上升趋势,表现剂量依赖趋势。诱发细胞微核率均显著低于预期值,并与作用的先后顺序无关,特别是在较低剂量是与单纯作用结果相当,提示两者联合作用诱发细胞微核存在一定的拮抗效应。诱发细胞微核能力比较∶ B[a]P+CSC > CSC+ B[a]P。
2.2.2 CSC与NNK联合作用诱发细胞微核率
由图2可知,固定低剂量CSC(1/10 IC50)与不同浓度NNK联合作用,固定低剂量NNK(1/10IC50)与不同浓度CSC联合作用,随着剂量的增加,细胞微核率均呈现上升趋势,表现剂量依赖趋势。诱发细胞微核率明显低于预期值,并与作用的先后顺序无关,特别是在较低剂量是与单纯作用结果相当,提示两者联合作用诱发细胞微核存在一定的拮抗效应。诱发细胞微核能力比较∶NNK+CSC > CSC+NNK。

图1 B[a]P与CSC联合作用对BEAS-2B细胞微核率的影响

图2 CSC与NNK联合作用对BEAS-2B细胞微核率的影响
2.2.3 B[a]P与NNK联合作用诱发细胞微核率
由图3可知,固定低剂量B[a]P(1/10 IC50)与不同浓度NNK联合作用,固定低剂量NNK(1/10 IC50)与不同浓度B[a]P联合作用,随着剂量的增加,细胞微核率均呈现上升趋势,表现剂量依赖趋势。诱发细胞微核率显著低于预期值,特别是在较低剂量是与单纯作用结果相当,提示两者联合作用诱发细胞微核存在一定的拮抗效应。诱发细胞微核能力比较∶NNK+B[a]P > B[a]P+ NNK。
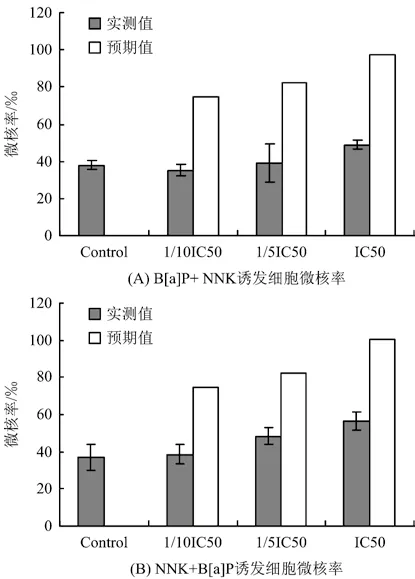
图3 B[a]P与NNK联合作用对BEAS-2B细胞微核率的影响
2.2.4 CSC、B[a]P与NNK三者联合作用诱发细胞微核率
由图4可知,三者联合作用随着剂量的增加,细胞微核率均呈现上升趋势,表现剂量依赖趋势。诱发细胞微核率显著低于理论预期值2,但与理论预期值1的结果相差较小。特别是固定低剂量B[a]P(1/10 IC50)和固定低剂量NNK(1/10 IC50)存在时,再加入CSC诱发的细胞微核率接近理论预期值1,提示有较弱的相互作用(弱相加)。诱发细胞微核能力 比 较 ∶ (B[a]P+NNK)+CSC > (CSC+B[a]P)+NNK >(NNK+CSC)+B[a]P。
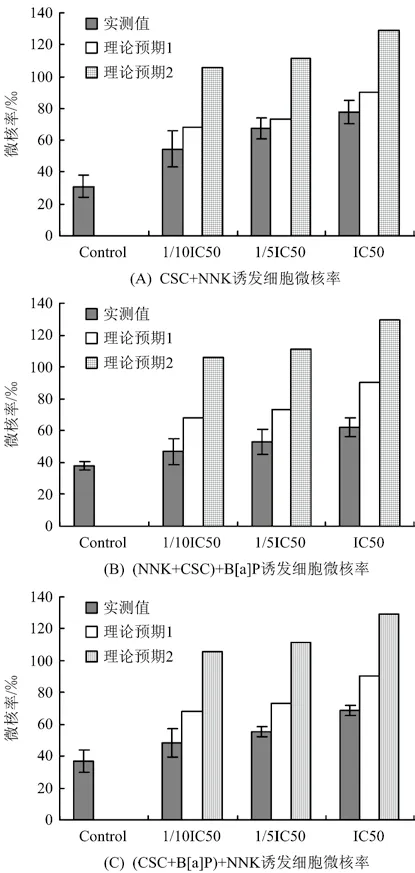
图4 CSC、B[a]P与NNK三者联合作用对BEAS-2B细胞微核率的影响
3 讨论
相关研究[23-24]表明,支气管上皮细胞为吸入式有害物质在体内代谢活化的主要场所。本实验所用BEAS-2B细胞,是由正常人支气管上皮细胞经腺病毒-12/SV40杂交病毒感染,连续传代筛选而永生化所得,是研究肺癌相关机理的重要靶细胞。B[a]P可导致肺癌A549细胞DNA损伤,使细胞周期发生阻滞[25];B[a]P与多氯联苯联合作用时,能抑制B[a]P代谢产物葡萄糖化,减缓B[a]P代谢速率[26];2, 4,6 - 三硝基甲苯(TNT)与B[a]P呈拮抗效应,可阻止B[a]P进入细胞[27]。NNK在烟草中含量高,能造成细胞的氧化损伤[28],诱导支气管上皮细胞的恶性转化[29], 与肺癌的相关性很高[30]。α粒子和NNK联合作用于BEP-2D细胞时,协同效应显著[31],而B[a]P和NNK之间的联合作用却少见文献报道。探究B[a]P、NNK在卷烟烟气复杂基质中的相互作用关系,有利于分析卷烟烟气有害物质的毒性作用及相关机理,构建符合其特征性的危害性研究方法。
本试验以BEAS-2B为靶细胞,通过对CSC及其最具代表性的有害成分NNK和B[a]P的联合作用诱发细胞微核能力进行分析,发现B[a]P、NNK与CSC均具有体外细胞诱变性,且存在明显剂量效应关系。B[a]P与CSC的联合作用、B[a]P与NNK的联合作用、CSC与NNK的联合作用均具有剂量依赖效应,但比预期毒性小,并与作用的先后顺序无关。特别是在较低剂量是与单纯作用结果相当,提示两两联合作用诱发细胞微核存在一定的拮抗效应。三者联合作用时均具明显的剂量效应关系,诱发细胞微核率显著低于理论预期值2,但与理论预期值1的结果相差较小。特别是固定低剂量B[a]P(1/10 IC50)和固定低剂量NNK(1/10 IC50)存在时,再加入CSC诱发的细胞微核率接近理论预期值1,提示有较弱的相互作用(弱相加)。笔者推测B[a]P和NNK可能与卷烟烟气中其他成分发生协同作用作用,随着CSC含量的上升,激活了BEAS-2B细胞CSC中其他物质代谢的相关酶类物质,促使CSC代谢加快,表现为诱发微核率上升趋势较快,增大了细胞的遗传毒性。
4 小结
本研究证实B[a]P、NNK与CSC之间两两联合存在拮抗作用,而三者之间的联合作用呈现协同(弱相加)效应。这一结果,对评价卷烟烟气中有害成分的危害性具有一定的指导意义。同时也提示卷烟烟气中其他有害成分(如苯酚、巴豆醛、重金属等)物质之间的相关性,有待进一步研究。
[1]Baker R R ,Pereira JR da Silva ,Smith G.The effect of tobacco ingredients on smoke chemistry.Part I∶ Flavourings and additives [J].Food and Chemical Toxicology ,2004 ,42:32-37.
[2]谢剑平,刘惠民,朱茂祥.卷烟烟气危害性指数研究[J].烟草科技, 2009(2):5-15.
[3]夭建华, 陈章玉,吴平艳,等. 卷烟烟气的毒理学指标与其重要有害成分之间的相关性[J]. 烟草科技,2005(12)∶ 17-20.
[4]Ellard S, Mohammed S, et al. The use of genetically engineered V79 Chinese hamster andAHH1 human lymphoblastoid Cultures expressing ratliverCYP1A1, 1A2 and 2B1cDNAs in micronucleus assays [J].Mutagenesis, 1991, 6∶ 461-470.
[5]Channarayappa, Nath J, Ong T. Clastogenic and aneuploido genic effects of cigarette Smoke condensate, Mitomycin Candv in cristinesul fate [J].Mutagenesis, 1992, 7(6)∶ 457-460.
[6]Veltel D, Hoheneder A. Characterization of cigarette smoke induced micronuclei in vitro [J]. Exp Toxic Pathol, 1996, 48∶ 548-550.
[7]Massey E D. Tobacco smoke genotoxicity∶ An in vitro perspective [J].Recent Advances in Tobacco Science, 2002, 28∶ 69-103.
[8]Gu Zuwei, Whong W Z, Wallace W E, et al. Induction of micronuclei in BALB/c-3T3 cells by selected chemicals and complex mixtures [J].Mutation Research, 1992, 279∶ 217-222.
[9]Moore M M, Honma M, Clements J. Mouse lymphoma thymidine kinase locus gene mutation assay∶ International Workshop on Genotoxicity Test Procedures Work group Report [J]. Environmental and Molecular Mutagenesis, 2000, 35∶ 185-190.
[10]GB15193.06-2003 哺乳动物骨髓细胞染色体畸变试验[S].
[11]Doolittle D J,C K Lee, et al. Genetic toxicology studies comparing the activity of sidestream smoke from cigarettes which burnoronly heat tobacco[J].Mutation Research,1990,249∶59-72.
[12]Doolittle D J, Lee C K,Ivett J L, et al. Comparative studies on the genotoxic activity of mainstream smoke condensate from cigarettes which burn or only heat tobacco[J].Environmental and Molecular Mutagenesis,1990,15∶93-105.
[13]Bombick B R, Murli H, Avalos J T. Chemical and biological studies of an cigarette that primarily heats tobacco. part 2∶Invitro toxicology of main stream smoke condensate[J].Food Chem Toxicol, 1998,36∶83-190.
[14]Lafi A, Parry J M. The effects of ventilation and dilution of smoke upon the clastogenic and an eugenic activity of tobacco particle matter in cultured mammalian cells[J].Mutation Research,1991,264∶51-57.
[15]曹佳. 微核试验[M]. 北京∶ 军事医学科学出版社2000∶ 264-272.
[16]杨颖. 体外微核技术及其进展[J]. 国外医学卫生学分册,2007(34)∶80-83.
[17]Cooper R L ,Lindsey A J ,Waller R E.The presence of 3,4-benzopyrene in cigarette smoke[J].Chem Ind ,1954 ,46:14-18.
[18]Hecht S S ,Hoffmann D.The relevance of tobacco-specific nitrosamines to human cancer[J].Cancer Surv ,1989 ,8:273-294.
[19]司徒镇强,吴军正.细胞培养[M].西安∶世界图书出版公司,2007:200-201.
[20]木潆,朱茂祥,齐绍武,等.NNK和B[a]P在卷烟烟气复杂基质中的联合细胞毒性[J].湖南农业大学学报:自然科学版 ,2012,38(1)∶49-52
[21]刘荣.卷烟烟气中五种重要有害成分的细胞毒性和遗传毒性研究[D].长沙:湖南农业大学,2009.
[22]Schlede E ,Genschow E ,Spielmann H ,et al.Oral acute toxic class method∶ a successful alternative to the oral LD50 test [M].Regul Toxicol Pharmacol ,United States ,2005:15-23.
[23]吕兰海,杨陟华,尤汉虎,等.卷烟烟气及其主要有害成分诱发细胞基因突变的研究[J].环境与健康杂志,2000,21(5):286-288.
[24]朱茂祥,张劲松,杨陟华,等.纳米硒对4-甲基亚硝胺-1-(3-吡啶)-1-丁酮诱发昆明小鼠肺癌的防治研究[J].癌症,2000,19(10):883-886.
[25]吴晓明,周宜开,王志勇,等.苯并(a)芘对肺癌细胞DNA损伤及修复基因表达水平的影响[J].中华劳动卫生职业病杂志,2002年,20(6):443-445.
[26]Margaret O James , Kevin M Kleinow , Youbo Zhang , et al.Increased toxicity of benzo ( a) pyrene -7, 8- dihydrodiol in the presence of polychlorobiphenylols [J].Marine Environmental Research ,2004 ,58:343-346.
[27]Washburn K S,Donnelly K C,Huebner H J,et al. A study of 2, 4, 6- trinitrotoluene inhibition of benzo ( a) pyrene uptake and activation in a microbialmutagenicity assay [J].Chemosphere,2001,44:1703-1709.
[28]杨陟华,朱茂祥,龚诒芬,等.NNK诱发人支气管上皮细胞恶性转化及氧化损伤机理研究[J].癌变·畸变·突变,1999,11(4):184-188.
[29]Zhou H,Calaf G M,Hei T K.Malignant transformation of human bronchial epithelial cells with the tobacco-specific nitrosamine 4- (methylnitrosamino) -1-(3-pyridyl )-1-butanone [J].Int J Cancer,2003,106:821-826.
[30]张红, 刘铭.NNK结构与其代谢机理和致癌性研究[J].宝鸡文理学院学报(自然科学版),2007,27(4):287-290.
[31]李平,潘秀领,朱茂祥,等.α粒子和NNK联合作用的细胞遗传毒性[J].中华放射医学与防护杂志,2006,26(3):33-36.
