乙肝病毒基因组1896位点变异株与野生株的快速检测
2012-11-05郭龙华万泽民何文军吴新忠冯春颜吴文权
郭龙华,陈 茶,万泽民,何文军,吴新忠,周 强,冯春颜,吴文权
(1.深圳市龙华人民医院 检验科,广东 深圳518109;2.广东省中医院 检验科,广东 广州510120)
乙型肝炎病毒(Hepatitis B Virus,HBV)前C区定位于乙肝病毒基因组nt1814-1900,前C区是HBV基因组的高变区,前C区最常见的变异为G1896A点突变,使第28位密码子TGG→TAG(终止子),翻译提前终止,导致HBeAg阴转,影响干扰素疗效[1]。目前一些常用方法对前C区1896位点变异株与野生株的混合感染易漏检,本研究建立的荧光定量PCR法能快速检测乙肝病毒基因组1896位点变异株与野生株的混合感染。
1 材料与方法
1.1 材料
1.1.1 血清标本来源于本院门诊和住院病人。
1.1.2 主要仪器 Roche公司LightCycler型荧光定量PCR仪、法国VL公司Bio-1D型凝胶成像仪、日本岛津(Shimadzu)UV-2550型紫外可见分光光度计。
1.1.3 主要试剂 广州达安基因公司HBV DNA荧光定量PCR检测试剂盒、蛋白酶K(Merck公司)、平衡酚(国产),裂解液(自配)。Taq DNA酶(MBI公司)、dNTP(Promega公司)、DNA Marker(TaKaRa公司)、PMD18-T载体(TaKaRa公司)。
1.1.4 参照GenBank中的HBV基因组序列,用Primer Premier 5.0软件设计5条特异性引物和1条特异性探针,由上海英骏生物技术有限公司合成。
P1:5-GAC TCT CAG CAA TGT CAA CG-3′(nt 1669-1688);
P2:5-TTG CCT GAG TGC GGT ATG GTG A-3′(nt 2071-2050);
P3:5-TCA CCT CTG CCT AAT CAT CTC A-3′(nt 1825-1846);
P4:5-TCA ATG TCC ATG CCC C-3′(nt 1911-1896);
P5:5-TCA ATG TCC ATG CCC T-3′(nt 1911-1896)(针对突变株);
TaqMan荧 光 探 针 :5′- (FAM)-CTC CAA GCT GTG CCT TGG GTG G-(TAMRA)-3′(nt 1891-1870)。
1.2 方法
1.2.1 收集30例 HBV DNA含量高于1×103IU/ml血清标本(用广州达安基因公司HBV DNA荧光定量PCR试剂盒检测)。
1.2.2 HBV DNA 的提取方法参照文献[2]。
1.2.3 第一次PCR扩增:引物P1、P2(5μmol/L)各1μl,10×缓冲液2μl,dNTP(10mmol/L)0.4 μl,Taq DNA 酶(1U/μl)0.5μl,MgCl2(25mmol/L)0.4μl,模板2μl,ddH2O 12.7μl,总体积20μl,95℃5分钟。然后94℃0.5分钟,53℃0.5分钟,72℃0.5分钟共循环35次,72℃延伸5分钟。取PCR产物在1.2%琼脂凝胶(含EB)上电泳,观察结果。
1.2.4 用试剂盒回收和纯化PCR产物,然后克隆入PMD18-T载体转化到大肠杆菌DH5α,将筛选出的阳性重组质粒送上海英骏生物技术有限公司用M13通用引物正反测序,分别选出含变异株和野生株序列重组质粒的大肠杆菌DH5α增菌,提取和纯化质粒,检测A260和A280值,计算质粒样品浓度(μg/μl),换算出质粒拷贝数浓度(IU/ml),分别稀释成1×103IU/ml、1×104IU/ml、1×105IU/ml、1×106IU/ml作标准模板备用。
1.2.5 荧光定量PCR扩增 每个标本同时做2个扩增管,一管加P3、P4(5μmol/L)各1μl,另一管加P3、P5(5μmol/L)各1μl,其余所加成份相同,10×缓冲液2μl,dNTP(10mmol/L)0.4μl,Taq DNA酶(1U/μl)0.5μl,MgCl2(25mmol/L)0.4μl,Taq-Man荧光探针 0.1μl(50μmol/L),模板 2μl,ddH2O 12.6μl,总体积20μl,94℃5分钟。然后94℃20秒,55℃45秒,共循环40次。
1.2.6 荧光定量PCR标准曲线 上述稀释好的标准模板(野生株质粒和变异株质粒)作扩增模板,野生株质粒用引物P3、P4,变异株质粒用引物P3、P5,其余扩增条件相同,调整基线以试剂空白和阴性管不出现阳性为准,与基线的交点的循环次数(Ct)值为纵坐标,HBV DNA浓度的对数值为横坐标,仪器自动绘制标准曲线,利用待测标本的Ct值求出相应的HBV DNA含量。
1.2.7 灵敏度检测 选取1份用广州达安基因公司HBV DNA荧光定量PCR试剂盒检测HBV DNA含量为5×106IU/ml血清标本,用HBV阴性血清1∶5倍连续稀释,检测本法灵敏度。
1.2.8 临床标本检测,共检测30例HBV DNA血清标本。
2 结果
2.1 第一次PCR产物电泳结果 见图1。
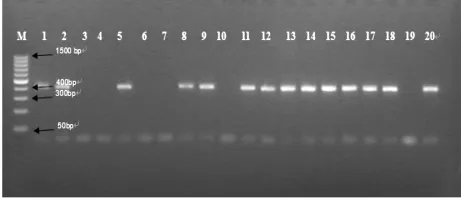
图1 PCR产物电泳结果设计产物长403bp,电泳结果与预期一致。
2.2 野生型质粒去载体后序列如下
TCAGCAATGTCAACGACCGACCTTGAGGCA TACTTCAAAGACTGTGTGTTTAAGGACTG GGAGGAGTTGGGGGAGGAGATTTGGCTTT GTACTAGGAGGCTGTAGGCATAAATTGGT CTGTTCACCAGCACCATGCAACTTTTTCAC CTCTGCCTAATCATCTCATGTTCATGTCCT ACTGTTCAAGCCTCCAAGCTGTGCCTTGGG TGGCTTTGGGGCATGGACATTGACCCATAT AAAGAATTTGGAGCTTCTGTGGAGTTACT CTCTTTTTTGCCTTCTGACTTCTTTCCTTC TATTCGAGATCTCCTCGACACCGCCTCTGC TCTGCACCGGGAGGCCTTAGAGTCTCCGGA ACAGTGTTCACCTCACCATACCGCACTCAG GCAA
序列中粗体字G为野生株1896位点。
2.3 变异型质粒去载体后序列如下
TCAGCAATGTCACCGACCGACCTTGAGGCA TACTTCAAAGTTTGTGTGTTTAAGGACTG GGAGGAGTTGGGGGAGGAGATTTGTCTTT GTACTAGGAGGCTGTAGGCATAAATTGGT CTGTTCACCAGCACCATGCAACTTTTTCAC CTCTGCCTAATCATCTCATGTTCATGTCCT ACTGTTCAAGCCTCCAAGCTGTGCCTTGGG TGGCTTTAGGGCATGGACATCGACCCATAT AAAGAATTTGGAGCTTCTGTGGAGTTACT CTCTTTTTTGCCTTCTGACTTCTTTCCTTC TATTCGAGATCTCCTCGACACCGCCTCTGC TCTGTATCGGGAGGCCTTAGAGTCTCCGGA ACATTGTTCACCTCACCATACCGCACTCAG GCAA
序列中粗体字A为变异株1896位点。
2.4 野生型标准品扩增曲线 见图2。
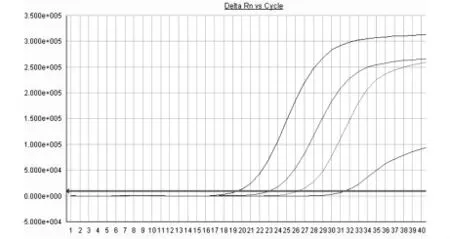
图2 野生型标准品扩增曲线
2.5 变异型标准品扩增曲线 见图3。
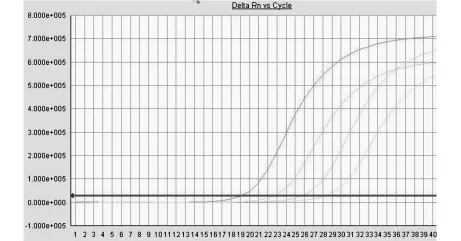
图3 变异型标准品扩增曲线
2.6 临床标本检测 本法灵敏度为1×103IU/ml,本次实验共检测30个标本,HBV DNA含量大于1×103IU/ml为阳性,有7个标本只检测到野生株,4个标本只检测到变异株,其余19个标本都是变异株与野生株混合感染。
3 讨论
HBV是不完全双链环状DNA病毒,HBV复制过程中要经过逆转录,由于逆转录酶缺乏有效的碱基校对功能,故HBV基因组比一般DNA病毒易发生变异,这给疾病的预防、诊断、治疗和预后带来新问题[3-4]。前C区是HBV基因组的高变区,前C区最常见的变异为G1896A,导致HBeAg阴转,影响干扰素对HBV的疗效。
由于干扰素对乙型肝炎病毒患者抗病毒治疗疗程长、存在不良反应、患者花费大,因而治疗前需对患者进行评估。HBeAg阴性患者,可用中药方剂抗病毒治疗[5]。干扰素治疗对象主要是HBeAg阳性患者。在HBV感染者体内,常形成以一个优势株为主的相关突变株病毒群,称为准种[6](quasispecies),即变异株与野生株的混合感染。在HBeAg阳性患者体内有些是G1896A点突变株和G1896野生株的混合感染,干扰素对G1896野生株有较好的疗效,而对G1896A点突变株疗效不好,对这类患者用干扰素治疗体内会出现G1896A点突变株成为优势感染株,达不到抗病毒治疗的效果。如果单纯是G1896野生株感染,可直接用干扰素治疗。
本法是结合3′-碱基特异性引物的荧光定量PCR法,与特异性探针杂交法、PCR-RFLP(PCR限制性片断长度多态性分析)法、测序法等法相比具有简单快速,且能同时检测前C区1896位点变异株与野生株混合感染,有推广应用价值。
[1]Bayraktar Y,Koseoglu A,Temizer A,et al.Relationship between the serum alamine aminotransferase level at the end of interferon treatment and histolotic Changes in wild type and precore mutant hepatitis B virus infections[J].J Viral Hepat,1996,3:137.
[2]郭龙华,董长垣,高 婧,等.一种从血清标本中快速提取HBV DNA方法的建立[J].武汉大学学报(医学版),2005,26:344.
[3]Madden CR,Fingeold MJ,Slagle BL.Altered DNA mutation spectrum in aflatoxin bl-treated transgenic mice that express the hepatitis B virus X protein[J].J Virol,2002,76:1170.
[4]Charlotte LCW,Peter M,Anna LB,et al.Evaluation of a line probe assay for identification of hepatitis B virus precore Variants in serum form chronic hepatitis B carriers[J].J Virol Methods,2008,114:97.
[5]杨宏志,王拥泽,戴 敏,等.扶正祛邪和清热解毒方药治疗乙型肝炎病毒前C区基因变异的临床对照研究[J].中华实用中西医杂志,2003,16(13):74.
[6]高凤萍,左 峰.乙型肝炎病毒准种的研究进展[J].口岸卫生控制,2010,15(13):52.
