槟榔籽中抗氧化活性物质的分离与结构分析
2012-11-02王兆丹张海德罗仕数
韩 林,王兆丹,张海德,罗仕数
(1.重庆三峡学院生物系,重庆404100;2.海南大学食品学院,海南海口570228)
槟榔籽中抗氧化活性物质的分离与结构分析
韩 林1,2,王兆丹1,张海德2,*,罗仕数2
(1.重庆三峡学院生物系,重庆404100;2.海南大学食品学院,海南海口570228)
为了研究槟榔籽中的抗氧化活性物质,通过柱色谱法分离纯化槟榔籽乙醇提取物,结合抗氧化活性筛选,分离得到槟榔籽中主要的抗氧化活性物质Fr-4。利用高效液相色谱分析其纯度,经波谱分析确定该物质为表儿茶素。
槟榔籽,分离,抗氧化活性
槟榔 采摘自海南大学儋州校区植物园,海南品种,破壳取槟榔籽,干燥后备用,经测定,槟榔籽粉末含水量为5.32%;ABTS 购自Amersco公司;甲醇、氯仿、乙酸乙酯、石油醚、正丁醇、无水乙醇等 均为国产分析纯。
UV-2450紫外可见分光光度计 日本岛津公司;HH-8型数显恒温水浴锅 金坛市医疗仪器厂;FW80微型高速试样粉碎机 河北省黄骅市新兴电器厂;CP225D型分析天平 德国Sartorius公司;RE52CS-2型旋转蒸发器 上海亚荣生化仪器厂;LABCONCO型真空冷冻干燥器 美国LABCONCO公司;Waters 2695高效液相色谱仪 美国Waters公司;400MHz核磁共振波谱仪 瑞士布鲁克公司。
1.2 实验方法
1.2.1 ABTS实验方法[3-4]取5.0mL 7mmol/L的ABTS溶液,加入88.0μL 140mmol/L的过硫酸钾,在室温下置于暗处反应12~16h,形成ABTS自由基储备液。在734nm处,用体积分数70%的乙醇将ABTS自由基储备液稀释至吸光度为0.70±0.02,备用。准确量取0.1mL不同浓度(50、100、150、200μg/mL)的样品溶液,加入3.9mL ABTS+·溶液,混匀,在室温下反应6min,于734nm处测定吸光度(AE)。同时吸取3.9mL ABTS+·溶液,加入0.1mL体积分数70%的乙醇溶液于734nm处测定吸光度(AB)。ABTS自由基清除率按下式计算:

1.2.2 槟榔籽乙醇提取物的制备与预处理 利用体积分数为70%的乙醇溶液对槟榔籽粉末进行提取,得到的槟榔籽乙醇提取物经真空减压浓缩后,分别利用石油醚、乙酸乙酯、正丁醇和水溶液进行萃取。根据1.2.1中的方法对石油醚相、乙酸乙酯相、正丁醇相和水相进行抗氧化活性对比,选择抗氧化活性最强的相进行分离纯化。
1.2.3 硅胶柱层析实验与活性筛选[5-6]将待分离的样品按一定比例(1∶20)溶解于氯仿中,加入一定量的硅胶,拌匀后,挥干溶剂,将吸附有样品的硅胶轻轻均匀地添加在色谱柱的吸附剂上面。以甲醇-氯仿作为洗脱剂,按不同的比例(1∶9、3∶7、5∶5、7∶3、9∶1)混合进行梯度洗脱,得到五个部位,分别为Fr-1、Fr-2、Fr-3、Fr-4和Fr-5。以每瓶150mL收集洗脱液,真空浓缩后定容至相同体积,通过薄层层析进行定性分析,同时根据1.2.1中的方法测定各部位的抗氧化活性。
1.2.4 高效液相色谱分析[7]将抗氧化活性最强的部位配制成一定的浓度,利用高效液相色谱仪进行分析。色谱条件:色谱柱:3.9×150mm;流动相:质量分数为2%的冰醋酸水溶液和乙腈;检测波长:280nm;流速:1mL/min;进样量:20μL。
1.2.5 核磁共振波谱分析[8]将抗氧化活性最强的部位溶解于氘代氯仿(CDCl3),利用400MHz核磁共振波谱仪,测定氢谱(1H-NRM)和碳谱(13C-NRM)。通过对谱图的分析,结合参考文献,确定该化合物的结构。
1.2.6 统计学分析 使用SAS9.0 for Windows软件对数据进行统计学分析,每组实验均重复三次,实验数据表示为平均值±标准偏差。显著性分析采用t检验法。
2 结果与讨论
2.1 不同相抗氧化活性对比

表1 不同相提取物对ABTS自由基清除能力Table 1 ABTS radical-scavenging activities of different phases

表2 不同部位对ABTS自由基清除能力(%)Table 2 ABTS radical-scavenging activities of different fractions(%)
不同相对ABTS自由基清除效果如表1所示,不同相对ABTS自由基均有一定的清除能力,且随浓度的增加而增强。其中乙酸乙酯相的清除能力最强,实验浓度范围内(50~200μg/mL)最大清除率为59.74%±0.76%。因此选择乙酸乙酯相进行下一步的分离纯化研究。
2.2 不同部位抗氧化活性对比
各部位对ABTS自由基的清除作用如表2如示,Fr-4和Fr-5对ABTS自由基的清除能力显著强于Fr-1、Fr-2和Fr-3,在实验浓度范围内(50~200μg/mL)最大清除率分别为97.70%±0.17%和95.64%±0.68%。通过TLC检测(表3)发现,Fr-4中只有一个斑点,而Fr-5中含有三个斑点,相比较而言,Fr-4对ABTS自由基的清除能力更强,因此选择Fr-4进行高效液相色谱分析和核磁共振波谱分析。

表3 不同部位TLC检测的显色效果Table 3 The developing effect of different parts by TLC analysis
2.3 高效液相色谱分析
由图1和表4可知,从乙酸乙酯相经硅胶柱分离得到的Fr-4组分通过高效液相色谱分析,呈现三个吸收峰,其中保留时间为6.568min的吸收峰非常明显,其纯度为96.06%。因此可判断Fr-4是一种从槟榔中分离得到的纯度较高,抗氧化活性较强的化合物。

图1 化合物Fr-4高效液相色谱图Fig.1 Elution profile of Fr-4 by HPLC

表4 化合物Fr-4高效液相色谱图谱分析Table 4 The analysis of Fr-4 by HPLC
2.4 核磁共振波谱分析
化合物Fr-4:白色针晶,易溶于氯仿,微溶于甲醇、乙醇,其NMR图谱见图2和图3。
1H NMR(CD3Cl,400MHz):δ6.85(1H,d,J=2.0Hz,H-2’),6.73(1H,d,J=8.1Hz,H-5’),6.70(1H,d,J=2.0Hz,H-6’),5.90(1H,d,J=2.3Hz,H-8),5.83(1H,d,J=2.3Hz,H-6),4.54(1H,d,J=7.5Hz,H-2),3.95(1H,m,H-3),2.81(1H,dd,J=16.1,5.0Hz,H-4a),2.48(1H,dd,J=16.1,8.1Hz,H-4b)。
13C NMR(CD3Cl,100MHz):δ82.9(d,C-2),68.9(d,C-3),28.5(t,C-4),157.9(s,C-5),96.4(d,C-6),157.6(s,C-7),95.6(d,C-8),157.0(s,C-9),100.9(s,C-10),132.3(s,C-1’),116.2(d,C-2’),146.3(s,C-3’),146.3(s,C-4’),115.3(d,C-5’),120.1(d,C-6’)。
综合以上数据并与文献[9]对照,鉴定化合物Fr-4为表儿茶素,结构式如图4所示。

图2 化合物Fr-4的1H-NRM图谱Fig.2 1H-NRM spectra of compound Fr-4
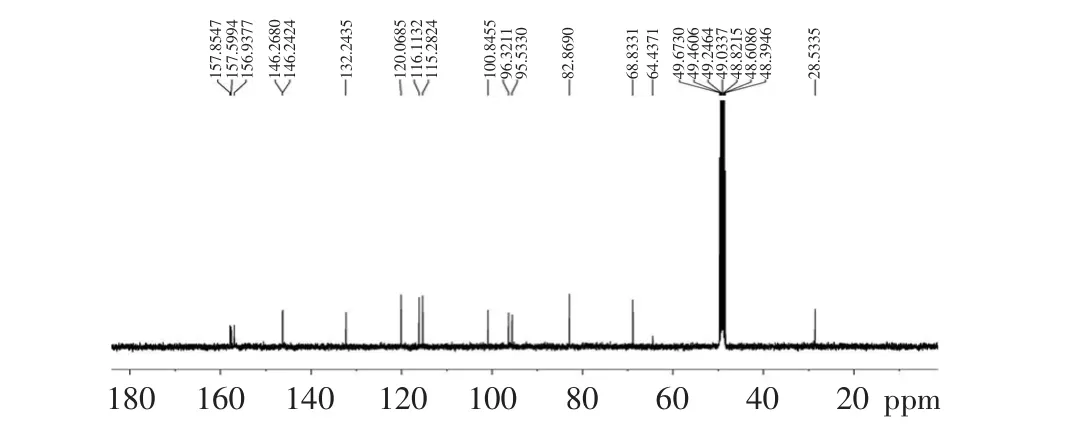
图3 化合物Fr-4的13C-NRM图谱Fig.3 13C-NRM spectra of compound Fr-4
3 结论
通过对槟榔籽乙醇提取物的过柱分离,得到Fr-1~Fr-5五个组分,结合抗氧化活性筛选,确定其中Fr-4部位抗氧化活性相对较强。通过TLC检测和HPLC分析可知,Fr-4部位是一种纯度较高的化合物。利用核磁共振波谱仪,测定氢谱(1H-NRM)和碳谱(13C-NRM)。通过对谱图的分析,确定该化合物为表儿茶素。实验结果表明,槟榔中主要的抗氧化活性物质为表儿茶素。

图4 表儿茶素的化学结构图Fig.4 The chemical structure of Epicatechin
[1]Penpun Wetwitayaklung,Thawatchai Phaechamud,Chutima Limmatvapirat,et al.The study of antioxidant capacity in various parts of Areca catechu L[J].Naresuan University Journal,2006,14(1):1-14.
[2]张兴,梅文莉,曾艳波,等.槟榔果实的酚类化学成分与抗菌活性的初步研究[J].热带亚热带植物学报,2009,17(1):74-76.
[3]Stéphanie Dudonné,Xavier vitrac,Philippe Coutière,et al. Comparative study of antioxidant properties and total phenolic content of 30 plant extracts of industrial interest using DPPH,ABTS,FRAP,SOD and ORAC assays[J].J Agric Food Chem,2009,57:1768-1774.
[4]Fang ZX,Zhang YH,Yuan LÜ,et al.Phenolic compounds and antioxidant capacities of bayberry juices[J].Food Chemistry,2009,113:884-888.
[5]D Grigonis,PR Venskutonis,B Sivik,et al.Comparison of different extraction techniques for isolation of antioxidants from sweet grass(Hierochloe odorata)[J].Journal of Supercritical Fluids,2005,33:223-233.
[6]徐静,韦京豫,郭继芬,等.石榴汁部分多酚类物质的分离鉴定[J].中国食品学报,2010,10(1):190-199.
[7]刘晓丽.余甘子多酚的分离、鉴定与生理活性研究[D].广州:华南理工大学,2007.
[8]吕海鹏.普洱茶的化学成分分析及其抗氧化活性研究[D].杭州:中国农业科学院茶叶研究所,2005.
[9]崔艳君,刘屏,陈若芸.鸡血藤有效成分研究[J].中国中药杂志,2005,30(2):121-123.
Isolation and structural characterization of antioxidant activity compounds from betel nut seed
HAN Lin1,2,WANG Zhao-dan1,ZHANG Hai-de2,*,LUO Shi-shu2
(1.Department of Biology,Chongqing Three Gorges University,Chongqing 404100,China;2.College of Food Science,Hainan University,Haikou 570228,China)
In order to research the antioxidant activity compounds of the betel nut seed,the ethanol extract of betel nut seed was isolated and purified by column chromatography.Combined with antioxidant activity screening,Fr-4 was isolated as the main antioxidant activity compounds of betel nut seed.HPLC was used to analyze its purity and epicatechin was identified by spectrum analysis.
betel nut seed;isolation;antioxidant activity
TS255.1
A
1002-0306(2012)03-0068-03
槟榔果别名仁频、宾门、槟榔玉、榔玉等,是棕榈科植物槟榔(Areca Catechu L.)的成熟种子,原产东南亚,在我国广东、海南、云南、福建、台湾等地均有栽培,尤以海南为多,是我国“四大南药”之首。槟榔果的成分较为复杂,含有31.1%的酚类,18.7%的多糖,14.0%的脂肪,10.8%的粗纤维,9.9%的水分,3.0%的灰分和0.5%的生物碱等物质。Penpun[1]等曾对槟榔中各部位的抗氧化能力进行了初步研究,结果表明,槟榔籽甲醇提取物具有最强的抗氧化活性,多酚类化合物是槟榔籽中主要的抗氧化物质,而槟榔碱则没有显示出抗氧化活性。张兴[2]等从槟榔果实的乙醇提取物中分离得到了5种酚类成分,并确定了其结构。然而,槟榔籽中主要的抗氧化活性物质却一直没有确定。本研究通过柱色谱法分离纯化槟榔籽提取物,同时进行抗氧化活性筛选,利用核磁共振波谱分析确定槟榔籽中主要的抗氧化活性物质及其化学结构。
1 材料与方法
1.1 材料与仪器
2011-02-11 *通讯联系人
韩林(1985-),男,助教,研究方向:果蔬深加工与综合利用。
国家“十一五”科技支撑计划(2007BAD76B03);重庆高校创新团队建设计划(201040);重庆三峡学院科研创新团队。
