人外周血树突状细胞的诱导、鉴定及活性测定
2012-10-30蔡学敏朱向情刘凌佟晓娜何洁马丽花潘兴华
蔡学敏 朱向情 刘凌 佟晓娜 何洁 马丽花 潘兴华
树突状细胞(dendritic cell,DC)是机体免疫系统中专职且功能最强的抗原提呈细胞,能直接激活体内初始型T细胞生成辅助性T细胞和杀伤性T细胞,也能使B细胞生成抗体。因此深入研究DC免疫调节机制,对认识肿瘤、感染及自身免疫系统疾病的发生机制有重要意义[1]。DC虽然体内广泛分布,但数量较少,难以分离和纯化。自1999年Randolph等[2]通过应用粒-巨噬细胞集 落 刺 激 因 子(granulocyte-macrophage colonystimulating factor,GM-CSF)体外扩增外周血 DC获得成功以来,DC的研究得到迅速发展,DC体外诱导方法的广泛应用,也为DC免疫调节机制的深入研究提供了基础。DC来源主要有骨髓、外周血和脐带血3个途径。对骨髓来源的研究已经很成熟,但采集时患者比较痛苦,大多不太愿意配合;而从脐带血虽能分离出很多的细胞,但不能做自体移植,存在较多伦理学和免疫排斥等问题;从外周血取材既可以较好地解决上述问题,又可以获得足够多的细胞,是获得DC的较好途径。本研究通过采用外周血单核细胞经细胞因子体外诱导DC获得成功,并对细胞进行了表面标志的鉴定及DC刺激T细胞增殖的活性鉴定,现报道如下。
材料与方法
一、材料
RhGM-GSF,RhIL-4,hTNF-a(美 国 Biosource公司);淋巴细胞分离液(Histopaque,1.077g/m1,北京灏洋生物公司);抗人CDla、抗人CD83单克隆抗体、同亚型对照抗体及异硫氰酸荧光素(fluorescein isothiocyanate,FITC)标记兔抗鼠IgG荧光二抗均购自美国PharMingen公司。完全培养基包括:RPMI1640(美国Gibico公司)、10﹪胎牛血清(美国Gibco公司)、2 mmol/L谷氨酰胺、0.0l mmol/L 丙酮酸钠、0.05 mmol/L巯基乙醇、20 mmol/L Hepes、100 U/ml青霉素、100 μg/ml链霉素。
二、方法
1.DC体外培养[3-4]:抽取健康志愿者外周抗凝全血约 30 ml,在无菌条件下,装入 50 ml的离心管中,并补加 PBS(pH 7.3) 缓冲液到 50 ml,混匀。缓慢沿管壁加到装有淋巴细胞分离液的50 ml离心管中,经淋巴细胞分离液梯度离心(600 ×g离心 20 min)分离,取中间白膜层细胞,置入 50 ml离心管中,加入PBS(pH 7.3)缓冲液悬浮细胞,400 ×g离心 5 min,重复 3 次。洗尽血小板,用RPMI 1640完全培养基悬浮细胞,调整细胞数为2×109个 /L,加入 6 孔板中,每孔 2 ml,放入 37℃、5﹪CO2孵箱中培养4 h后,吸弃培养液上清,加入预热的培养基缓慢摇动培养板去除非贴壁细胞,获得贴壁的单核细胞。每孔加入2 ml完全培养基,含 RhGM-CSF 100 ng/ml,RhIL-4 30 ng/ml,培养5 d,隔天半量换液,补充细胞因子。于第5、6天,每孔加入TNF-α 1000 U/ml,培养至第7天收集悬浮细胞;空白对照组只用RPMI 1640培养基培养悬浮细胞,不添加任何细胞因子。
2.细胞形态学观察及细胞表型检测:用倒置显微镜每天观察细胞的生长情况,观察其形态、大小和数量变化并照相记录。收集培养第7天的细胞,用 PBS(pH7.3) 缓冲液,400 ×g离心 5 min,洗涤细胞,部分细胞用于流式检测,部分细胞涂片进行免疫荧光染色。用于流式检测的洗涤后用FACS标记液PBA(PBS+l﹪BSA+0.02﹪叠氮钠)悬浮细胞,计数,调整细胞浓度为5×106/ml,加入离心管中,100 μl/管,再分别加入PC5-抗人CD83 单抗(mAb)、PE-抗人 CD1α 单抗各 10 μl,轻轻摇匀2 s,室温避光反应30 min。各管分别加入 PBS 缓冲液 2 ml,混匀,400 ×g离心 5 min,洗2次,吸弃上清,各管加入PBS液0.5 ml,轻轻震散细胞团,通过流式细胞仪检测细胞表面表型[5-6]。
进行免疫荧光染色的DC涂片后用4℃冷丙酮固定 10 min 后再用PBS(pH 7.3) 洗3 次,每次 5 min;滴加正常山羊血清封闭,室温孵育 5~ 10 min,弃去血清,勿洗,分别滴加50 μl FITC标记的CD83和PE标记的CD1a单克隆抗体,40℃闭光过夜;PBS(pH7.3)洗 3次,每次 5 min,荧光显微镜下观察并照相[7]。
3.T淋巴细胞的制备及刺激增殖实验[8-9]:另取健康志愿者外周抗凝全血,用淋巴细胞分离液梯度离心分离,常规分离单个核细胞,用37℃预温的含 5﹪ FCS 的 RPMI 1640 稀释为(1~ 2)×107/ml,加在37℃预温的尼龙毛上,37℃、5﹪CO2孵箱中培养 30 min,用预温的 RPMI 1640 轻轻冲洗出未黏附在尼龙毛上的细胞即为T细胞,用作T淋巴细胞剌激增殖实验。
将第7天获得的DC细胞收集培养,用丝裂霉素C处理45 min,去除细胞的增殖活性,与T细胞按不同比例混合。于96孔板中,每孔分别加入 DC 悬液 2×104、5×103、2×103,以自身 T 淋巴细胞作为T细胞空白对照,每组设3个复孔,分别按1:1、1:2、1:5的比例加入T淋巴细胞,终体积为200 μl,在 37℃ 5﹪CO2培养箱中孵育 72 h 后,每孔取出上清 100 μl,每孔加入 1.25 g/L 的 MTT 60 μl,37℃ 4 h 后每孔加入 0.04 mol/L 的 DMSO 100 μl/L终止反应,静止5 min后在酶标仪上测570 nm波长的吸光度值。以此评价DC刺激T淋巴细胞增殖的能力。
三、统计学分析方法
采用SPSS13.0软件进行统计分析,3组诱导细胞表面标志CD1aCD83双阳性细胞、CD83阳性细胞和CD1a阳性细胞的比较采用单因素F检验及LSD两两比较,以P< 0.05为差异有统计学意义。
结 果
一、细胞形态
从外周血获取的外周血单个核细胞,培养4 h后获得的贴壁细胞为单核细胞,加入RhGM-CSF,RhIL-4培养24 h后,即见贴壁的单核细胞聚集成均匀散布的细胞聚体,细胞呈逗号状或水滴状。于培养第4天,即可见部分悬浮细胞,细胞呈多种形状:星形、圆形、梭形等。于培养第5天加入促DC成熟的RhTNF-α后,倒置显微镜下可见大部分细胞悬浮不贴壁,形态不规则,细胞体积增大、数量增多,大多有毛刺状突起。第6、7天可见毛刺状突起进一步增长增多,为典型DC形态,培养板上留有少量贴壁伸展的巨噬细胞(图1)。

图1 倒置相差显微镜下观察人外周血分化为树突状细胞的形态
二、FACS分析
收集培养第7天的各组悬浮细胞,用FITC-抗 人 CD83mAb和 PE-抗 人 CD1αmAb进 行 流式细胞术分析表明:没有加任何细胞因子的空白组细胞,DC细胞标志表达量很低,CD1aCD83双阳性细胞仅占0.5﹪,CD1a阳性细胞为9.7﹪,CD83 阳性细胞为 0.7﹪(F=350.058,P=0.000);而加入细胞因子诱导4 d后,DC细胞标志有一定变化,CD1aCD83双阳性细胞为5.1﹪,CD1a阳性细胞为84.6﹪,CD83阳性细胞为7.7﹪(F=3343.914,P=0.000),于培养第 5 天加入促DC成熟的RhTNF-α后,第2天DC细胞标志为CD1aCD83双阳性细胞为16.9﹪,CD1a阳性细胞为80.8﹪,CD83阳性细胞为19.5﹪(F=695.293,P=0.000)。培养到第 5、7 天,细胞表面各标志表达阳性率与对照组相比,差异均有统计学意义(P< 0.01,图2,表1)。
表1 人外周血诱导细胞表面标志结果(﹪,±s)
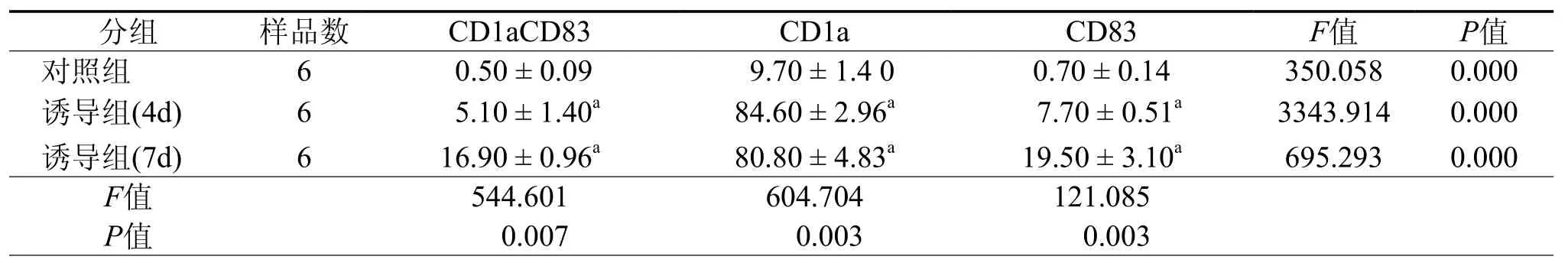
表1 人外周血诱导细胞表面标志结果(﹪,±s)
注:a与对照组相比,P < 0.01,差异有统计学意义
分组 样品数 CD1aCD83 CD1a CD83 F值 P值对照组 6 0.50 ± 0.09 9.70 ± 1.4 0 0.70 ± 0.14 350.058 0.000诱导组(4d) 6 5.10 ± 1.40a 84.60 ± 2.96a 7.70 ± 0.51a 3343.914 0.000诱导组(7d) 6 16.90 ± 0.96a 80.80 ± 4.83a 19.50 ± 3.10a 695.293 0.000 F值 544.601 604.704 121.085 P值 0.007 0.003 0.003

图2 人外周血分化为树突状细胞后细胞表面标志情况(FACS)
三、免疫荧光染色
培养7 d的悬浮细胞,用CD83和CD1a单克隆抗体进行免疫荧光染色,90﹪以上细胞表达DC细胞标志物CD83和CD1a(图3)。
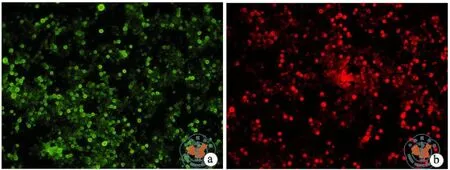
图3 CD83和CD1a单克隆抗体进行免疫荧光染色鉴定DC结果(×100)
四、DC刺激T淋巴细胞增殖活性
通过实验,与对照组相比,DC明显有刺激T淋巴细胞增殖的能力,并且本法获得的DC按不同比例与T淋巴细胞混合行细胞刺激增殖实验均产生强大的刺激和促增殖能力。其中1:1时的刺激增强作用最强,吸光度值为0.74,为正常对照的3倍多,实验组活性与对照组相比差异有统计学意义(P<0.05);而 DC 与 T 细胞 1:2 或 1:5 时,吸光度值分别为0.6、0.58,吸光度值为正常对照的2倍多,活性与对照组相比差异有统计学意义(P<0.05), 而两都本身活性差别不大(图4)。
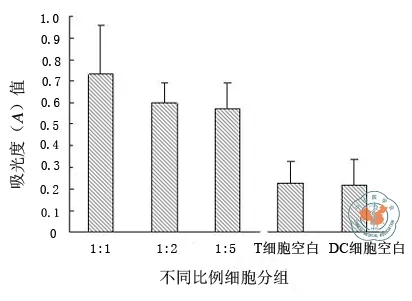
图4 树突状细胞刺激T淋巴细胞增殖活性情况
讨 论
DC可以从不同的部位分离,如骨髓、脐带血、脾脏和外周血等[3-4]。外周血树突细胞是最近几年研究比较多的一类免疫细胞[2],这主要由于外周血采集比较容易,细胞量比较大保证了实验的可操作性,同时可以获取足够的DC用于进一步的实验,为DC的应用提供实验依据。
外周血DC自1999年首次明确其特征为诱导后细胞体积快速增大以来,进一步的研究表明其最主要的功能和特性是分泌Ⅰ型干扰素以应对病毒及其核酸的感染[2-3,10]。
本研究采用密度梯度离心与贴壁培养法相结合的DC分离方法,利用了DC密度低且能够贴壁生长的特征[11]。通过密度梯度离心获得DC及单核细胞悬液,然后短暂培养得到DC而除去其中的巨噬细胞及成纤维细胞。巨噬细胞成熟时和DC一样都能表达MHC-Ⅱ以及CD80、CD86等细胞标志[12],非常容易干扰后续实验。
RhGM-CSF与RhIL-4组合是诱导DC成熟比较常用的一种方法[11]。GM-CSF是维持DC分化与发育必要的细胞因子,而IL-4起抑制DC前体细胞向巨噬细胞和粒细胞分化的作用,如果诱导体系中只单独加入GM-SCF则不能诱导DC生成,得到的主要是巨噬细胞。
未成熟的树突前体细胞表达的细胞表面标志物较多,主要为 CD3-、CD11-、CD14-、CD16-/CD56-、CD19-、CD33-、CD40-orlow、MHC-Ⅰ、MHC-Ⅱ、CD80low、CD83-、CD86low和 CD45RA+[13-15],诱导成熟后,其MHC-Ⅰ、MHC-Ⅱ分子、共刺激分子和黏附分子表达显著升高,B7-1(CD80)、B7-2(CD86)、CD58、ICAM(CD54)、CD40 和 CD1a表达量升高,与溶酶体相连的膜糖蛋白(LAMP)高表达,MHC-Ⅰ、MHC-Ⅱ类分子如 HLA-A、HLA-B、HLA-C、HLA-DR、DP、DQ 以及黏附分子如CD83也是高表达的[13,16]。但是,目前尚未发现DC的特异性标志[2],因此对DC的鉴定方法还是以检测其细胞表面标志与其刺激T淋巴细胞增殖的功能检测相结合。本研究中,流式细胞检测及免疫荧光染色均证实诱导成熟后的细胞高表达CD83及CD1a,然后通过其刺激淋巴细胞增殖实验证实我们得到的DC能够刺激淋巴细胞增殖3倍以上,具有较强刺激淋巴细胞增殖的能力。
近年的研究表明DC在临床病毒感染[17-19]及肿瘤[20-25]的生物治疗领域备受关注,在前列腺癌、黑色素瘤、结肠癌和肾癌等的治疗上取得令人鼓舞的成果。其治疗原理是通过个体化肿瘤多肽冲击致敏DC,再将其回输到患者体内,利用其最强抗原递呈能力激活患者对相应肿瘤的免疫能力从而使患者肿瘤得到治疗[26-27]。可以看出DC的临床应用的关键前提就是必须获得足够数量的有活性的DC。本研究使用外周血作为DC来源,通过优化分离、纯化、扩增及诱导方法,得到了大量有活性的DC,为将来的临床应用提供了实验基础。
1 Kawakami Y. cancer treatment by comprehensive regulation of anti-tumor immune network[J]. Nippon Rinsho, 2010, 68(6):1094-1099.
2 Randolph GJ, Inaba K, Robbiani DF, et al. Differentiation of phagocytic monocytes into lymph node dendritic cellsin vivo[J]. Immunity, 1999 ,11(6):753-761.
3 Bjorck P, Leong HX, Engleman EG. Plasmacytoid dendritic cell dichotomy:Identification of ifn-alpha producing cells as a phenotypically and functionally distinct subset[J]. J Immunol, 2011, 186(3):1477-1485.
4 吴萍萍 , 杜晓英 , 刘书逊 , 等 . 不同来源人树突状细胞的培养诱导及鉴定 [J]. 浙江医学 , 2007, 29(9):928-930.
5 吴鸣宇. 黑色素瘤基因(mage-1)相关肽负载树突状细胞对肝癌细胞杀伤作用的实验研究[D][硕士]. 苏州大学 , 2003.
6 Wu J, Zhou C, Robertson J, et al. Identification of a bone marrow-derived cd8alphaalpha+dendritic cell-like population in inflamed autoimmune target tissue with capability of inducing t cell apoptosis[J]. J Leukoc Biol, 2010, 88(5):849-861.
7 聂晓华 , 遇奇 , 李建东 , 等 . 猪血源树突状细胞诱导培养与鉴定 [J]. 中国农学通报 , 2011, 27(1):407-411.
8 王媛 , 杨爱珍 , 陈惠英 , 等 . 人外周血树突状细胞的体外诱导和鉴定 [J]. 临床肿瘤学杂志 , 2004, 9(6):597-600.
9 蔡兵. 黑色素瘤基因(mage-1)相关肽致敏树突状细胞治疗原发性肝癌的实验研究[D][博士]. 苏州大学, 2002.
10 Zaba L C, Fuentes-Duculan J, Eungdamrong NJ, et al. Identification of tnf-related apoptosis-inducing ligand and other molecules that distinguish inflammatory from resident dendritic cells in patients with psoriasis[J]. J Allergy Clin Immunol, 2010, 125(6):1261-1289.
11 Chauhan D, Singh AV, Brahmandam M, et al. Functional interaction of plasmacytoid dendritic cells with multiple myeloma cells: A therapeutic target[J]. Cancer Cell, 2009, 16(4):309-323.
12 斯东锋 , 岳嘉宁 , 杨勇 , 等 . 大鼠脾脏树突状细胞的体外分离培养 [J]. 上海交通大学学报(医学版), 2007, 27(6):755-758.
13 马国强, 王佳烈. 人外周血树突状细胞的体外培养及鉴定 [J]. 中国现代医生 , 2007, 45(24):4-6.
14 付必莽 , 何晓顺 , 余思 , 等 . 小鼠骨髓源半成熟树突状细胞的培养与初步鉴定[J]. 中国医学科学院学报, 2008, 30(04):430-435.
15 Zimmer A, Luce S, Gaignier F, et al. Identification of a new phenotype of tolerogenic human dendritic cells induced by fungal proteases from aspergillus oryzae[J]. J Immunol, 2011, 186(7):3966-3976.
16 Takekoshi T, Tada Y, Watanabe T, et al. Identification of a novel marker for dendritic cell maturation, mouse transmembrane protein 123[J]. J Biol Chem, 2010, 285(41):31876-31884.
17 Monie A, Tsen SW, Hung CF, et al. Therapeutic HPV DNA vaccines[J]. Expert Rev Vaccines, 2009, 8(9):1221-1235.
18 Rehermann B. Hepatitis c virus versus innate and adaptive immune responses: A tale of coevolution and coexistence[J]. J Clin Invest, 2009, 119(7):1745-1754.
19 Xing LH, Ma WP, Zhang XS, et al. Identification of circulating type Ⅱ pre-dendritic cells (pDC2) and its clinical significance in chronic hepatitis B virus infection[J]. Zhonghua Shi Yan He Lin Chuang Bing Du Xue Za Zhi, 2007, 21(3):247-249.
20 Ramsay AG, Gribben JG. Vaccine therapy and chronic lymphocytic leukaemia[J]. Best Pract Res Clin Haematol, 2008, 21(3):421-436.
21 Papewalis C, Wuttke M, Jacobs B, et al. Dendritic cell vaccination induces tumor epitope-specific th1 immune response in medullary thyroid carcinoma[J]. Horm Metab Res, 2008, 40(2):108-116.
22 PandolfiF, Cianci R, Lolli S, et al. Strategies to overcome obstacles to successful immunotherapy of melanoma[J]. Int J Immunopathol Pharmacol, 2008, 21(3):493-500.
23 Kiessling A, Fussel S, Wehner R, et al. Advances in specific immunotherapy for prostate cancer[J]. Eur Urol, 2008, 53(4):694-708.
24 Ballestrero A, Boy D, Moran E, et al. Immunotherapy with dendritic cells for cancer[J]. Adv Drug Deliv Rev, 2008, 60(2):173-183.
25 Pilla L, Valenti R, Marrari A, et al. Vaccination: Role in metastatic melanoma[J]. Expert Rev Anticancer Ther, 2006, 6(8):1305-1318.
26 Ocadlikova D, Kovarova L, Hajek R, et al. The preparation of myeloma-specific t cells activated with dendritic cells loaded with nonapeptides derived from mucin protein muc1 and catalytic subunit of telomerase htert[J]. Klin Onkol, 2008, 21(2):59-65.
27 Takeuchi S, Furue M. Dendritic cells:Ontogeny[J]. Allergol Int, 2007, 56(3):215-223.
