缺氧/复氧后星形胶质细胞AQP5表达的变化及亚低温的干预效应
2012-10-18董瑞国李晓宾张冠群
刘 君 董瑞国 李晓宾 张冠群 崔 晓
水通道蛋白(aquaporin,AQP)是一种对水具有选择性通透功能的膜通道蛋白家族,目前越来越多的证据显示脑水肿的发生与AQP有着密切的关系。亚低温(31~35℃)具有显著的脑保护作用,但其具体的作用机制尚未完全清楚。既往有关脑水肿的研究主要为AQP4,AQP5的表达与脑水肿的关系报道较少。星形胶质细胞的缺氧、复氧过程与脑缺血再灌注损伤的病理过程相似,因此研究缺氧/复氧条件下星形胶质细胞AQP5表达的特点及亚低温干预效应,对于探讨缺血再灌注脑水肿的形成及亚低温的作用机制可以有着更深一步的认识。
1 材料与方法
1.1 试剂
DMEM培养基(美国Hyclone),一抗山羊来源AQP5多克隆抗体(美国Santa Cruz公司),二抗兔抗山羊二步法免疫组化试剂(北京中山公司),多聚赖氨酸(美国Sigma)
1.2 动物来源
新生24 h内SD大鼠由徐州医学院实验动物中心提供。
1.3 方法
1.3.1 星形胶质细胞的体外培养和鉴定
参照文献[1]创立的方法并加以改进。新生24 h内的SD大鼠断头取脑,分离出大脑皮质,经机械分离及化学消化,制成单细胞悬液,调整细胞密度种植于含血清DMEM培养基中;接种后每隔3 d换液,7~10 d后进行传代培养;在细胞传至第4代时制备细胞爬片,对细胞进行GFAP鉴定及进一步实验。
1.3.2 缺氧/复氧模型的建立
将第4代的细胞置入无菌培养皿中,3~5 d左右细胞生长至约80%以上融合后,弃去培养基,用无血清DMEM清洗2遍,置入通以缺氧混合气体(95%N2+5%CO2)约0.5 h左右彻底驱除其中所溶解的氧,放入37℃及32℃持续通以缺氧混合气的培养箱内进行缺氧,并开始记时,缺氧8 h后即刻将接入95%N2的接口断开,重新接入95%的空气复氧。对照组除用95%N2+5%CO2代替缺氧混合气体外,余方法完全同上。
1.3.3 分组
实验分为3组,即对照组:吸取旧的培养基换完全培养基放入通以37℃、5%CO2、95%空气的培养箱中培养,20h后取样测定相关指标;常温组:吸取旧的培养基换完全培养基放入37℃通以缺氧混合气体(95%N2+5%CO2)的培养箱内进行缺氧,于缺氧8 h后即刻将接入95%N2的接口断开,重新接入95%的空气复氧,按缺氧/复氧(H/R)的时间不同分为缺氧4h(H4/R0组)、缺氧8 h(H8/R0组)、缺氧8h/复氧后4、6、8、10、12 h(H8/R4、H8/R6、H8/R8、H8/R10和 H8/R12组),在相应时间点取样测定相关指标;亚低温组:吸取旧的培养基换完全培养基放入32℃通以缺氧混合气体的培养箱内进行缺氧,余操作、分组同前。
1.3.4 细胞存活能力的鉴定
从培养皿中取出一盖玻片,用巴氏吸管吸取0.4%台盼蓝溶液,直接滴于盖玻片,3 min后于镜下计算同一视野下着蓝色及不着色数量(着蓝色为死亡细胞,不着色为活细胞),按10倍镜下每个视野着色细胞数,共计5个视野,计算平均值。
1.3.5 用免疫细胞化学检测AQP5蛋白的表达水平
将各组的盖玻片在相应时间点按PowerVisionTM二步法进行免疫组化染色,用3%过氧化氢溶液孵育5 min,以阻断内源性过氧化物酶,一抗(浓度为1∶100)为山羊AQP5多克隆抗体 (美国Santa Cruz公司)室温下孵育60 min,按二步法免疫组化试剂盒(北京中山公司)说明书进行操作;DAB显色时间统一为3 min,显色后光镜观察。阴性对照用PBS代替一抗进行孵育。免疫组化的形态半定量方法:显微镜下(40×)细胞计数,选取中央视野及上下左右一个相邻视野,计阳性细胞数(总数不少于400个细胞);以平均每100个阳性中的强阳性细胞数作为每张盖玻片的数值。
1.3.6 统计学处理
应用SPSS13.0统计软件。所有数据均以均数±标准差(±s)表示,多组间比较采用单因素方差分析,组间两两比较采用LSD法,P<0.05有显著性差异。
2 结 果
2.1 星形胶质细胞培养的形态学观察与鉴定
分离的大鼠大脑皮层胶质细胞在种植后分散均匀,3~5 h后贴壁,光晕明显,4~5 d时细胞体积明显增大,长出胞突的细胞明显增多,8 d时已长满培养瓶瓶底,星形胶质细胞在底层互相连接成网状,传代培养的星形胶质细胞初级胞突较多较长,呈放射状多分枝;经原代培养传3代后GFAP免疫细胞化学染色鉴定星形胶质细胞胞,黄褐色为阳性反应;GFAP主要位于星形胶质细胞的胞浆和突起内,GFAP染色阳性的细胞形态不规则,突起粗大。本实验中95%以上为反应阳性的星形胶质细胞,符合实验要求。
2.2 不同缺氧/复氧时间点细胞形态学观察
缺氧4及8 h细胞形态学变化尚不明显,个别细胞变圆肿胀感,部分细胞边缘皱缩,复氧后随着时间的延长细胞变化逐渐明显,表现为细胞肿胀、变圆,突起增粗缩短,细胞间连接断裂,有的细胞呈纤维样改变,轮廓不清,甚至细胞脱落成悬浮状,大多数细胞出现分离现象。亚低温组在缺氧及复氧时各时间的病变程度要轻于常温组。
2.3 星形胶质细胞的生存力
缺氧/复氧模型组星形胶质细胞随缺氧/复氧时间的延长死亡细胞数逐渐增多,各时间点均明显高于对照组(P<0.05或0.01);亚低温组在各时间点的死亡细胞数均明显低于对照组(P<0.05或0.01)(表1)。
表1 不同缺氧/复氧时间点死亡细胞数(±s,个/每个100倍视野)

表1 不同缺氧/复氧时间点死亡细胞数(±s,个/每个100倍视野)
注:与常温组比较,*P<0.05,**P<0.01
组别 n死亡细胞数H4R0 H8R0 H8R4 H8R6 H8R8 H8R10 H8R12 33常温组 5 4.03±1.10 6.37±0.99 8.09±1.16 10.90±1.13 16.92±1.43 22.21±1.40 32.37±4.48亚低温组 5 2.94±0.33* 3.10±.71** 5.03±.65** 7.87±.32** 13.56±1.12** 18.64±4.43* 26.49±2.69对照组 5 - - - - - - 2.94±0.**
2.4 AQP5免疫细胞化学染色
各组AQP5蛋白在星形胶质细胞的胞浆及胞膜都有黄染的阳性细胞表达,缺氧/复氧模型组随缺氧时间的延长表达呈下降趋势,持续至复氧4 h后至最低,从复氧6 h开始增强,在复氧≤8 h两组缺氧/复氧模型组的表达水平均明显低于对照组(P<0.05或0.01),而至复氧后10、12 h两组AQP5蛋白表达水平均明显高于对照组(P<0.05或0.01),亚低温组在各时间点的表达水平均要明显低于常温组(P<0.05或0.01)(图1~6,表2)。

图1 常温组缺氧8 h(×100倍)
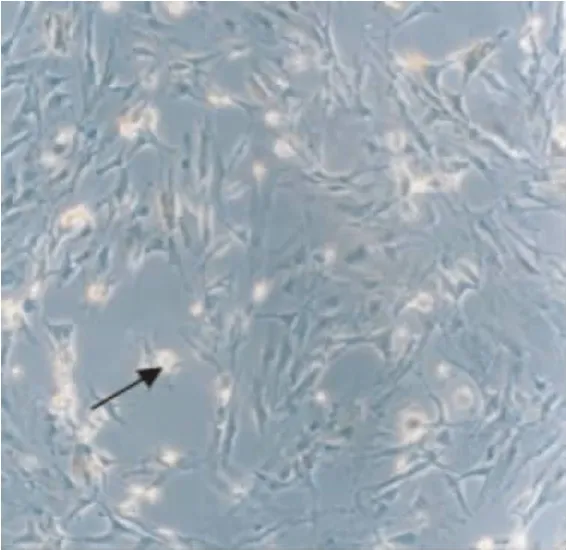
图2 常温组复氧8 h(×100倍)

图3 常温组复氧12 h(×100倍)

图4 亚低温组缺氧8 h(×100倍)

图5 亚低温组复氧8 h(×100倍)

图6 亚低温组复氧12 h(×100倍)
3 讨 论
水通道蛋白(aquaporin,AQP)是一种对水具有选择性通透功能的膜通道蛋白家族,与晶状体的主体内在蛋白(MIP)具有同源性。目前已发现有13种水通道蛋白,即AQP0~AQP12,它们的分布具有相对的组织特异性。大脑中主要含有AQP1、AQP4和AQP5,AQP1分布于脑脉络丛上皮细胞,而AQP4、AQP5和AQP9在星形胶质细胞和室管膜细胞上表达丰富[2]。目前已有大量研究认为AQP4与脑水肿的形成发展密切相关。目前有关AQP5与脑水肿形成的关系报道较少,Yamamoto等发现在缺氧情况下培养的星形胶质细胞上AQP5的表达降低,而在复氧后AQP5的表达升高达3倍,复氧20h后其表达又趋于下降[3],提示AQP5参与了缺血性脑水肿的形成。
表2 不同缺氧/复氧时间点Aqp5染色阳性细胞数(±s,个/每个100倍视野)

表2 不同缺氧/复氧时间点Aqp5染色阳性细胞数(±s,个/每个100倍视野)
注:与常温组比较,*P<0.05,**P<0.01
组别 n Aqp5染色阳性细胞数H4R0 H8R0 H8R4 H8R6 H8R8 H8R10 H8R12 89常温组 5 18.10±1.29 13.7±1.25 9.8±1.32 14.5±1.08 20.2±1.14 24.7±1.34 33.7±3.16亚低温组 5 15.50±1.96* 11.40±1.08*8.4±0.84* 12.4±0.70** 17.60±1.84* 20.7±2.16** 28.9±4.43对照组 5 - - - - - - 20.6±3.*
星形胶质细胞是中枢神经系统数量最多的细胞,是构成血脑屏障的主要成分,它对脑水肿有重要影响。超微结构显示在脑水肿早期主要表现为星形胶质细胞肿胀,它可能是脑水肿发生发展过程中的一个重要因素。星形胶质细胞的缺氧、复氧过程与脑缺血再灌注损伤的病理过程相似,因此研究星形胶质细胞的在缺氧/复氧过程中的病理、生理变化对于研究缺血性脑水肿形成、变化有着重要的意义。
本研究发现,在星形胶质细胞缺氧及复氧早期AQP5的表达降低,复氧后随着时间延长出现AQP5表达明显升高。在缺血性脑水肿早期主要是以细胞毒性水肿为主要机制,如果缺氧时间短暂,细胞毒性水肿往往是可逆的。AQP5蛋白在缺氧早期的表达减少,有利于保护星形胶质细胞,从而在缺血早期发挥神经保护作用。缺血缺氧可能通过激活PKA而减少AQP5的表达[4]。缺血缺氧损伤导致线粒体能量代谢障碍,亦可能直接引起水通道能量衰竭导致AQP5的减少。因而,此种情况下AQP5的表达减少,可以减轻星形胶质细胞的水肿而起到保护作用。本实验在复氧后10、12hAQP5蛋白表达明显增高,可能是星形胶质细胞离子泵功能衰竭,大量的Na+、Ca2+以及谷氨酸进入细胞内使细胞内外渗透压改变,激活了细胞膜外的渗透压感受器使AQP5表达增多,水通道开放,大量水分子流入细胞内形成水肿。
亚低温(31~35℃)具有缓解细胞内酸中毒、减轻脑水肿、抑制白三烯B4生成、减轻脑损伤后细胞毒性作用及防止血脑屏障通透性改变等作用[5]。但其确切调节机制尚不完全清楚。李晓宾等用亚低温对大鼠出血性脑水肿的模型进行干预发现,亚低温可能通过下调脑内AQP4的表达而抑制出血性脑水肿[6]。
本实验结果发现,缺氧≤8h细胞形态变化不明显,随着复氧时间的延长,可见活化逐渐明显,死亡细胞数逐渐增高,32℃亚低温干预后各时间点细胞病变的程度要轻于常温组而死亡细胞数明显低于常温组,说明缺氧、复氧造成了星形胶质细胞的损伤,而亚低温能减轻缺氧造成的星形胶质细胞损伤。本实验亚低温组与常温组相比,在各时间点AQP5表达亦明显降低,提示亚低温可能通过降低星形胶质细胞膜上AQP5的表达,减少由经胶质细胞膜进入细胞内的水含量,抑制细胞毒性脑水肿。如将亚低温及AQP5抑制剂联合应用是否可以有效地控制脑水肿,将可能成为治疗缺血性脑水肿新的突破。
1 Mc Carthy K and Vellis JD.Preparation of separate astroglial and oligodendroglial cell cultures from rat cerebral tissue.Cell Biol,1980,85:890-902.
2 Badaut J,Lasbennes F,Magistretti PJ,et al.Aquaporins in brain:distribution,physiology,and pathophysiology.Cereb Blood Flow Metab,2002,22(4):367-378.
3 Yamamoto N,Yoneda K,Asai K,et al.Alterations in the expression of the AQPfamily in cultured rat astrocytes during hypoxia and reoxygenation.Brain Res Mol,2001,90(1):26-38.
4 Yamamoto N,Sobue K,Fujita M,et al.Differential regulation of aquaporin-5 and -9 expression in astrocytes by protein kinase A..Brain Res Mol Brain Res,2002,104(1):96-102.
5 Den HH,Van DWB,Van GM,et a1.Therapeutic hypothermia in acute ischemic stroke.Expert Rev Neurother,2007,7(2):155-164.
6 李晓宾,董瑞国,程广军,等.亚低温对实验性脑出血后水通道蛋白4表达及脑水肿的影响.临床神经病学杂志,2006,19(2):115-117.
