具有大孔介孔结构的磷酸钛的合成及溶菌酶吸附
2012-10-13邢向英任铁真
李 霞,邢向英,任铁真
(河北工业大学 化工学院,天津 300130)
生物大分子的吸附和固载在生物、医药、生态学和食品工业方面具有广泛的应用前景[1],许多多孔材料用来蛋白质吸附[2-7].
溶菌酶(Lysozyme)是一个椭球型的蛋白质分子包括了两个特征性的截面:其中的横截面的面积约为3.0×4.5 nm2,纵截面的面积约为3.0×3.0 nm2[8,9].由于溶菌酶的简单结构特征,目前介孔材料吸附溶菌酶的研究备受关注[2-4].Vinu[2]曾系统的考察过不同的介孔氧化硅材料对溶菌酶的吸附性能,A lSBA-15在等电点处的最大吸附量为47.2mol/g,比表面积为1 000 m2/g的MCM-41在等电点处的最大吸附量为28.1.而介孔磷酸铝和多孔炭材料吸附溶菌酶的报道显示,介孔磷酸铝的吸附量仅为11,介孔炭材料的为22[4-6].在众多介孔材料中,磷酸钛对溶菌酶的吸附研究较少,而介孔磷酸钛因稳定性高、生物友好等优点,更适合生物大分子的吸附、运载和固化.
最近,人们使用阴离子表面活性剂,阳离子表面活性剂,烷基铵,嵌段共聚物等作为模板剂合成出了类分子筛微孔磷酸钛[10],介孔磷酸钛等材料[11-15].尽管使用表面活性剂模板,聚合物模板,生物模板或无模板自组装等方法可以合成出具有多级孔道结构介孔磷酸钛,但是设计和合成出具有大孔-介孔结构的磷酸钛材料仍然具有很大的困难.在介孔材料中引入大孔结构,对于那些扩散速率低的大分子反应(如高分子、生物分子)或粘性体系尤其重要,且大孔和介孔要很好的相互贯通,以更大的提高材料的性能.本文采用混合表面活性剂合成了大孔-介孔结构的磷酸钛材料,在表面活性剂存在下的油/水混合体系可以形成微乳泡,在微乳泡外围氧化物先驱体与表面活性剂作用组成介孔结构的骨架墙,所得固体产物经焙烧去除表面活性剂等有机组分后即生成大孔-介孔复合结构材料[16],并考察了合成材料对溶菌酶的吸附性能,经测定表明溶菌酶以无规则排列的单层吸附形式为主,合成的材料是一种很好的吸附剂.
1 实验部分
1.1 大孔-介孔磷酸钛的制备
将一定物质的量之比的十六烷基三甲基溴化铵(CTAB) 和烷基酚聚氧乙烯醚(OP-10)混合物溶于乙醇溶剂中,60℃下搅拌一定的时间,然后加入磷酸,同温度下搅拌30 m in,最后向混合物中滴加钛酸四丁酯,得到白色的凝胶,混合物物质的量之比大约为0.02OP-10∶0.1CTAB∶1TBOT∶1H3PO4∶100C2H5OH,搅拌3h后,将混合物转入带有聚四氟乙烯内衬的不锈钢反应釜内,放入90℃的恒温干燥箱内老化两天,两天后把混合物取出过滤,60℃恒温干燥箱内干燥,在马弗炉内程序升温到500℃焙烧4 h,收集样品TiP01.改变溶剂, (C2H5OH)∶ (H2O)=1∶2,其它步骤同上,合成的样品标记为TiP02.
1.2 表征
采用日本理学Rigaku D/Max 2500型X射线衍射仪分析催化剂的物相结构,CuK辐射,管电压40 kV,管电流100mA.FT-IR数据由瑞士Bruker公司VECTOR22型傅立叶红外光谱仪所得;仪器分辩率为4 cm1;扫描速度:0.2 cm s1;波数范围:400~4000 cm1.试样制备采用KBr压片法.N2吸附数据采用国康塔仪器公司生产的NOVA2000e高速比表面和孔隙度仪进行测定,N2为吸附质,吸附温度为液氮温度,比表面用BET方程进行计算.TEM分析采用PhilipsTECNAIG20型透射电镜TEM加速电压200 kV点分辨率0.2nm.SEM分析是在JSM-6700F扫描电镜上观察产物形貌,工作电压为20 kV.将制得的粉末样品用导电胶固定在金属片上进行测试.
1.3 溶菌酶吸附
通过把不同量的溶菌酶加入到25mol/L缓冲溶液(pH=6.5的磷酸钾缓冲溶液和pH=9.6的碳酸钠缓冲溶液)中,配置一系列浓度从20~280mol/L的溶菌酶标准溶液.每一次吸附实验按如下步骤进行:50mg不同的磷酸钛材料吸附剂分散在10m L不同浓度的溶菌酶标准液中,最终的混合物在293K搅拌直到吸附达到平衡(24 h).溶菌酶的吸附量由标准溶液的量减去吸附后溶液中剩下的量来计算.溶菌酶的UV吸附在,在进行UV-Vis分析前离心分离,取上层清液以避免分散的悬浮小颗粒对结果的影响.
2 结果与讨论
2.1 磷酸钛的结构和性质表征
图1是样品TiP01和TiP02的广角X-射线衍射谱图,从图上可以明显的看出两个样品具有相似结构,在15°~40°处有一个宽峰,说明合成样品主要为无定形非晶态形式.
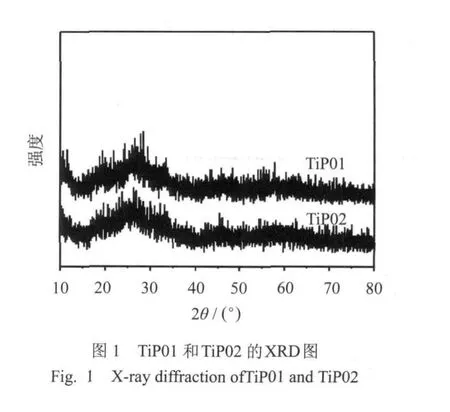
图2是样品TiP01和TiP02的SEM图和TEM图.图2a,b是合成样品TiP01的SEM图,从图中可以看出TiP01是由不规则的纳米颗粒聚集而成,颗粒大小大约几百个纳米,为介孔结构并没有大孔的存在.改变合成的溶剂,钛酸四丁酯在有表面活性剂存在下的油/水混合体系形成的微乳泡外围水解,组成介孔结构的骨架墙,所得固体产物经焙烧去除表面活性剂等有机组分后即生成大孔-介孔复合结构材料.图2c,d是TiP02的SEM图,从图中可以看出TiP02具有孔径1~2m的大孔结构存在,大孔孔道呈一维平行排列,大孔孔墙是由许多相互连接的球形小粒子组成的,它们之间的相互堆积和聚集又进一步形成了大孔孔墙之间的几百个纳米大小的孔道.图2 e,f是合成样品TiP01的TEM图,从图中可以看出钛酸四丁酯醇解的过程中形成了蠕虫状的纳米孔,纳米颗粒的聚集形成了介孔,孔径大约为5 nm.图2h,g为TiP02的TEM图,图中显示TiP02大孔孔墙是由氧化钛纳米颗粒堆积组成的,它们之间有蠕虫状的介孔结构,孔径大约为6 nm,还有一些10 nm左右的大孔,这种蠕虫状的介孔结构是有纳米粒子之间有组织的聚集和堆积构成[17].XRD和SEM分析显示,合成体系中水的加入对样品孔结构有明显的作用,是制备大孔结构磷酸钛的关键.但是,对样品的无定形结构没有影响.
2.2 溶菌酶吸附性能研究
在不同的pH下,介孔磷酸钛吸附缓冲溶液中的溶菌酶,吸附量与溶液的pH,孔容和吸附剂的成分都有一定关系,最大的吸附量在等电点处(p I=11),图3是TiP01在不同pH下的等温线,从图中可以看出,初始吸附量呈直线上升,最终在较高的平衡浓度时出现吸附平台.溶菌酶和吸附剂之间表现了很强的吸附力,这些等温线符合典型的朗缪尔单层吸附,单层吸附容量可以通过吸附等温式计算得出
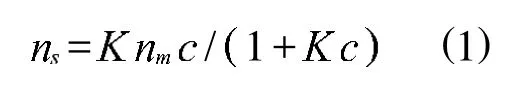

关于溶菌酶的吸附机理,主要从3个方面来讨论,大于等电点,等于等电点,小于等电点,溶菌酶在低于等电点(在适当的酸碱度时,氨基酸的氨基和羧基的解离度基本相等,正离子等于负离子,净电荷为零,这时溶液的pH值称为该溶液的等电点)pHlt;11,溶菌酶带正电荷,高于等电点时带负电荷,溶菌酶带负电荷.在溶菌酶的吸附方面,疏水作用和静电作用都是重要的作用力.在等电点处溶菌酶的净电荷为零,溶菌酶分子之间的排斥力达到最低,另外疏水作用相对于静电作用在等电点处更占优势,因此在等电点处溶菌酶的吸附达到了最大,最大吸附量为25.94mol/g.随着pH从11降到6.5,溶菌酶的正电荷开始增加,溶菌酶分子之间排斥作用增大,分子面积变大,占据了更大的空间,因此溶菌酶和吸附剂之间的静电作用力有所降低,从而吸附量降低.所以,在pH低于等电点时,单层吸附容量低于在等电点时的吸附容量.当溶液的pH=12时,溶菌酶分子的表面带负电荷,蛋白质分子之间静电排斥作用力增加了,同理,这吸附容量也降低了.通过上面的分析,我们得出,在等电点处疏水作用相对于静电作用更占优势,然而,在低于等电点和高于等电点处,对于蛋白质吸附在吸附剂上,静电作用力更占优势.
图4为两种不同孔径的磷酸钛材料在pH=11缓冲溶液中的溶菌酶吸附曲线,在平衡浓度范围内,不同的吸附剂有不同的吸附能力,顺序为:TiP01gt;TiP02,最大吸附量分别为25.94mol/g和21.07mol/g.对于TiP01而言,它具有比较大的比表面积,有更多的活性中心,有利于溶菌酶分子分散在吸附剂的表面,由于溶菌酶吸附为单层吸附,较大的比表面积对于溶菌酶在氧化钛材料表面的吸附尤为重要,TiP01具有比TiP02更大的比表面积,所以它的吸附能力更强一些.虽然TiP02相对于TiP01的比表面积降低了很多,TiP02的大孔有利于溶菌酶分子进入孔内并在其中进行分散从而覆盖所有的表面,所以吸附量降低的并不是很多,因此影响吸附的因素不仅与比表面积有关,还与材料的自身的性质、成分及形貌有关.
图5为样品傅立叶红外谱分析图谱,3 400 cm1和1 630 cm1处的振动峰可以归属于表面羟基和表面吸附水的伸缩振动峰.未焙烧前得FT-IR图,从图中可以看出2 922 cm1和2 850 cm1处的特征峰是有亚甲基中的C-CH2伸缩振动产生的,而1463 cm1和1 363 cm1是有表面活性剂中的C-H键的伸缩振动峰,另外,1712 cm1的振动峰是有OP-10中的芳环所引起的.在红外谱图中,低频段的400~790 cm1的峰是典型的Ti-O-Ti的骨架振动峰[18].500℃焙烧后,C-H键特征峰的消失,表明了表面活性剂通过焙烧后被完全去除.在~1040 cm1处较强的振动峰,归属于,或者Ti-O-P的骨架振动的特征峰[20],Vasylvev等人[21]通过对磷酸钛材料的FT-IR研究发现,在1 026 cm1处可以观测到新的振动峰,此处的峰位归属于具有树枝状的磷酸根与钛相连形成的P O T i骨架振动.而Bhaum ik和Inagaki[12]认为在1 000~1 050 cm1的振动峰主要是由Ti-O-P骨架振动所致.吸附溶菌酶后(图5 c),溶菌酶分子的特征峰可以被全部观测到.1650 cm1为氨基化合物的C=O伸缩振动峰.1 530 cm1为N H和C N的弯曲振动和伸缩振动[22].1 430 cm1和1 363 cm1可以归属为氨基酸链上的脂肪族的CH2和CH3振动模式.1 225 cm-1归属于氨基酸 -层的贡献[22-24].红外分析显示,溶菌酶分子的基本氨基酸序列没有变化,说明磷酸钛对溶菌酶的吸附没有引起蛋白质的变性.
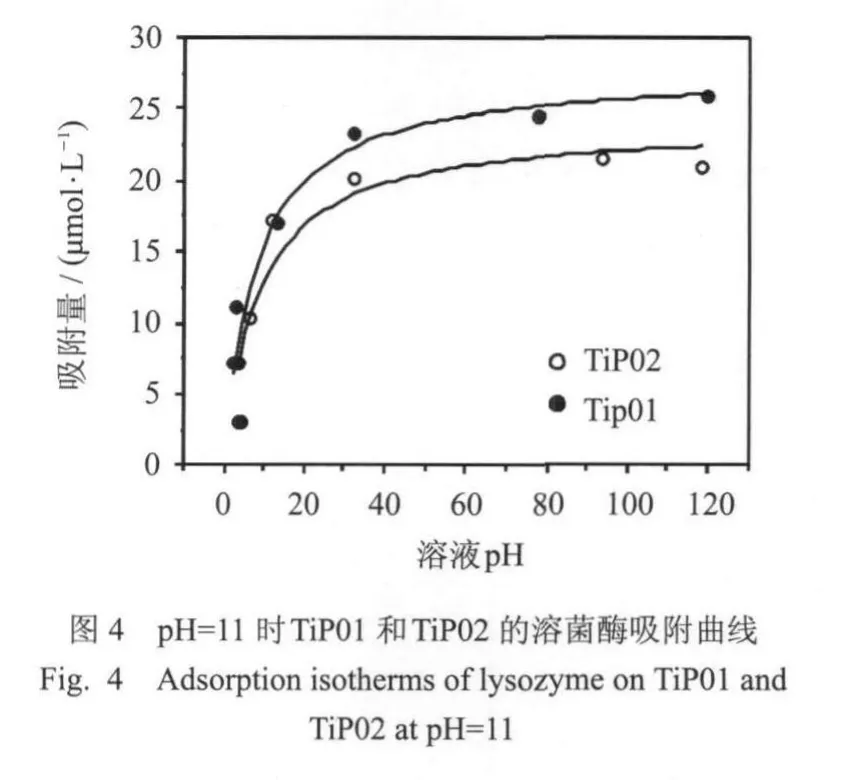
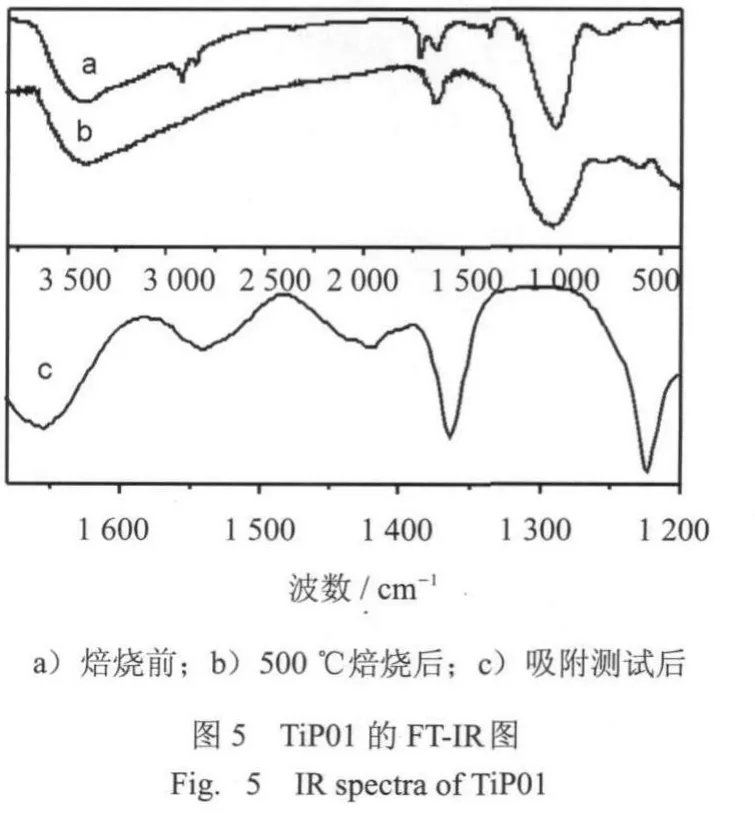
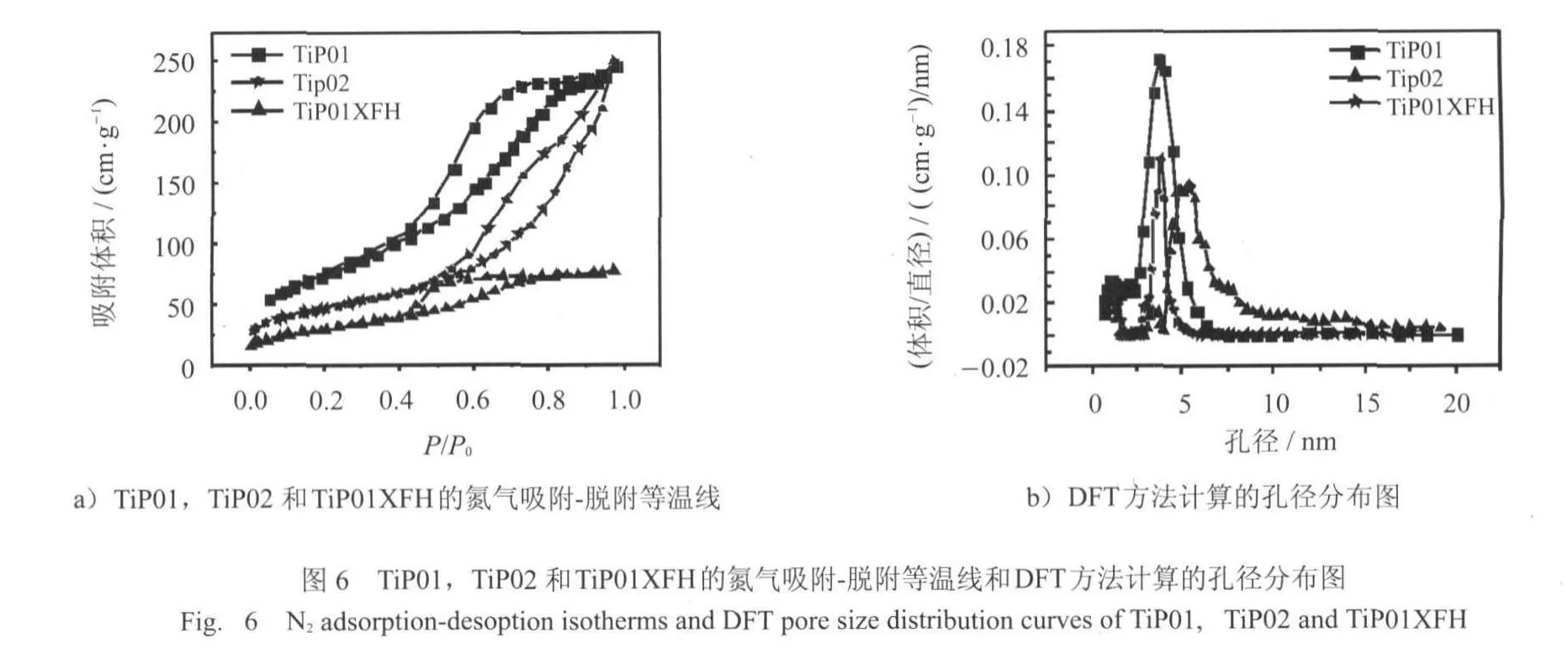
图6是对合成的样品TiP01,TiP02和TiP01XFH进行氮气吸附-脱附等温线和DFT法计算得到的孔径分布图.根据国际纯粹和应用化学学会(IUPAC)的分类.从吸附等温线可以看出,所得的所有样品的等温线均属于IV型吸附等温曲线,表明材料具有典型的介孔结构,TiP01的比表面积为272 m2/g,而TiP02的比表面积为162 m2/g,从吸附等温线上可以直接看出TiP02的比表面积相对于TiP01有所降低.在对应的孔径分布图上可以看出TiP01的孔径3.7 nm,孔容为0.359 cm3/g,而TiP02的孔径为5.4nm,孔容为0.388 cm3/g,TiP02的孔径相对于TiP01的孔径有所增加,还有一部分10nm以上的孔.样品TiP01吸附溶菌酶后吸附脱附等温线上的可以看出明显的滞后环,所以吸附溶菌酶后TiP01样品的介孔结构仍然存在,说明溶菌酶吸附并没有影响样品的介孔结构,但比表面面积降低了很多,吸附前的比表面积为272m2/g,吸附后的比表面积为109m2/g,比表面积降低了163m2/g,孔容为0.109 cm3/g,孔径保持4 nm左右.
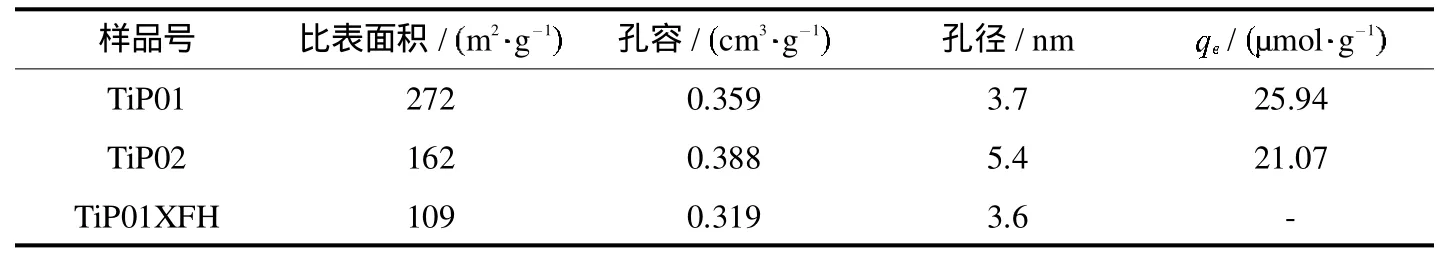
表1 合成样品的各项结构参数Tab.1 Texturalpropertiesof the synthesized samples
目前,文献中报道的介孔氧化硅、多孔碳等材料,其比表面积均远远大于磷酸钛材料,但是,对溶菌酶的吸附能力却与磷酸钛材料相近[2-6],表明对蛋白质吸附材料的选取,应当在考虑比表面积和孔径大小的同时,注意材料的生物友好性.同时,结合TiP01吸附前后比表面的减少163 m2/g,根据溶菌酶的特定分子结构和三维尺度,吸附量相对应的比表面积可以由方程得到.其中分别带入溶菌酶的横截面积和纵截面积,n为阿伏加德罗常数6.02×1023).因此,吸附量对应的面积为140~210m2/g(TiP01),表明溶菌酶分子在吸附剂表面为单层吸附无规则方式的排列,计算结果与测试结果基本一致.
3 结论
利用CTAB和OP-10混合模板体系,在水热条件下制备出大孔-介孔结构磷酸钛和介孔磷酸钛氧化物,在乙醇溶剂的条件下合成的介孔磷酸钛TiP01,比表面积可以达到272 m2/g,通过氮气吸附等温线可以看出为介孔材料.通过改变溶剂,合成出大孔-介孔磷酸钛TiP02,由SEM图可以看出大孔孔径为1~2 m.对合成的材料进行溶菌酶吸附性能测试,在平衡吸附浓度范围内,最大的吸附量发生在等电点处,在等电点处TiP01溶菌酶的最大吸附量为25.94mol/g,TiP02的最大吸附量为21.07mol/g,在溶菌酶的等电处,氨基酸残基之间的库伦排斥力最小,溶菌酶分子之间紧密堆积,从而体积最小,有利于吸附剂的吸附.通过比较不同孔径的介孔磷修饰的氧化钛材料对溶菌酶的吸附曲线,可以看出,吸附剂的比表面积越大越有利于溶菌酶吸附,吸附剂的吸附能力就越大.
[1]HorbettTA,Brash JL,Book R.Proteinsat Interfaces II:Fundamentalsand Applications[M].Washington DC:American ChemicalSociety,1995.
[2]Vinu A,Murugesan V,Hartmann M.Adsorption of lysozyme overmesoporousmolecular sieves MCM-41 and SBA-15:influence of pH and alum inum incorporation[J].Phys Chem B,2004,108:7323-7330.
[3]Qiao SZ,Djojoputro H,Hu QH,etal.Synthesisand lysozymeadsorption of rod-like large-pore periodicmesoporousorganosilica[J].Progress in Solid State Chemistry,2006,34:249-256.
[4]Vinu A,M iyahara M,Ariga K.Biomaterial immobilization in nanoporous carbonmolecular sieves:influence of solution pH,pore volume,and pore diameter[J].PhysChem B,2005,109:6436-6441.
[5]Vinu A,Hossain K Z,KumarGS,etal.Adsorption of L-histidineovermesoporouscarbonmolecularsieves[J].Carbon,2006,44:530-536.
[6]Ma TY,Zhang X J,Yuan ZY.Hierarchicalmeso-/macroporousaluminum phosphonatehybridmaterialsasmultifunctionaladsorbents[J].Phys Chem C,2009,113:12854-12862.
[7]Vinu A,Murugesan V,Tangermann O,etal.Adsorptionof cytochrome c onmesoporousmolecularsieves:influenceofpH,porediameter,and alum inum incorporation[J].Chem Mater,2004,16:3056-3065.
[8]Handler JS,ButcherRW,Sutherland EW,etal.Theeffectofvasopressinand of theophyllineon theconcentrationofadenosine3’,5’-phosphate in theurinary bladderof the toad[J].Journalof BiologicalChemistry,1965,240(11):4524-4526.
[9]Kharakoz D P,Sarvazyan A P,Sarvazyan.Hydrationaland intrinsic compressibilitiesof globular proteins[J].Biopolymers,1993,33:11-26.
[10]Ekambaram S,Sevov SC.Organically templatedm ixed-valent TiIII/TiIV phosphatew ith an octahedral-tetrahedralopen framework[J].Angew Chem IntEd Engl,1999,38:372-375.
[11]Jones D J,Aptel G,brandhorstM,et al.High surface areamesoporous titanium phosphate:synthesis and surface acidity determ ination[J].Mater Chem,2000,10:1957-1963.
[12]Bhaum ik A,InagakiS.Mesoporous titanium phosphatemolecularsieveswith ion-exchange capacity[J].Am Chem Soc,2001,123:691-696.
[13]Pan C L,Zhang W X.Synthesis ofmesoporous titanium phosphate w ith high surface area using long-chain alkylam ine[J].Materials Letters,2003,57:3815-3819.
[14]Pan C L,Yuan S.A neutral templating route to mesoporous titanium phosphatemolecular sievesw ith enhanced thermal stability[J].Applied Catalysis A:General,2006,312:186-193.
[15]Li X S,Courtney A R,YantaseeW,et al.Templated synthesis ofmesoporous titanium phosphates for the sequestration of radionuclides[J].Inorganic Chem istry Communications,2006,9:293-295.
[16]Carn F,Colin A,Achard M F,etal.Inorganicmonolithshierarchically textured via concentrated directemulsion andm icellar templates[J].J Mater Chem,2004,14:1370-1376.
[17]Yuan ZY,Ren TZ,AziouneA,etal.Self-assembly ofhierarchicallymesoporous-macroporousphosphated nanocrystallinealum inum(oxyhydr)oxidematerials[J].Chem Mater,2006,18:1753-1767.
[18]LouisA,SanchezC.Synthesisand characterizationofmesostructured titania-basedmaterials throughevaporation-induced self-assembly[J].Chem Mater,2002,14:750-759.
[19]Samantaray SK,Parida K.Effectof phosphate ion on the textural and catalytic activity of titania–silicam ixed oxide[J].Applied Catalysis A:General,2001,220:9-20.
[20]Mukhopadhyay SM,Garofalini SH.Surface studies of TiO2-SiO2glasses by X-ray photoelectron spectroscopy[J].Non-Cryst Solids,1990,126:202-208.
[21]Vasylyev M V,Wachtel E J,Popovitz-Biro R,etal.Titanium phosphonate porousmaterials constructed from dendritic tetraphosphonates[J].Chem Eur J,2006,12:3507-3514.
[22]HammondW,ProuzetE,MahantiSD,etal.Structure factor for the periodicwallsofmesoporousMCM-41molecular sieves[J].M icroporous MesoporousMater,1999,27:19-25.
[23]AdamsS,HigginsAM,JonesRA L.Surface-mediated foldingandmisfoldingofproteinsatlipid/water Interfaces[J].Langmuir,2002,18:4854-4861.
[24]NiFu F,DeOliveira D B,TrumbleW R,etal.Secondary structureestimation of proteinsusing the am ide IIIregion of fourier transform infrared spectroscopy:application to analyze calcium-binding-induced structuralchanges in calsequestrin[J].ApplSpectrosc,1994,48:1432-1441.
