急性染铅对大鼠海马CREB、c-FOS蛋白表达的影响*
2012-09-27包翠芬宋慧娟张尤新
包翠芬,赵 艳,宋慧娟,张尤新
(辽宁医学院:1.科学实验中心;2.基础学院生物化学教研室,辽宁锦州121001)
重金属铅具有较强的神经亲和性,研究表明,铅暴露可导致儿童学习记忆认知能力改变及智力障碍。钙-钙调蛋白依赖的蛋白激酶Ⅱ(Ca2+/Calmodulin dependent protein kinaseⅡ,CaMKⅡ)信号通路在学习记忆方面发挥着重要作用,急性铅中毒可能通过抑制该通路中CaMKⅡ活性从而影响下游信号分子,造成对学习记忆功能的损伤,但是其机制目前还不完全清楚[1-4]。本实验通过使用CaMKⅡ的激活剂、抑制剂及铅对大鼠海马脑片进行处理,通过检测其下游信号分子cAMP反应元件结合蛋白质(CRE binding protein,CREB)、c-FOS的表达来探明急性染铅对Ca2+/CaM-CaMKⅡ 信号转导通路的影响,进一步探讨CaMKⅡ是否在大鼠海马急性铅中毒中的信号转导具有开关作用,以阐明铅对学习记忆影响的分子机制。
1 材料与方法
1.1 材料 健康SD大鼠,生后30d,雌雄各半(由辽宁医学院实验动物中心提供),动物合格证号:SYXK(辽)2003-0011;兔抗大鼠CREB、c-FOS多克隆抗体,购于Cell Signaling公司;辣根过氧化酶标记的山羊抗兔二抗,购于北京中山金桥公司;醋酸铅购于沈阳化学试剂厂;PowerPac 3000电泳仪(美国Bio-Rad公司);Trans-blot SD半干转膜仪(美国 Bio-Rad公司);其余试剂由辽宁医学院科学实验中心提供。
1.2 方法
1.2.1 培养脑片样品制备 取生后30d大鼠,颈脱臼处死后迅速取出大脑海马,放入4℃的人工脑脊液(ACSF)内,将其横切为350μm左右的脑片,于六孔培养板中培养。培养过程中连续通入流速1mL/min的混合气体(95%O2+5%CO2),温度32.5~33.5℃[5]。
1.2.2 急性染铅样品制备 上述样品稳定培养2h后,分为对照组(n=5)和染铅组(n=35):染铅组加入20μmol/L醋酸铅,分别于注入0、3、7.5、15、30、60、120min收集脑片,对照组继续采用ACSF培养并与染铅组同时收集脑片[5-6]。
1.2.3 CaMKⅡ的激活剂、抑制剂及铅处理样品制备 上述样品稳定培养2h后,更换培养液,按培养液的种类分为4组(n=5),(1)对照组:ACSF液;(2)激活剂组:含谷氨酸的 A CSF液(谷氨酸终浓度为5μmol/L);(3)抑制剂组:含 K N-93的ACSF液(KN-93终浓度为100μmol/L);(4)染铅组:含谷氨酸及醋酸铅的ACSF液(谷氨酸、醋酸铅终浓度分别为5、20 μmol/L)。继续培养30min后收集脑片[5]。
表1 改变CaMKⅡ活性对CREB、c-FOS活性及表达的影响(±s,n=3)
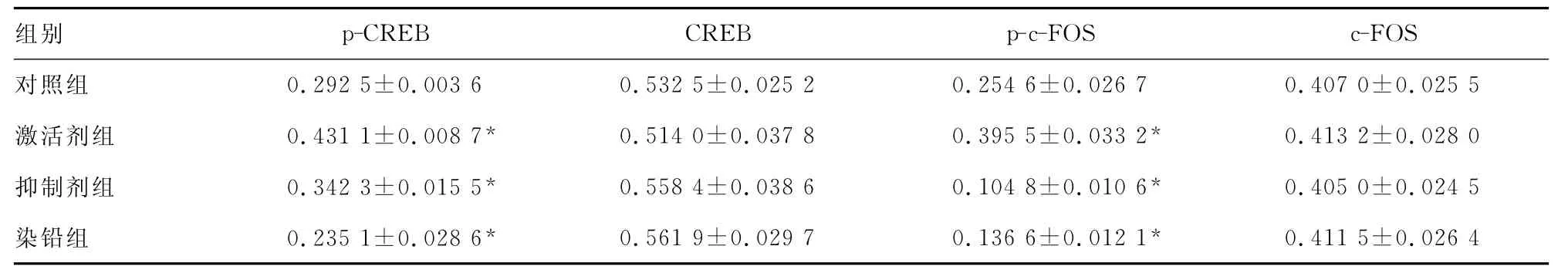
表1 改变CaMKⅡ活性对CREB、c-FOS活性及表达的影响(±s,n=3)
*:P<0.05,与对照组比较。
组别 p-CREB CREB p-c-FOS c-FOS对照组 0.292 5±0.003 6 0.532 5±0.025 2 0.254 6±0.026 70.407 0±0.025 5激活剂组 0.431 1±0.008 7* 0.514 0±0.037 8 0.395 5±0.033 2* 0.413 2±0.028 0抑制剂组 0.342 3±0.015 5* 0.558 4±0.038 6 0.104 8±0.010 6* 0.405 0±0.024 5染铅组 0.235 1±0.028 6* 0.561 9±0.029 7 0.136 6±0.012 1*0.411 5±0.026 4
1.2.4 免疫印迹法测定CREB、c-FOS的活性 将收集的海马脑片样品立即放入4℃裂解缓冲液中,静止0.5h后超声粉碎组织,12 000r/min,4℃离心20min,取上清液。采用二喹啉甲酸法测定蛋白含量;按所测浓度稀释样品。取适量稀释后样品加入电泳槽进行电泳,转膜,半干转印,5%脱脂奶粉封闭后。分别加入一抗(兔抗大鼠磷酸化及非磷酸化CREB、c-FOS抗体,稀释度为1∶1 000)4℃过夜;TBST缓冲液洗脱后加入辣根过氧化物酶标记的羊抗兔IgG抗体孵育1h,TBST缓冲液洗脱;ECL发光显色。采用β-actin作为内参。扫描电泳条带,采用UVP软件测定蛋白目的条带的灰度值。待测蛋白质含量=目的条带灰度/内参条带灰度。
1.2.5 统计学处理 以SPSS 13.0软件统计对实验数据经内参校正后进行方差分析。所有数据均以±s表示,以P<0.05为差异有统计学意义。
2 结 果
2.1 急性染铅对大鼠海马脑片CREB、c-FOS活性的影响免疫印迹结果显示,采用内参校正后,对照组CREB、c-FOS活性随时间延长无显著性变化;而染铅组CREB、c-FOS活性随时间延长呈显著性降低趋势,见图1。
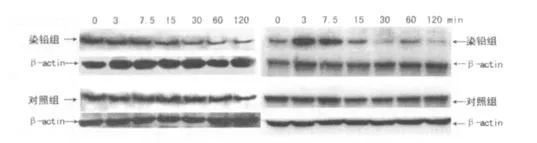
图1 急性染铅对大鼠海马CREB、c-FOS活性的影响
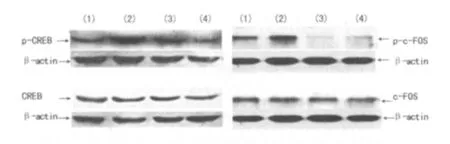
图2 Western blot测定CREB、c-FOS活性及表达
2.2 谷氨酸、KN-93、铅对CREB、c-FOS表达的影响 谷氨酸通过活化CaMKⅡ蛋白使磷酸化CREB、c-FOS的活性分别增强了47%、54%,而对非磷酸化CREB、c-FOS的表达无显著性影响;采用 KN-93抑制CaMKⅡ的活性使CREB、c-FOS活性分别降低了20%~59%,而对总量CREB的表达无显著性影响;铅能够拮抗谷氨酸的作用,使谷氨酸诱导的CREB、c-FOS活性升高分别降低了45%~47%,而对总量CREB表达无显著性影响,见表1、图2。
3 讨 论
环境中的铅是影响婴幼儿智力发育、儿童学习记忆功能的神经毒性物质之一,铅中毒的作用机制研究一直是防治铅中毒领域的热点问题。目前研究表明,突触传递在学习记忆过程中发挥着重要的作用,而某些蛋白激酶参与了突触传递过程。其中Ca2+/CaM-CaMKⅡ是突触后传递的主要通路之一。当大脑海马CA1区受到强烈刺激后,立即传导至神经使树突的谷氨酸受体激活,进而使与谷氨酸受体偶联的Ca2+通道开放,引发Ca2+内流及谷氨酸的释放,导致胞内Ca2+浓度升高,使CaMKⅡ的Thr-286磷酸化导致其被激活。这种磷酸化能够使其在细胞内Ca2+浓度下降的情况下仍然保持活性,此活化过程被认为是学习记忆的分子基础[7-8]。本研究采用体外应用激活剂(谷氨酸)和抑制剂(KN-93)以改变培养脑片中CaMKⅡ活性,同时采用醋酸铅处理脑片,以观察其对下游信号分子活性的影响[9]。
研究表明,CREB和c-FOS是 Ca2+/CaM-CaMKⅡ下游通路的重要因子。当突触活化产生的Ca2+内流激活腺苷酸环化酶,催化ATP合成cAMP,进一步激活蛋白激酶A,使其催化亚基进入核内促使CREB磷酸化,形成二聚体与cAMP反应元件结合,活化下游分子。而c-FOS作为第三信使,通过激活异源二聚体激活蛋白-1的结合位点从而完成CREB下游因子的信号转导[10-13]。本研究结果显示,大鼠海马脑片培养时,激活剂组活化的CREB、c-FOS表达量与对照组比较显著增强,而抑制剂组及染铅组活化的CREB、c-FOS的表达则显著降低,此结果提示急性铅中毒对Ca2+/CaM-CaMKⅡ信号转导通路的影响可能通过抑制CaMKⅡ的活性,影响某些蛋白激酶的激活状态,从而降低下游信号分子CREB、c-FOS的磷酸化水平,改变CREB、c-FOS调节基因转录的能力,干扰基因表达和蛋白质的合成,导致学习记忆功能障碍[14]。研究表明,Ca2+/CaM-CaMKⅡ通路在铅中毒导致学习记忆损伤中发挥着重要的作用,可能作为开启和关闭下游信号转导通路的靶点,对该通路的深入研究可能为揭示铅神经毒机制提出新的思路,为防治铅中毒提供新的理论依据和线索。
[1] Kahn MS,Kranjac D,Alonzo CA,et al.Prolonged elevation in hippocampal Aβand cognitive deficits following repeated endotoxin exposure in the mouse[J].Behav Brain Res,2012,229(1):176-184.
[2] 张尤新,叶丽平,包翠芬,等.急性染铅对大鼠海马Ca2+-CaMKⅡ信号通路影响[J].中国公共卫生,2010,26(9):1154-1156
[3] Flora SJ,Gautam P,Kushwaha P.Lead and ethanol co-ex-posure lead to blood oxidative stress and subsequent neuronal apoptosis in rats[J].Alcohol Alcohol,2012,47(2):92-101.
[4] Khor BS,Jamil MF,Adenan MI,et al.Mitragynine attenuates withdrawal syndrome in morphine-withdrawn zebrafish[J].PLoS One,2011,6(12):e28340.
[5] Raveendran R,Devi Suma Priya S,Mayadevi M,et al.Phosphorylation status of the NR2Bsubunit of NMDA receptor regulates its interaction with calcium/calmodulin-dependent protein kinaseⅡ[J].J Neurochem,2009,110(1):92-105.
[6] Connelly CA,Chen LC,Colquhoun SD.Metabolic activity of cultured rat brainstem,hippocampal and spinal cord slices[J].J NeurosciMethods,2000,99(1/2):1-7.
[7] Yamauchi T.Molecular mechanism of learning and memory based on the research for Ca2+/calmodulin-dependent protein kinase Ⅱ [J].Yakugaku Zasshi,2007,127(8):1173-1197.
[8] Radwańska K,Tudor-Jones AA,Mizuno K,et al.Differential regulation of CaMKⅡinhibitor beta protein expression after exposure to a novel context and during contextual fear memory formation[J].Genes Brain Behav,2010,9(6):648-657.
[9] 杨红卫,胡晓东,张红梅,等.KN-93抑制脊髓背角C-纤维诱发电位LTP的诱导和早期维持[J].中山大学学报:医学科学版,2003,24(4):321-328.
[10]RamaRao G,Bhattacharya BK.Multiple signal transduction pathways alterations during nerve agent toxicity[J].Toxicol Lett,2012,208(1):16-22.
[11]Wilson MA,Brunger AT.Domain flexibility in the 1.75 A resolution structure of Pb2+-calmodulin[J].Acta Crystallogr D Biol Crystallogr,2003,59(10):1782-1792.
[12]Wayman GA,Tokumitsu H,Davare MA,et al.Analysis of CaM-kinase signaling in cells[J].Cell Calcium,2011,50(1):1-8.
[13]Toscano CD,O′Callaghan JP,Guilarte TR.Calcium/calmodulin-dependent protein kinase II activity and expression are altered in the hippocampus of Pb2+-exposed rats[J].Brain Res,2005,1044(1):51-58.
[14]Naseer MI,Lee HY,Ullah N,et al.Ethanol and PTZ effects on siRNA-mediated GABAB1receptor:down regulation of intracellular signaling pathway in prenatal rat cortical and hippocampal neurons[J].Synapse,2010,64(3):181-190.
[15]Benito E,Valor LM,Jimenez-Minchan M,et al.cAMP response element-binding protein is a primary hub of activity-driven neuronal gene expression.Huber W,Barco A[J].J Neurosci,2011,31(50):18237-18250.
