重组腺病毒介导Hsp70基因表达对胰腺癌荷瘤小鼠的免疫功能影响*
2012-09-27孙运良苏长青马建霞吴红玉
孙运良,徐 灿,苏长青,马建霞,吴红玉
(1.第二军医大学附属长海医院消化内科,上海210043;2.第二军医大学附属东方肝胆外科医院分子肿瘤研究室,上海210043)
热休克蛋白质70(heat shock protein 70,Hsp70)是一类广泛存在于各种生物体内的进化上高度保守的细胞应激蛋白。研究已证实,肿瘤细胞来源的Hsp70不仅可作为抗原提呈的辅助分子参与肿瘤抗原肽的加工和处理,增强肿瘤抗原的稳定性和免疫原性,而且可作为抗原呈递分子直接将肿瘤抗原肽递呈给T细胞,特别是细胞毒性T细胞,从而诱导机体产生强大的抗肿瘤免疫效应[1-3]。近年来,以Hsp70为基础的肿瘤疫苗受到了学者的广泛关注,本研究利用前期构建的表达Hsp70基因的重组腺病毒治疗胰腺癌荷瘤小鼠动物模型,观察该重组腺病毒对荷瘤小鼠移植瘤生长的抑制作用及其对免疫功能的影响,现报道如下。
1 材料与方法
1.1 材料 人胰腺癌细胞株BxPC-3为长海医院消化内科实验室保存,BxPC-3细胞在含10%FBS的 DMEM 培养液,37℃,5%CO2条件下培养,培养液中含青霉素、链霉素各10 U/mL。表达Hsp70基因的重组腺病毒Ad5-pCEA-Hsp70以及对照病毒Ad5-control为本研究前期所构建[4]。小鼠抗人Hsp70单克隆抗体购自Stressgen公司;FITC标记的抗小鼠CD4、CD8单克隆抗体为eBioscience公司产品;IL-2、INF-γ、IL-4、IL-10ELISA检测试剂盒购自BD公司,清洁级健康雄性的C57BL/6小鼠24只,体质量(20±2)g,6~8周龄,购于上海中科院斯莱克动物中心,第二军医大学动物实验中心饲养。
1.2 方法
1.2.1 胰腺癌荷瘤小鼠动物模型的建立 常规培养BxPC-3细胞,收集处于对数生长期的细胞,调整细胞浓度,将总量为5×106的细胞接种于C57BL/6小鼠腹部皮下。每周两次观察荷瘤小鼠皮下瘤的生长情况,以游标卡尺测量瘤体的长径和短径,通过a×b2/2(a为长径,b为短径)计算移植瘤的大小[5]。
1.2.2 实验分组及处理 待小鼠皮下形成直径约0.5cm的移植瘤后,随机将小鼠分为荷瘤组、对照组和治疗组,每组共8只动物。其中荷瘤组不作任何治疗;对照组给予腹腔注射溶于100μL PBS的对照病毒2×108PFU,每隔1d1次,共注射5次;治疗组给予腹腔注射溶于100μL PBS的重组腺病毒2×108PFU,每隔1d1次,共注射5次。
1.2.3 抑瘤效果和抑瘤率的评价 每周两次观察荷瘤小鼠的皮下瘤的生长情况,绘制肿瘤生长曲线,评价抑瘤效果。当荷瘤组肿瘤体积长至约1 000mm3时,以3%戊巴比妥钠腹腔注射麻醉各组实验动物,通过摘除眼球取血后处死动物,剥离皮下移植瘤,电子天平称质量,计算肿瘤抑制率。抑瘤率=[(荷瘤组平均瘤质量-治疗组平均瘤质量)/荷瘤组平均瘤质量]×100%。
1.2.4 Western blot检测移植瘤组织Hsp70蛋白表达 用RIPA裂解液制备移植瘤组织蛋白,蛋白分析系统(Bio-Rad)测定蛋白浓度,上样于20%SDS-PAGE电泳,电转染到硝酸纤维膜。室温下用含5%脱脂奶粉的1×PBS封膜2h。加入Hsp70单克隆抗体,4℃孵育过夜,洗膜后加入辣根过氧化物酶(HRP)标记的羊抗兔二抗,室温孵育2h,ECL显影。结果用凝胶图像软件分析系统对胶片扫描,与内参照β-actin进行比较,计算其比值。
1.2.5 脾指数测定 摘取小鼠的脾脏,用滤纸吸干残血后,电子天平称质量,计算脾脏指数。脾脏指数=[脾脏质量(mg)/小鼠体质量(g)]×100%。
1.2.6 流式细胞仪检测脾单核细胞中CD4+、CD8+细胞比例 分离小鼠脾脏,制备单细胞悬液,经FITC标记的抗小鼠CD4、CD8单克隆抗体标记后,通过流式细胞仪检测CD4+、CD8+细胞比例。
1.2.7 ELISA测定外周血中细胞因子的含量 取各组实验动物的外周血,离心后收集血清,按ELISA试剂盒说明书进行操作,检测细胞因子IL-2、INF-γ、IL-4、IL-10的含量。
1.2.8 酶法检测各组动物肝、肾功能 采用酶法通过HITACHI-7150型自动生化分析仪测定各组动物血清天冬氨酸转氨酶(AST),丙氨酸转氨酶(ALT)、尿素氮(BUN)以及肌酐(Cr)含量。
1.3 统计学处理 所有数据均应用SPSS11.0统计软件进行分析,计量资料以x±s表示,两组间均数比较采用t检验,多组均数比较采用单因素方差分析。以P<0.05为差异有统计学意义。
2 结 果
2.1 重组腺病毒对荷瘤小鼠皮下移植瘤的生长抑制作用C57BL/6小鼠皮下接种BxPC-3细胞后,5~7d后可以看见并能触及瘤结节,成瘤率100%。荷瘤组和对照组瘤体生长迅速,两组之间各个时间点肿瘤体积均差异无统计学意义;治疗组肿瘤生长则受到明显抑制,与荷瘤组和对照组各个时间点肿瘤体积相比,差异有统计学意义(P<0.05或P<0.01),见图1。实验终止时,治疗组的肿瘤质量为(0.62±0.18)g,显著低于荷瘤组和对照组[(1.32±0.27)g,(1.27±0.29)g;P<0.01];治疗组的肿瘤抑制率为53.1%,而对照组的肿瘤抑制率为3.79%。
2.2 重组腺病毒对荷瘤小鼠皮下移植瘤Hsp70蛋白表达的影响 Western blot结果显示(图2),重组腺病毒能够较好的介导Hsp70蛋白在荷瘤小鼠皮下移植瘤表达,治疗组Hsp70蛋白相对表达量为0.97±0.18,显著高于对照组与荷瘤组(0.31±0.09,0.27±0.07;P<0.01)。
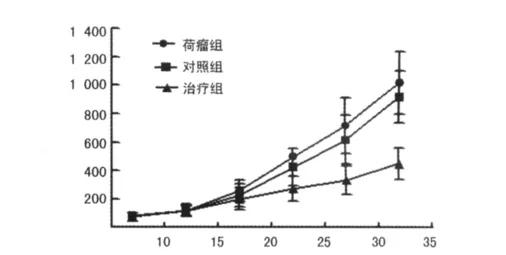
图1 重组腺病毒对胰腺癌荷瘤小鼠皮下移植瘤生长的影响
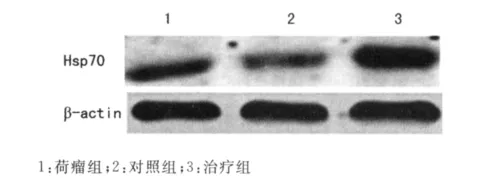
图2 Western blot检测Hsp70蛋白表达
2.3 重组腺病毒对荷瘤小鼠脾指数和CD4+、CD8+细胞比例的影响 治疗组脾指数为12.4±2.6,显著高于荷瘤组和对照组(P<0.05)。治疗组脾单核细胞CD4+、CD8+细胞比例分别为(17.3±2.5)%和(20.5±3.2)%,与荷瘤组和对照组相比,差异均有统计学意义(P<0.01)。见表1。
表1 重组腺病毒对荷瘤小鼠脾指数和CD4+、CD8+细胞比例的影响(±s)
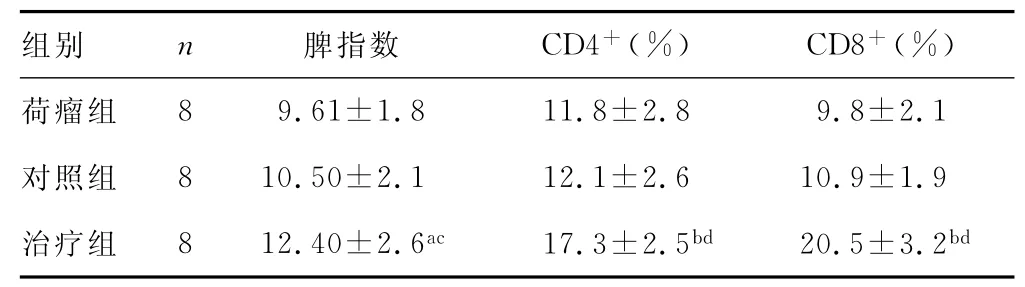
表1 重组腺病毒对荷瘤小鼠脾指数和CD4+、CD8+细胞比例的影响(±s)
a:P<0.05,b:P<0.01,与荷瘤组相比;c:P<0.05,d:P<0.01,与对照组比较。
组别 n 脾指数 CD4+(%) CD8+(%)8 9.61±1.8 11.8±2.8 9.8±2.1对照组 8 10.50±2.1 12.1±2.6 10.9±1.9治疗组 8 12.40±2.6ac 17.3±2.5bd 20.5±3.2荷瘤组bd
2.4 重组腺病毒对荷瘤小鼠血清Th1/Th2细胞因子水平的影响 经重组腺病毒治疗后,与荷瘤组和对照组相比,治疗组血清中细胞因子IL-2、INF-γ含量明显增加(P<0.01),IL-10含量则明显减少(P<0.01),而IL-4含量无明显变化,见图3。

图3 重组腺病毒对荷瘤小鼠血清Th1/Th2细胞因子水平的影响
2.5 重组腺病毒对荷瘤小鼠肝、肾功能的影响 与荷瘤组和对照组相比,经重组腺病毒治疗后,各组小鼠之间的肝、肾功能指标差异均无统计学意义(P>0.05)。见表2。
表2 重组腺病毒对荷瘤小鼠肝肾功能的影响(±s)
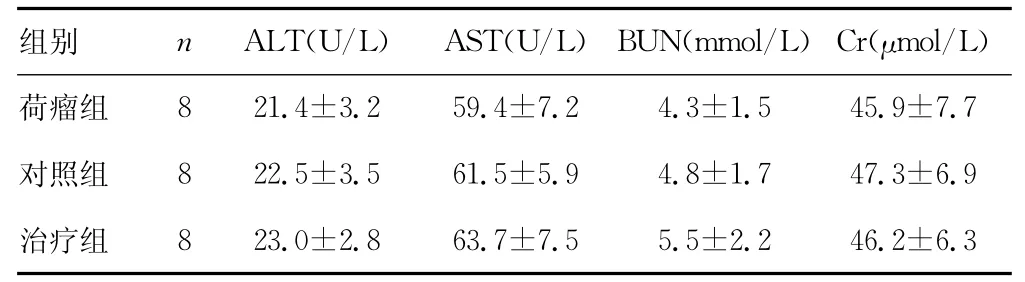
表2 重组腺病毒对荷瘤小鼠肝肾功能的影响(±s)
组别 n ALT(U/L) AST(U/L) BUN(mmol/L)Cr(μmol/L)8 21.4±3.2 59.4±7.2 4.3±1.5 45.9±7.7对照组 8 22.5±3.5 61.5±5.9 4.8±1.7 47.3±6.9治疗组荷瘤组8 23.0±2.8 63.7±7.5 5.5±2.2 46.2±6.3
3 讨 论
近年来,随着分子生物学和肿瘤免疫学的发展,免疫基因治疗已成为胰腺癌综合治疗的研究方向一。由于Hsp70能同时激活机体特异性免疫应答和固有免疫应答,在抗肿瘤免疫中发挥重要作用,因此以Hsp70为基础的肿瘤疫苗受到了学者的广泛关注[6-9]。近年来,随着DNA重组技术的应用和对Hsp70基因的深入研究,使人类可在基因水平构建以Hsp70为基础的肿瘤疫苗成为现实,促进了Hsp70肿瘤疫苗进行广泛应用的可能性。本研究利用前期构建的表达Hsp70基因的重组腺病毒治疗胰腺癌荷瘤小鼠,结果显示,治疗组的肿瘤生长受到明显抑制,且对肝、肾功能无明显影响,表明本研究所构建的重组腺病毒是一种较好的治疗胰腺癌的肿瘤疫苗。
目前关于Hsp70诱导机体抗肿瘤免疫反应的确切机制尚未完全明确,多数研究认为,Hsp70可与肿瘤细胞内的抗原多肽结合,进而通过与抗原递呈细胞相作用,激活特异性的免疫应答。Hsp70可与抗原递呈细胞表面的特异性高亲和受体相结合,介导抗原肽进入抗原提呈细胞,然后抗原肽与细胞内MHC分子形成复合物,并在抗原提呈细胞表面呈现,通过该复合物所递呈的抗原激活特异的免疫应答,活化CD4+和CD8+T细胞,特别是细胞毒性杀伤细胞,激发抗肿瘤细胞特异性反应[10-11]。本研究也显示,经重组腺病毒治疗后,荷瘤小鼠脾指数以及脾单核细胞中CD4+、CD8+细胞比例均明显增加,证实Hsp70在诱导机体特异性的抗肿瘤免疫中具有重要的作用。
Th细胞根据功能和产生细胞因子的不同可分为Th1和Th2两大类,其中Th1细胞产生IFN-γ、TNF-β和IL-2,参与细胞介导的免疫反应;而 Th2细胞产生IL-4、IL-5、IL-10和IL-13,参与体液介导的免疫反应。机体的抗肿瘤效应,主要依靠Th1类细胞因子的作用。肿瘤患者体内Th2类细胞因子多处于优势状,易产生免疫耐受,成为肿瘤逃避免疫攻击的机制之一。因此,Th1/Th2类型细胞因子之间的漂移对肿瘤免疫具有重要的影响[12-14]。本研究发现,重组腺病毒介导的Hsp70表达,可增加荷瘤小鼠体内Th1类细胞因子IL-2、IFN-γ的含量,降低Th2类细胞因子IL-10的水平,从而抑制荷瘤小鼠皮下移植瘤的生长。Chen等[15]研究也发现,热处理肿瘤细胞后所产生的Hsp70,可促进巨噬细胞以及树突状细胞趋化至肿瘤细胞,并可刺激IL-2、IFN-γ、TNF-α等细胞因子的分泌,从而发挥抗肿瘤免疫反应。
本研究发现以腺病毒介导Hsp70表达可对胰腺癌荷瘤小鼠皮下移植瘤的生长具有明确的抑制作用,其机制与增加CD4+、CD8+细胞比例,促进IL-2、IFN-γ并抑制IL-10的分泌有关。但关于Hsp70诱导机体抗肿瘤免疫的确切机制尚有待于进一步明确;很多宿主体内存在抗腺病毒抗体,可以中和或清除腺病毒,降低疗效。如何进一步解决上述问题,提高该重组腺病毒治疗胰腺癌的疗效和安全性,将是今后研究的主要方向。
[1] Ueda G,Tamura Y,Hirai I,et al.Tumor-derived heat shock protein 70-pulsed dendritic cells elicit tumor-specific cytotoxic T lymphocytes(CTLs)and tumor immunity[J].Cancer Sci,2004,95(3):248-253.
[2] Chan T,Chen Z,Hao S,et al.Enhanced T-cell immunity induced by dendritic cells with phagocytosis of heat shock protein 70gene-transfected tumor cells in early phase of apoptosis[J].Cancer Gene Ther,2007,14(4):409-420.
[3] Figueiredo C,Wittmann M,Wang D,et al.Heat shock protein 70(HSP70)induces cytotoxicity of T-helper cells[J].Blood,2009,113(13):3008-3016.
[4] 孙运良,徐灿,苏长青,等.CEA启动子驱动下表达Hsp70基因的重组腺病毒的构建及鉴定[J].中华胰腺病杂志,2011,11(8):251-254.
[5] Liu Y,Ye T,Sun D,et al.Tumor-specific therapeutic effect induced by an oncolytic adenoviral vector containing heat shock protein 70and prodrug activation genes[J].Gene T-her,2006,13(16):1235-1243.
[6] Bolhassani A and Rafat S.Heat-shock proteins as powerful weapons in vaccine development[J].Expert Rev Vaccines,2008,7(8):1185-1199.
[7] Ren Z,Ye X,Fang C,et al.Intratumor injection of oncolytic adenovirus expressing HSP70prolonged survival in melanoma B16bearing mice by enhanced immune response[J].Cancer Biol Ther,2008,7(2):191-195.
[8] Li JL,Liu HL,Zhang XR,et al.A phase I trial of intratumoral administration of recombinant oncolytic adenovirus overexpressing HSP70in advanced solid tumor patients[J].Gene Ther,2009,16(3):376-382.
[9] Di Paolo NC,Tuve S,Ni S,et al.Effect of adenovirus-mediated heat shock protein expression and oncolysis in combination with low-dose cyclophosphamide treatment on antitumor immune responses[J].Cancer Res,2006,66(2):960-969.
[10]Mambula SS,Calderwood SK.Heat shock protein 70is secreted from tumor cells by a nonclassical pathway involving lysosomal endosomes[J].J Immunol,2006,177(11):7849-7857.
[11]Harmala LE,Ingulli EG,Curtsinger JM,et al.The adjuvant effects of mycobacterium tuberculosis heat shock protein 70result from the rapid and prolonged activation of antigen-specific CD8+T cells in vivo[J].J Immunol,2002,169(10):5622-5629.
[12]AgauguéS,Carosella ED,Rouas-Freiss N.Role of HLA-G in tumor escape through expansion of myeloid-derived suppressor cells and cytokinic balance in favor of Th2versus Th1/Th17[J].Blood,2011,117(26):7021-7031.
[13]Godin-Ethier J,Pelletier S,Hanafi LA,et al.Human activated T lymphocytes modulate IDO expression in tumors through Th1/Th2balance[J].J Immunol,2009,183(12):7752-7760.
[14]Tosolini M,Kirilovsky A,Mlecnik B,et al Clinical impact of different classes of infiltrating T cytotoxic and helper cells(Th1,th2,treg,th17)in patients with colorectal cancer[J].Cancer Res,2011,71(4):1263-1271.
[15]Chen T,Guo J,Han C,et al.Heat shock protein 70,re-leased from heat-stressed tumor cells,initiates antitumor immunity by inducing tumor cell chemokine production and activating dendritic cells via TLR4pathway[J].J Immunol,2009,182(3):1449-1459.
