丙戊酸盐对胃癌细胞株SGC-7901/VCR耐药性的逆转作用*
2012-09-27缪肖波刘求真姚开泰肖广惠
缪肖波,刘求真,姚开泰,肖广惠
(南方医科大学肿瘤研究所,广州510515)
胃癌是世界常见恶性肿瘤之一[1],目前早期胃癌多采用手术治疗为主的综合治疗,而对于中晚期患者,化疗则是综合治疗的重要措施之一[2]。然而导致化疗失败的重要原因就是化疗过程中形成的多药耐药性(multidrug resistance,MDR)[3]。多药耐药性是指恶性肿瘤细胞接触一种抗癌药后,继而对多种结构不同、作用机制各异的其他抗癌药产生耐药性的现象[4],其成为化疗失败以及缓解后复发的主要原因。因此,寻找能够逆转MDR的药物成为胃癌研究的热点。丙戊酸盐(Valproate)是一种短链脂肪酸,目前在临床上被作为一线药物用来治疗癫痫[5-6],后有实验证明丙戊酸盐具有抑制组蛋白去乙酰化酶(histone deacetylase,HDAC)的作用[7],这类抑制剂被称为组蛋白去乙酰化酶抑制剂,是一种新型且有效的抗肿瘤药物,可促进组蛋白乙酰化,激活某些基因转录,诱导细胞生长停滞、促进细胞分化和凋亡,并具有抑制肿瘤血管生成和转移的作用[8]。丙戊酸盐作为抗肿瘤药物的临床实验正在进行。本实验选择SGC-7901和SGC-7901/VCR细胞作为实验对象,观察丙戊酸盐对耐药细胞SGC-7901/VCR耐药性的逆转作用,并探讨其机制。
1 材料与方法
1.1 细胞培养 人胃癌细胞株SGC-7901及其耐药株SGC-7901/VCR由中南大学湘雅医学院细胞中心提供,将细胞置入含青/链霉素100U/mL青/链霉素和10%胎牛血清的RPMI-1640培养液中,在37℃,5%CO2恒温培养箱密闭条件下培养,每3天换1次液。
1.2 主要试剂和药物 胎牛血清、RRPMI-1640培养液、青/链霉素(Gibco);MTT(Sigma);二甲亚砜(DMSO,Sigma);长春新碱(VCR,深圳万乐药业);丙戊酸盐(Chalbiochem);Annexin V-FITC/PI细胞凋亡检测试剂盒(凯基生物);抗乙酰化组蛋白3(acetylated histone H3,AcH3)单克隆抗体、β-Actin抗体(Santa Cruz)。
1.3 MTT法检测SGC-7901及SGC-7901/VCR细胞对 VCR及丙戊酸盐的敏感性 以每孔5 000个细胞接种于96孔培养板中,每孔体积100μL,每组3孔,同时设空白对照(仅加培养基),分别加入 VCR(浓度梯度为10.000、5.000、2.500、1.250、0.625、0.320、0.160和0.000μmol/L)或丙戊酸盐(浓度梯度为32.0、16.0、8.0、4.0、2.0、1.0、0.5和0.0mmol/L)培养48 h后,每孔加入5mg/mL的MTT 20μL,37℃继续培养4h后终止培养,小心吸弃孔内培养基,加入二甲基亚砜(DMSO)150 μL,室温孵育10min,微振荡器振荡10min,使结晶物充分溶解,以空白对照孔调零,测定OD值,绘制耐药曲线。IC50软件分析SGC-7901和SGC-7901/VCR细胞对VCR及丙戊酸盐的IC50,并计算耐药指数,对某一药物的RI=耐药细胞IC50/亲本细胞IC50。
1.4 丙戊酸盐对耐药细胞SGC-7901/VCR耐VCR的逆转作用 制备单细胞悬液,接种于96空培养板,每孔5 000个细胞,37℃、5%CO2培养箱过夜,待细胞完全贴壁后,加入药物。MTT法检测丙戊酸盐对耐药细胞SGC-7901/VCR耐VCR的逆转时,VCR设8个药物梯度,分别为10.000、5.000、2.500、1.250、0.625、0.320、0.160和0.000μmol/L;丙戊酸盐设3个药物梯度,分别为1.0、0.5和0.0mmol/L。共设3个实验组:(1)VCR;(2)0.5mmol/L + VCR;(3)1.0mmol/L + VCR。加入药物继续培养48h后,每孔加入5mg/mL的 MTT 20 μL,37℃继续培养4h后终止培养,小心吸弃孔内培养基,加入二甲基亚砜(DMSO)150μL,室温孵育10min,微振荡器振荡10min,使结晶物充分溶解,以空白对照孔调零,测定OD值,绘制耐药曲线。观察耐药细胞SGC-7901/VCR对VCR的敏感性,计算IC50和逆转指数 (逆转指数=使用逆转药物前IC50/使用逆转药物后IC50)。
1.5 流式细胞术检测细胞凋亡 收集对数生长期的SGC-7901/VCR细胞,消化、计数、铺板,37℃、5%CO2培养箱中培养,待培养12h细胞完全贴壁后,进行不同处理(未处理组、1.0μmol/L VCR处理组、0.5mmol/L丙戊酸盐处理组、1.0 mmol/L 丙戊酸盐处理组、1.0μmol/L VCR + 0.5mmol/L丙戊酸盐处理组和1μmol/L VCR+1.0mmol/L丙戊酸盐处理组),药物作用48h后,收集所有细胞(包括液体中悬浮的细胞)后计数,调整细胞浓度为1×106/mL。SGC-7901/VCR细胞未处理组分别设空白对照管和凋亡检测管,其余药物处理组只设凋亡检测管。凋亡检测管反应容积为100μL,加入FITC-Annexin V和PI各5μL后室温避光孵育30min。孵育完成后,D-Hanks洗涤2次后D-hanks重悬,上BD公司FACSAria型号流式细胞仪检测细胞凋亡,并计算总凋亡率(早期凋亡+晚期凋亡)。
1.6 Westernblot实验检测SGC-7901/VCR细胞中乙酰化组蛋白AcH3的表达 首先提取亲代细胞SGC-7901和耐药细胞SGC-7901/VCR的总蛋白,检测两细胞中AcH3的表达差异。继而用不同浓度(0.0、0.5、1.0或2.0mmol/L)的丙戊酸盐作用于SGC-7901/VCR细胞48h或同一浓度(1mmol/L)作用12、24、48h后,检测丙戊酸盐其影响AcH3表达的规律。为了明确丙戊酸盐对AcH3的特异性,4种处理方法(未处理、1.0μmol/L VCR、1.0mmol/L 丙戊酸盐和1.0μmol/L VCR+1.0mmol/L丙戊酸盐)处理SGC-7901/VCR细胞48h后,检测细胞中AcH3的表达。提取的蛋白经BCA法测定蛋白浓度后,煮沸变性上样于SDS-PAGE凝胶进行电泳分离,转膜,封闭,然后依次结合AcH3单克隆抗体和HRP标记的二抗,将ECL发光液Solution A和Solution B按1∶1比例混合,Bio-Rad公司molecular Imager ChemiDocTM XRS+成像系统下采集曝光图像。
1.7 统计学处理 数据采用SPSS13.0进行分析,计量资料以±s表示,两样本比较采用独立样本t检验分析;One-way ANOVA比较同一细胞不同处理组的差异;两细胞不同药物处理的凋亡率数据采用析因设计方差分析,以P<0.05为差异有统计学意义。
2 结 果
2.1 SGC-7901及SGC-7901/VCR细胞对 VCR及丙戊酸盐的敏感性 与亲代细胞SGC-7901相比,耐药细胞SGC-7901对 VCR 不敏感,IC50分 别为 (0.073±0.020)μmol/L 和(2.530±0.287)μmol/L,两者差异具有统计学意义(t= -14.793,P=0.004),耐药倍数为36.0。而SGC-7901和SGC-7901/VCR细胞对丙戊酸盐的IC50分别为3.681±0.889 mmol/L和3.313±0.511mmol/L,两者之间差异无统计学意义(t=0.621,P=0.568),这表明 SGC-7901和 SGC-7901/VCR对丙戊酸盐的敏感性基本相同。根据丙戊酸盐抑制细胞增殖曲线可知,丙戊酸盐在0.5mmol/L和1mmol/L时,对SGC-7901和SGC-7901/VCR细胞的抑制作用较弱,细胞存活率大于60%,细胞毒性较弱,本研究选择这两个浓度作为逆转耐药时的药物处理浓度,见表1。
表1 MTT比较SGC-7901和SGC-7901/VCR细胞的耐药能力(±s,n=3)

表1 MTT比较SGC-7901和SGC-7901/VCR细胞的耐药能力(±s,n=3)
IC50细胞系VCR(μmoL) 丙戊酸盐(mmol/L)SGC-7901 0.073±0.020 3.681±0.889 SGC-7901/VCR 2.530±0.287 3.313±0.511 t-14.793 0.621 P 0.004 0.568耐药指数36.0 1.0
2.2 丙戊酸盐对SGC-7901/VCR细胞耐VCR的逆转作用与SGC-7901细胞相比,SGC-7901/VCR细胞对 VCR 的耐药指数约为36.0。为了检测丙戊酸盐对耐药细胞耐VCR逆转作用的效果,将丙戊酸盐与VCR联用,在0.5mmol/L或1.0 mmol/L丙戊酸盐存在的条件下,SGC-7901/VCR细胞对VCR的敏感性明显增加,IC50由(2.433±0.208)μmol/L分别降为(0.850±0.132)μmol/L和(0.433±0.104)μmol/L,且随着丙戊酸盐浓度的上升逆转作用增强,各处理组间差异有统计学意义(F=139.826,P=0.000),逆转指数分别为2.86和5.62,见表2。
2.3 丙戊酸盐与VCR联用可增加SGC-7901/VCR细胞的凋亡率 为了检测丙戊酸盐单用或联合VCR使用后对细胞凋亡的影响,将耐药细胞SGC-7901/VCR依次进行6种处理,分别为未处理、1.0μmol/L VCR处理、0.5mmol/L丙戊酸盐处理、1.0mmol/L 丙 戊 酸 盐 处 理、1.0μmol/LVCR+0.5 mmol/L丙戊酸盐处理和1.0μmol/L VCR+0.5mmol/L丙戊酸盐处理。48h后流式细胞术检测细胞凋亡结果显示凋亡率分别为(3.600±0.552)%、(11.600±2.193)%、(12.133±2.103)%、(17.967±2.616)%、(32.7±2.685)%和(41.900±3.659)%。除1.0μmol/L VCR处理组与0.5mmol/L丙戊酸盐处理组之间差异无统计学意义(P>0.05)外,其余各组之间的差异均有统计学意义(P<0.05)。此结果表明丙戊酸盐与VCR联用可促进细胞的凋亡,且这种作用具有浓度依赖性,见图2。
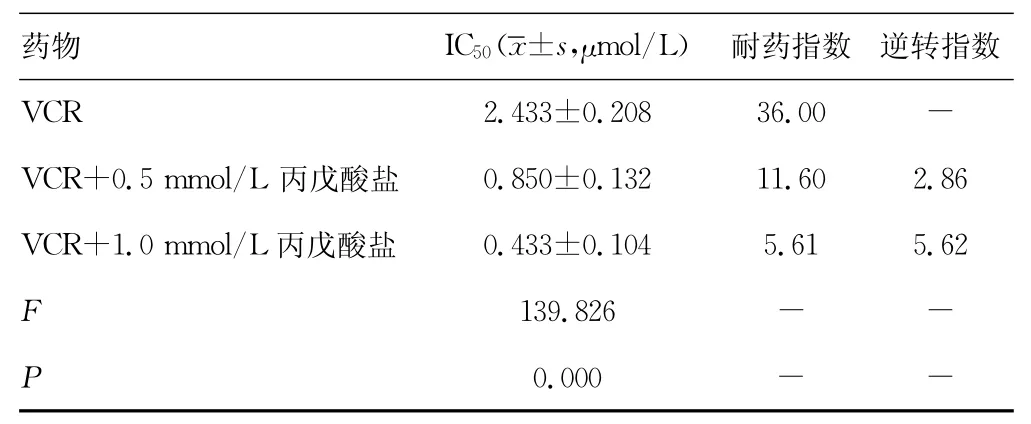
表2 丙戊酸盐对SGC-7901/VCR细胞耐药性的逆转作用(n=3)
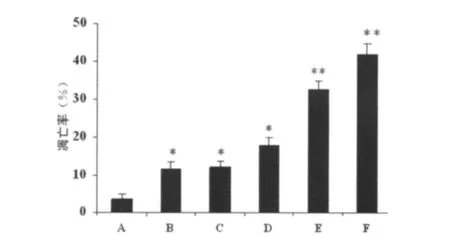
图2 丙戊酸盐与VCR联用对SGC-7901/VCR细胞凋亡的影响(n=3)
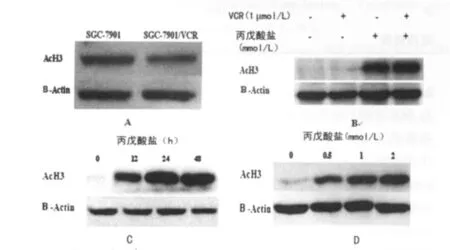
图3 丙戊酸盐诱导SGC-7901/VCR细胞中组蛋白的增加
2.4 丙戊酸盐逆转SGC-7901/VCR细胞耐药的机制 Western blot实验结果显示,与亲代细胞SGC-7901相比,耐药细胞SGC-7901/VCR的 AcH3的表达降低(图3A)。未处理、1 μmol/LVCR、1.0mmol/L丙戊酸盐和1μmol/L VCR +1.0 mmol/L丙戊酸盐等4种处理后 SGC-7901/VCR 细胞中AcH3检测结果显示:与未处理组相比,1.0mmol/L丙戊酸盐和1.0μmol/L VCR+1.0mmol/L丙戊酸盐处理组AcH3表达明显增高,而1.0μmol/L VCR处理组无变化(图3B)。这说明丙戊酸盐能够增加SGC-7901/VCR细胞中AcH3的表达。用0.5、1.0或2.0mmol/L丙戊酸盐分别处理SGC-7901/VCR细胞48h后,AcH3的表达量随药物浓度的上升而逐渐增加(图3C);用同一浓度(1.0mmol/L)的丙戊酸盐处理SGC-7901/VCR细胞12、24、48h后发现,随处理时间的延长,AcH3的表达量也逐渐增加(图3D)。这说明丙戊酸盐增加AcH3的表达具有浓度和时间依赖性。
3 讨 论
在近代肿瘤治疗进程中,MDR已成为影响化疗效果和远期预后的重要因素[9]。自1970年Bieder等[10]首次阐述 MDR以来,对MDR形成机制的研究持续存在。肿瘤细胞对化疗药物产生耐药性是治疗失败的主要原因,也是临床所需要解决的难题[11]。由于肿瘤细胞发生MDR的机制十分复杂,因此选择理想的耐药细胞模型是解决问题最基本的条件。本研究选择的耐药细胞SGC-7901/VCR与亲代细胞 SGC-7901相比对VCR化疗药物均有较强耐药性,耐药倍数高达36.0,是研究逆转耐药的较好模型。Kim等[12]的实验发现多数胃癌组织中有HDAC1mRNA和蛋白高表达,这表明在胃癌组织中组蛋白去乙酰化酶的表达增加,而组蛋白的表达是明显降低的。亲代细胞SGC-7901与耐药细胞SGC-7901/VCR细胞作为胃癌细胞系,也具有此特点,因此可以选择胃癌细胞作为丙戊酸盐逆转耐药的研究对象。
组蛋白氨基端富含赖氨酸残基,对其中保守位点的乙酰化修饰可以影响DNA与转录调节复合物的结合,调控DNA的复制和修复、基因表达、染色质组装和细胞有丝分裂[13]。组蛋白的乙酰化状态由两类酶来决定,即组蛋白乙酰转移酶(histone acetyltransferase,HAT)和组蛋白脱乙酰基酶(histone deacetylase,HDAC)[14]。这两类酶对组蛋白乙酰化作用调控的失衡,可导致染色质结构改变,使调节细胞周期、细胞分化、凋亡的基因转录失衡,从而导致细胞的恶变。HDACIs作为一类新型、有效的抗肿瘤化合物,可促进组蛋白乙酰化,激活某些基因转录,诱导细胞生长停滞、促进细胞分化和凋亡[15]。丙戊酸盐作为一种组蛋白去乙酰化酶抑制剂(histone deacetylase inhibitors,HDACIs),与SAHA、TSA 等 HDACIs相比,具有作用时间长,毒性作用较弱等优点[16]。而且本研究发现丙戊酸盐 对 SGC-7901 和 SGC-7901/VCR 细 胞 的 IC50分 别 为(3.681±0.889)mmol/L和(3.313±0.511)mmol/L,二者之间差异无统计学意义,这表明与SGC-7901相比,SGC-7901/VCR对丙戊酸盐的敏感性相同。本研究选取0.5mmol/L和1.0 mmol/L两个较低浓度丙戊酸盐与VCR联用,观察其逆转耐药效果,结果发现丙戊酸盐使SGC-7901/VCR细胞对VCR的敏感性明显增加,IC50由(2.433±0.208)mol/L分别降为(0.850±0.132)μmol/L和(0.433±0.104)μmol/L,逆转指数分别为2.86和5.62。
Keshelava等[17]在神经母细胞瘤的研究中发现,耐药细胞中组蛋白去乙酰化酶的表达明显增加,即乙酰化组蛋白表达明显降低。通过抑制HDAC的表达或降低其活性可增加多药耐药细胞对普通化疗药物的敏感性。为了探讨丙戊酸盐逆转耐药的机制,本实验首先检测了亲代细胞和耐药细胞中AcH3的表达,结果证实耐药细胞SGC-7901/VCR中AcH3的表达量明显低于亲代细胞SGC-7901。丙戊酸盐单独或与VCR联用后检测结果显示VCR不能增加AcH3的表达,而丙戊酸盐增加AcH3表达则具有浓度和时间依赖性。增加的乙酰化组蛋白通过多种途径杀灭肿瘤细胞,其中最重要的就是增加细胞凋亡[18]。因此,本实验将低浓度丙戊酸盐和VCR联用后流式检测细胞凋亡的变化,结果发现:与未处理组相比,单独丙戊酸盐或VCR处理细胞均可诱导凋亡但比例较低,而两药联用时耐药细胞SGC-7901/VCR细胞的凋亡率明显增加。因此,丙戊酸盐通过抑制去乙酰化酶增加乙酰化组蛋白(如AcH3)的表达,进而通过一系列机制促进细胞凋亡逆转耐药。
目前,许多组蛋白去乙酰化酶抑制剂类药物进入了临床实验和一线治疗,如 MS-275、他地那兰、belinostat、vorinostat、帕比司他等,均显示了较好的抗肿瘤效果[19]。作为一种新型非细胞毒的广谱抗肿瘤药物,HDACi具有良好的临床应用前景和价值,作为其中的一种,由于丙戊酸盐作用时间长、安全范围大等特点,特别是联合其他化疗药物时对化疗疗效的促进作用,将会使其应用得到越来越多的重视。
[1] Alberts SR,Cervantes A,van de Velde CJ.Gastric cancer:epidemiology,pathology and treatment[J].Ann Oncol,2003,14(2):31-36.
[2] Sasako M.Principles of surgical treatment for curable gastric cancer[J].J Clin Oncol,2003,21(23Suppl):274-275.
[3] Kowalski P,Stein U,Scheffer GL,et al.Modulation of the atypical multidrug resistant phenotype by a hammerhead ribozyme directed against the ABC transporter BCRP/MXR/ABCG2[J].Cancer Gene Ther,2002,9(7):579-586.
[4] Pastan I.Cottesman MM.Multidrug resistance[J].Annu Rev Med,1991,42:277-286.
[5] Eong MR,Hashimoto R,Senatorov VV,et al.Valproic acid,a mood stabilizer and anticonvulsant,protects rat cerebral cortical neurons from spontaneous cell death:a role of histone deacetylase inhibition[J]FEBS Lett,2003,542(1/2/3):74-78.
[6]Phiel CJ,Zhang F,Huang EY,et al.Histone deacetylase is a direct target of valproic acid,apotent anticonvulsant,mood stabilizer,and teratogen[J].J Biol Chem,2001,276(39):36734-36741.
[7] Gottlicher M,Minucci S,Zhu P,et al.Valproic acid defines a novel class of HDAC inhibitors inducing differentiation of transformed cells[J].EMBO J,2001,20(24):6969-6978.
[8] Marks PA,Richon VM,Rifkind RA.Histone deacetylase inhibitors:inducers of differentiation or apoptosis of transformed cells[J].J Nail Cancer Inst,2000,92(15):1210-1216.
[9] Perez-Tomas R.Multidrug resistance:retrospect and prospects in anti-cancer drug treatment[J].Curr Med Chem,2006,13(16):1859-1876.
[10]Biedler JL,Riehm H.Cellular resistance to actinomycin D in Chinese hamster cells in vitro:Cross-resistance,radioautographic,and cytogenetic studies[J].Cancer Res,1970,30(4):1174-1184.
[11]Lin XS,Rui M.Rong L,et al.Reversal effect of tyroservatide(YSV)tripeptide on multi-drug resistance in resistant human hepatocellular carcinoma cell ine BEL-7402/5-FU[J].Cancer Letters,2008,269(1):101-110.
[12]Kim JH,Choi YK,Yang HK,et al.Downregulation of gelsolin and retinoic acid receptor beta expression in gastric cancer tissues through histone deacetylase 1[J].J Gastroenterol Hepatol,2004,19(2):218-224.
[13]Huang C,Sloan EA,Boerkoel CF.Chromatin remodeling and human disease[J].Curr Opin Genet Dev,2003,13(3):246-249.
[14]Khochbin S,Verdel A,Lemercier C,et a1.Functional significance of histone deacetylase diversity[J].Curt Opin Genet Dev,2001,11(2):162-166.
[15]Marks PA,Richon VM,Rifkind RA.Histone deacetylase inhibitors:inducers of differentiation or apoptosis of transformed cells[J].J Nail Cancer Inst,2000,92(15):1210-1216.
[16]Vandermeers F,Hubert P,Delvenne P,et al.Valproate,in combination with pemetrexed and cisplatin,provides additional efficacy to the treatment of malignant mesothelioma[J].Clin Cancer Res,2009,15(8):2818-2828.
[17]Keshelava N,Davicioni E,Wan Z,et al.Histone Deacetylase 1Gene Expression and Sensitization of Multidrug-Resistant Neuroblastoma Cell Lines to Cytotoxic Agents by Depsipeptide[J].J Natl Cancer Inst,2007,99(14):1107-1119.
[18]Burgess A,Ruefli A,Beamish H,et al.Histone deacetylase inhibitors specifically kill nonproliferating tumour cells[J].Oncogene,2004,23(40):6693-6701.
[19]焦杰,徐文方.新型抗肿瘤药组蛋白脱乙酰基抑制剂的临床研究进展[J].中国新药与临床杂志,2009,28(3):161-163.
