BARD1及相关蛋白在乳腺浸润性导管癌中的表达及意义
2012-09-20罗娟娟
罗娟娟,陈 阳,张 帆
(1.皖南医学院 法医病理学教研室,安徽 芜湖 241002;2.皖南医学院附属弋矶山医院 病理科,安徽 芜湖 241001)
乳腺癌现已成为女性因癌症而死亡的最主要原因之一,BARD1是在非家族性及散发性乳腺癌患者中发现的新的抑癌基因,其在乳腺癌发生发展中的作用已成为目前研究的热点。本研究通过免疫组织化学方法检测乳腺浸润性导管癌组织中BARD1、cerbB-2、P53、ER和 PR的表达特征,并初步探讨BARD1与其他蛋白表达的相关性以及临床病理学各因素的相关性及其临床意义。
1 资料与方法
1.1 病例资料 收集皖南医学院附属弋矶山医院病理科2009年5月~2011年5月乳腺手术切除标本,其中实验组为156例乳腺浸润性导管癌,对照组为22例乳腺腺病。腺病组患者年龄26~60岁,中位年龄43岁;乳腺癌组患者年龄32~76岁,中位年龄54岁;其中组织学分级Ⅰ级52例,Ⅱ级95例,Ⅲ级9例。无腋淋巴结转移57例,有腋淋巴结转移99例。患者均为女性,无乳腺癌家族史,行乳腺癌根治手术,术前均未接受放疗、化疗及其他抗癌治疗。所有标本均由两位病理科主任医师依据WHO 2004年乳腺及女性生殖系统分类标准诊断。
1.2 方法 上述存档蜡块组织均为4%甲醛固定,常规脱水,石蜡包埋,4μm厚切片。SP两步法免疫组织化学染色,DAB显色。分别检测两组标本中BARD1、c-erbB-2、P53、ER 和 PR 蛋白的表达。兔抗人BARD1多克隆抗体(工作液)购自Novus Biologi-cals(USA),c-erbB-2、P53、ER 和 PR 一抗及浓缩试剂盒购自武汉博士德公司。所用抗体均采用pH 6.0的柠檬酸钠缓冲液高压修复。以PBS代替一抗作空白对照,以已知阳性病例作阳性对照。操作严格按产品说明书进行。
1.3 结果判断 免疫组织化学染色细胞膜、胞质或胞核出现清晰淡黄色至棕褐色颗粒者为阳性表达细胞。BARD1阳性表达定位于细胞核及细胞质,cerbB-2阳性表达定位于细胞膜或细胞质,P53、ER、PR阳性表达均定位于细胞核。由两位高年资病理医师采用双盲法读片,每人选择10个具有代表性的高倍视野(×400倍),评分后取平均值。BARD1、P53、ER、PR评分标准参考免疫组织化学染色结合染色强度和阳性细胞数进行分级[1]。染色强度评分标准:不着色为0分,淡黄色为1分,黄褐色为2分,棕褐色为3分。阳性细胞所占整张切片比例评分标准:阳性细胞数 <5%为0分,5% ~25%为1分,>25% ~50%为2分,>50% ~75%为3分,>75%为4分。2种评分乘积0分为阴性,≥1分为阳性。c-erbB-2(HER-2)采用Hercep Test进行IHC检测分析并根据修订的评分系统进行评分[2]。此评分系统中IHC⧻为HER-2阳性,IHC+及IHC-为HER-2阴性。无着色/少于10%肿瘤细胞有细胞膜着色(0/阴性);大于10%的肿瘤细胞呈现微弱、不完整的细胞膜着色(+/阴性);大于10%的肿瘤细胞呈现弱至中度完整的细胞膜着色(⧺/不确定);大于10%的肿瘤细胞呈现强的、完整的细胞膜着色(⧻/阳性);若两人观察结果相差3分则重新评定。
1.4统计学分析 计数资料采用χ2检验和等级相关分析,P<0.05为有统计学意义。
2 结果
2.1 BARD1等蛋白在乳腺浸润性导管癌和腺病中的表达 156例乳腺浸润性导管癌及22例腺病组织中,BARD1等蛋白的表达情况见表1,其中-为失表达,+为低表达,⧺~⧻为中强度或过表达。
2.2 乳腺癌中BARD1与c-erbB-2等蛋白表达水平关联性分析 结果显示乳腺癌组织中BARD1的表达与 P53(P <0.05)表达相关,与 c-erbB-2、ER、PR表达差异无统计学意义(P值均>0.05)。
2.3 乳腺癌中BARD1的表达与临床病理因素的相关性 BARD1蛋白表达在不同肿瘤大小、组织学分级之间及不同临床分期各组间差异有统计学意义(P<0.05),而与年龄、有无淋巴结转移阳性率差异无统计学意义(P >0.05,表3)。
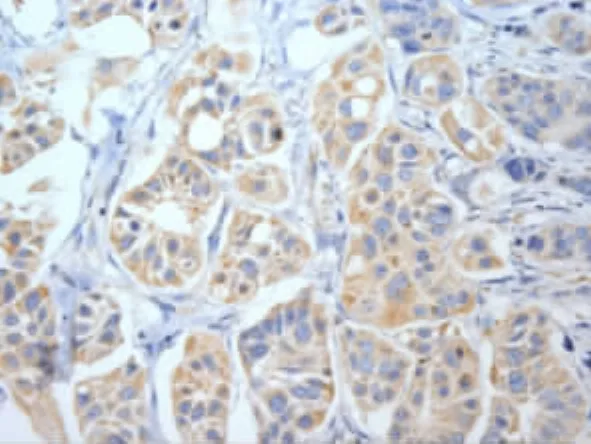
图1 BARD1在乳腺癌中的表达(×400)
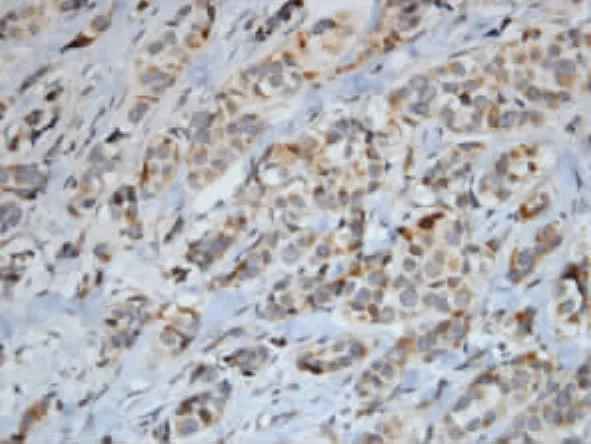
图2 BARD1在腺病中的表达(×400)

表1 BARD1等蛋白在乳腺浸润性导管癌和腺病中的表达
3 讨论
BARD1是1996年在无家族性乳腺癌患者以及散发性乳腺癌患者中发现的新的乳腺癌候选抑癌基因[3]。该基因定位于2q34-35,编码777个氨基酸残基蛋白。BARD1不仅能与BRCA1环指区形成稳定的异二聚体,参与RNA聚合酶Ⅱ的泛素化,调节mRNA的加工过程,还可与聚腺苷酸化因子Cst FS0等相互作用。在DNA损伤修复、细胞周期、转录调控等多种重要通路中发挥肿瘤抑制作用[4-6]。

表2 乳腺癌中BARD1与P53、c-erbB-2等蛋白表达的关系
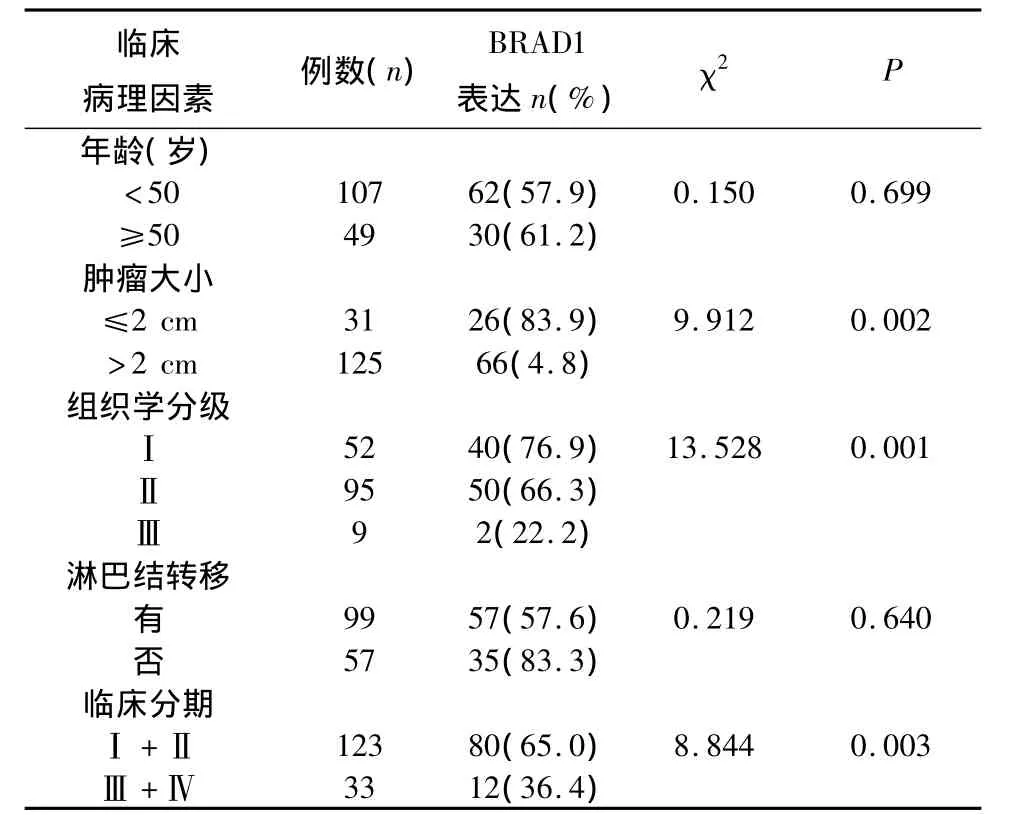
表3 乳腺癌中BARD1与临床病理因素的关系
本实验BARD1在乳腺癌组的表达明显低于腺病组(P<0.05),提示抑癌基因BARD1在乳腺癌中低表达或缺失。初步分析BARD1与临床病理指标的关系显示BARD1表达与组织学分级、临床分期相关,且随肿瘤分级的升高有逐渐下降趋势,其中Ⅰ级、Ⅱ级和Ⅲ级间的差异有统计学意义(P<0.05),表明BARD1蛋白的异常表达参与了乳腺癌的发生发展,与Wu等[7]报道一致。本实验结果还显示乳腺癌中BARD1的表达与肿瘤大小有关,而与淋巴结转移无关,与国内外文献报道相似。
p53基因是一个重要的抑癌管家基因,有突变型和野生型之分。国外报道p53在乳腺癌中阳性表达为27%~54%。本组156例乳腺癌p53阳性表达率为37.1%,与上述结果基本一致,且BRAD1失表达与突变型p53表达密切相关(P<0.05)。究其原因可能与BARD1的表达上调与p53的稳定性有关[8],并通过依赖于p53的细胞信号诱导细胞凋亡,行使抑制肿瘤的功能[9]。而 p53基因突变和BARD1的失表达共同导致BARD1无法通过p53基因发挥肿瘤抑制作用,最终促进了肿瘤的发生发展。
大量研究证实乳腺癌患者ER、PR阳性者较阴性者预后好,癌细胞分化程度高,生长缓慢,可避免不必要的内分泌器官切除[10]。本组乳腺浸润性导管癌与乳腺腺病ER、PR表达差异不显著,可能与标本的入选标准、标本量大小及采用的免疫组化方法等有关,156例乳腺浸润性导管癌中,ER、PR的阳性表达率分别为45.5%、51.32%,与文献基本一致。BARD1作为抑癌基因,可促进乳腺上皮接触抑制,抑制BARDI基因表达后会诱导癌前病变,与ER、PR关联分析中,未发现相关性,可能与学者推测的激素刺激肿瘤增殖的单一途径有关,是肿瘤发生中的早期事件,而激素受体的消失则是相对较晚的事件[11]。有关学者提出的卵巢激素周期性的变化而影响其表达的程度是否相关,有待进一步研究证实。
c-erbB-2阳性率高乳腺癌患者往往病理分级较高、肿瘤分化差、生存期较短,已成为一项预后不良的生物学指标。该基因定位于17q21,参与信号传导,细胞增殖、分化[12-13]。本组乳腺癌与腺病组织中阳性表达率差异显著,提示c-erbB-2过度表达参与了乳腺癌的发生发展。Starita等[14]证实BRCA1-BARD1异二聚体有细胞周期调控功能。c-erbB-2作为原癌基因,其磷酸化与细胞周期调控关系密切。本实验未发现BARD1与c-erbB-2具有相关性(P>0.05),提示两种蛋白在乳腺癌组织中的表达分子生物学机制不尽相同。至于两者在癌变过程中作用机制,笔者推断可能是由某些致病因素(遗传、环境、生物等)促进c-erbB-2基因过表达,产生大量促分裂因子,抑制BARD1基因表达,使细胞分裂失控,从而形成肿瘤有关。
综上所述,研究显示BARD1在乳腺癌中失表达率较高,提示其可作为预测乳腺癌易感性的生物指标,为乳腺癌的诊断、治疗、预测预后及预防提供了很好的实验依据。本研究没有发现BARD1与ER、PR和c-erbB-2的相关性,不能断然认为其无密切相关,可能与样本量小有关,有待于进一步更深入的研究。
[1] 于萍,步宏,王华,等.免疫组化结果的图像分析与人工计数方法的对比研究[J].生物医学工程学杂志,2003,20(2):288-290.
[2] HOFMANNM,STOSSO,SHID,et al.Assessment of a HER2 scoring system for gastric cancer:results from a validation study[J].Histopathology,2008,52(7):797 -805.
[3] WU LC,WANQ ZW,TSAN JT,et al.Identification of a RING protein that can interact in vivo with the BRCA1 gene product[J].Nature Genet,1996,14(4):430 -440.
[4] HASHIZUME R,FUKUDA M,MEADA I,et al.The RING heterodimer BRCA1-BARD1 is a ubiquitin ligase inactivated by a breast cancer- derived mutation[J].J Biol Chem,2001,276(18):14537-14540.
[5] OYAKE D,NISHIKAWA H,KOIZUKA I,et al.Targeted substrate degradation by an engineered double RING ubiquitin ligase[J].Biochem Biophys Res Commun,2002,295(2):370 -375.
[6] RUFNER H,JOAZEIROCA,HEMMATID,et al.Cancer predisposing mutations within the RING domain of BRCA1:loss of ubiquitin protein ligase activity and protection from radiation hypersensitity[J].Proc Natl Acad Sci USA,2001,98(9):5134 -5139.
[7] WU JY,VLASTOS AT,PELTE MF,et al.Aberrant expression of BARD1 in breast and ovarian cancers with poor prognosis[J].Int J Cancer,2006,118(5):1215 -1226.
[8] IRMINGER-FINGER I,LEUNG WC,LI J,et al.Identification of BARD1 as mediator between proapoptotic stress and p53-dependent apoptosis[J].Mol Cell,2001,8(6):1255-1266.
[9] IRM INGER-FINGER I,LEUNG WC.BRCA1-dependent and independent functions of BARD1[J].Int JBiochem Cell Biol,2002,34(6):582-587.
[10] XU GH,YE SI,WANG FM,et al.Protein Expression and Correlation with Prognosis of Three Drug Resistant genes in human Breast Carcinoma[J].Fudan Univ J Med Sei,2005,32(1):33 - 39.
[11] ROSEN EM,FAIL S,LSAACS C.BRCA1 in hormoonal carcinogenesis:basic and clinical research[J].Endocr Relat Cancer,2005,12(3):533 -548.
[12] PAWLOWSKIV,REVILLIONF,HORNEZL,et al.A real-time onestep reverse transcriptase-Polymerase chain reaction method to quantify c-erbB-2 expression in human breast caneer[J].Cancer Detect Prev,2000,24(3):212 -223.
[13] PRENZEL N,FISCHER OM,STREIT S,et al.The epidermal growth factor receptor family as a central element for cellular signal transduction and diversification[J].Endocr Relat Cancer,2001,8(1):11-31.
[14] STARITA LM,MACHIDA Y,SANKARAN S.BRCA1-dependent ubiquitination ofγ-tubulin regulates centrosome number[J].Mol Cell Biol,2004,24:8457 -8456.
