大鼠创伤后应激障碍模型及腹腔注射干预的影响
2012-09-20汪萌芽
秦 雯,曲 睿,汪萌芽
(皖南医学院 细胞电生理研究室,安徽 芜湖 241002)
创伤后应激障碍(post-traumatic stress disorder,PTSD)是指个体由于遭受到对生命具有威胁的事件或严重创伤,导致症状长期持续的精神障碍。其主要的特征性症状包括对创伤的反复性体验、持久性回避和警觉性增高[1-2]。与创伤记忆相关联的症状即条件性恐惧,据此可以建立PTSD动物模型,即通过给予动物严重的创伤应激,测试动物行为和生理的变化,以变化呈现应激强度(剂量)依赖性,并可持续较长时间或随时间逐渐增强为特征[3-5]。目前研究最多的是与创伤记忆相联系的联想性学习的恐惧性条件反射(fear conditioning),表现为病理性重现、回避和对创伤线索的高度警觉反应等症状,即为条件性恐惧记忆的PTSD模型[4-8]。为此,本文通过恐惧性刺激形成条件性恐惧记忆的方法制备大鼠PTSD干预的影响,特别已有研究显示不同的给药途径如灌胃或腹腔注射(ip)均会对实验动物的自主活动产生影响[9],特通过腹腔注射这一干预措施,观察其对模型大鼠条件性恐惧记忆的影响,为进一步研究PTSD的恐惧记忆机制和干预治疗奠定基础。
1 材料和方法
1.1 动物雄性SD大鼠38只,由南京青龙山动物中心提供,体质量(137.1±21.5)g。实验前,大鼠先适应性饲养一周,昼夜周期为12 h/12 h(8∶00开灯,20∶00熄灯),室温控制在(22±3)℃,每笼4只,自由进食饮水。适应期间,实验者每天抚摸大鼠5 min左右,使其适应实验者操作。
1.2 仪器设备美国San Diego公司的Freeze Monitor System(恐惧监测系统),包括3个测试箱,可提供光、声及足底电刺激,以及恐惧反应(木僵反应)检测,均通过Freeze Monitor软件由计算机自动控制完成。Morris水迷宫系统由自制的圆形不锈钢水池、Smart视频追踪系统的红外摄像头,以及大鼠行为Morris实验软件(中科院心理健康重点实验室隋南实验室馈赠)组成,其游泳轨迹记录和参数分析均由计算机自动完成。
1.3 PTSD模型制备与木僵时间检测 参考文献[4]并根据预试情况作刺激参数的适当调整,制备PTSD模型。第1、2天:大鼠置于测试箱中,适应2 min,每天检测基础木僵时间(即检测大鼠同时阻断三条红外射线以前木僵状态持续的时间)[10]。第3~5天上午:大鼠分别置于3个测试箱,适应2 min后开始“声音-电击”配对刺激。20 min/d,先给予15 s声音信号刺激,最后的10 s施加足底电击(3 mA),重复20次,间隔随机。以此建立声音与电刺激的配对条件性恐惧反应(PTSD造模)。造模完成24 h后进行条件性恐惧监测,监测指标为木僵时间,以木僵时间百分比表示(即累计木僵时间占总监测时间的百分比)。检测日共检测30次,每次持续监测10 s,总监测时间5 min。以木僵时间百分比达50%以上,为鉴定大鼠PTSD模型的标准。
1.4 动物分组和腹腔注射干预 将造模后大鼠按其木僵时间百分比分层随机抽取14只,均分为2组:对照组和生理盐水组。生理盐水组于建模后行生理盐水腹腔注射(ip,4 ml/kg,qd),连续2周,观察其对条件性恐惧反应的影响。对照组不做任何处理。两组模型大鼠均在生理盐水组干预后第2、4、8、15天进行木僵时间检测,监测时间5 min,10 s/次,以观察条件性恐惧记忆的消退情况。
1.5 Morris水迷宫空间学习记忆能力测试[11-12]
1.5.1 寻找平台训练方法 大鼠在进行正式测试前,先进行游泳以及寻找可视平台的训练。训练时,将不锈钢可视平台置于迷宫水池的中心,台面高出水面1 cm,每只大鼠先置于平台上适应20 s,随后训练3次,随机从不同象限的入水点投入水中,学习寻找平台60 s,若超过60 s仍未找到平台,由实验者引导至平台上停留15 s,然后取出。
1.5.2 定位航行实验 为期7 d,将透明平台置于4个象限中任一象限1/2弧度,池壁到池中心距离1/2的位置,水面高于台面1 cm。每天测试1次,含分别从4个象限(顺序随机)面向池壁入水的4个测试,每个测试间隔30 s。大鼠在水中游泳的时间记为逃避潜伏期;若大鼠60 s内未找到平台,则由实验者引导其登上平台并停留15 s,此时的逃避潜伏期计为60 s。
1. 5空间探索实验第7天定位航行实验结束1 h后,将平台撤离,大鼠从原平台所在象限的对侧象限入水,测试空间探索实验1次。分析记录大鼠在60 s内穿过原平台所在位置的次数。
1.6 统计学分析结果以¯x±s表示。用配对t检验比较处理前后的差异,用单因素方差分析(oneway ANOVA)分析模型大鼠条件性恐惧记忆的消退情况,用重复测量的双因素方差分析(two-way ANOVA)比较腹腔注射干预和对照组间条件性恐惧记忆的消退情况。
2 结果
2.1 声音-电击配对刺激对大鼠木僵时间百分比的影响38只大鼠经过连续3 d的声音-电击配对刺激后,木僵时间百分比由刺激前的(18.63±9.76)%增加到(59.01 ±20.44)%(配对 t检验,P<0.01,图1A),其中有28只大鼠的木僵时间百分比≥50%,达到条件性恐惧记忆的PTSD模型的鉴定标准(成功率为73.7%)。
2.2 木僵时间百分比与体质量的相关性分析经直线相关分析显示,38只大鼠声音-电击配对刺激作用的效果(木僵时间百分比)与体质量成一定的正相关关系(r=0.4200,P <0.01,图 1B)。
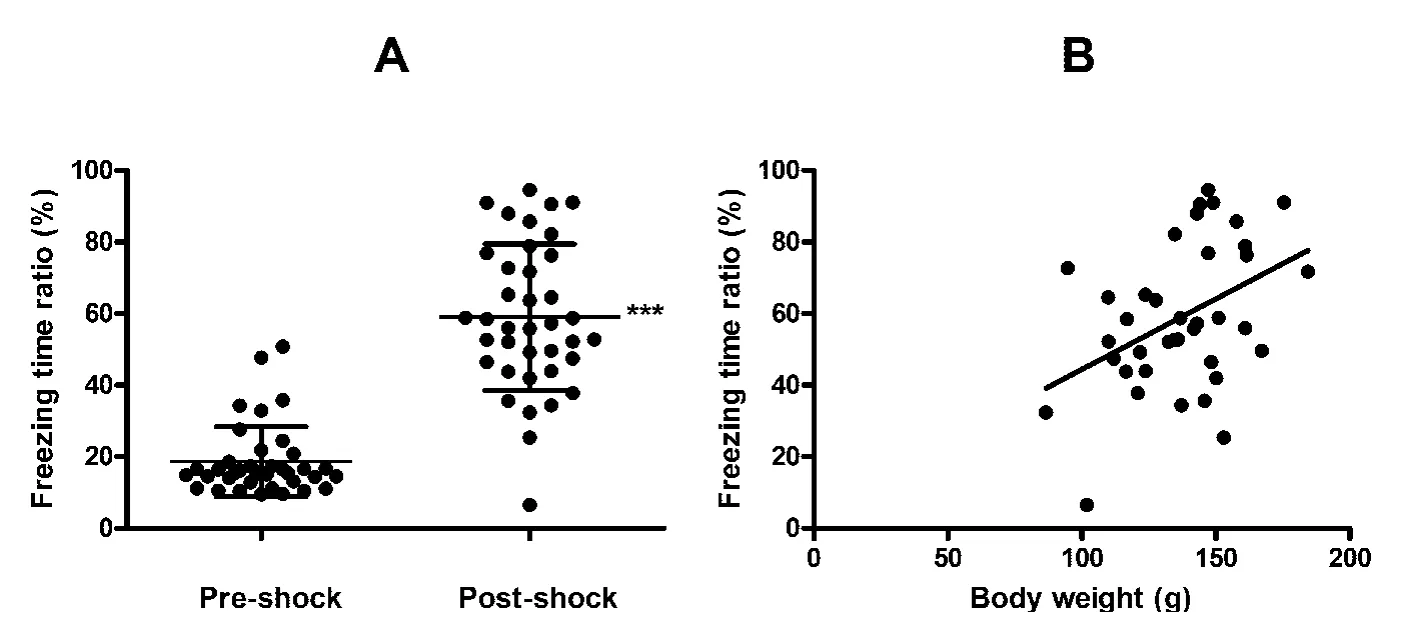
图1 声音-电击配对刺激对大鼠木僵时间百分比的影响
2.3 腹腔注射干预对模型大鼠体质量的影响分析木僵反应检测日2组模型大鼠体质量数据,重复测量双因素 ANOVA显示,测试间 F(4,48)=589.0,P <0.01;处理间 F(1,12)<1,P >0.05。提示两组大鼠的体质量均呈现增长,但两组间差异没有显著性意义。
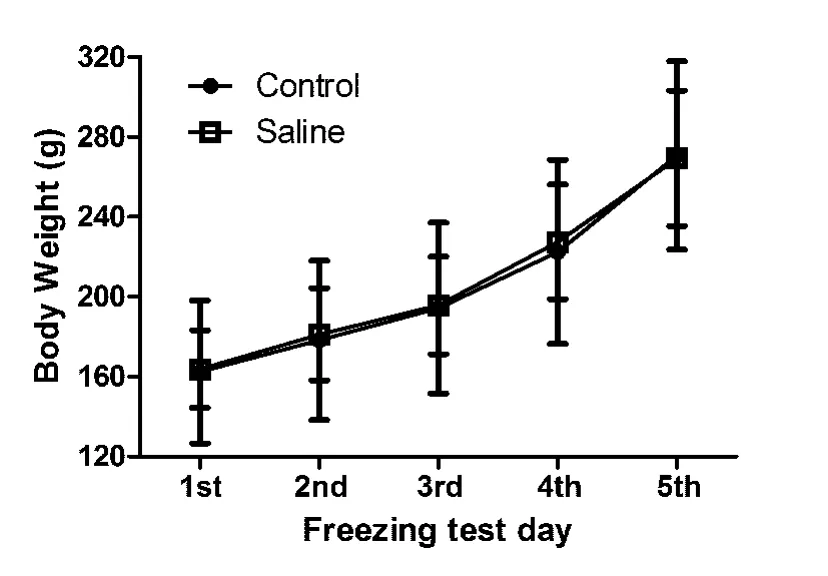
图2 腹腔注射(ip)干预对模型大鼠体质量的影响
2.4 腹腔注射干预对模型大鼠木僵反应的影响对模型制作后大鼠进行5次测试的木僵时间百分比数据(图3),两组分别进行单因素ANOVA分析,结果对照组的测试次间 F(4,30)=2.25,P >0.05,提示模型动物恐惧记忆的消退无显著性意义,PTSD模型有一定稳定性;而生理盐水组的测试次间F(4,30)=14.67,P <0.01,表明该组模型动物恐惧记忆有明显的消退。对干预后的4次测试木僵时间百分比数据进行重复测量双因素ANOVA分析显示,测试次间 F(3,36)=7.09,P < 0.01,处理组间 F(1,12)=4.83,P <0.05,提示 ip 生理盐水干预具有促进模型动物恐惧记忆消退的作用。
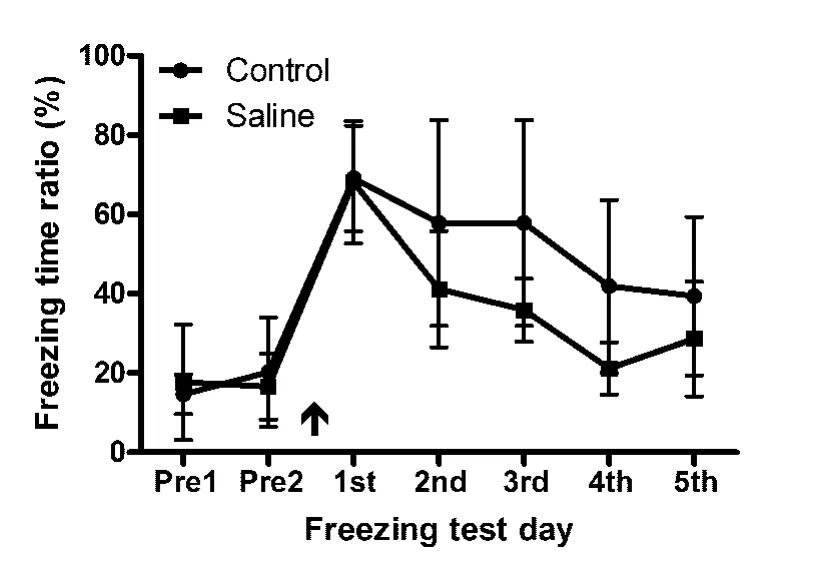
图3 腹腔注射干预对模型大鼠木僵时间百分比的影响
2.5 腹腔注射干预对模型大鼠空间学习记忆能力的影响2组大鼠Morris水迷宫测试的数据中,第1~7天各组定位航行实验的逃避潜伏期数据见图4A,其重复测量双因素ANOVA显示,测试日间F(6,72)=11.46,P <0.01,处理组间 F(1,12)<1,P>0.05,提示2组大鼠的Morris水迷宫空间学习能力差异无显著性意义。空间探索实验中,2组大鼠的穿台次数(图4B),两组 t检验:P>0.05,结果提示2组大鼠Morris水迷宫空间记忆能力差异无显著性意义。
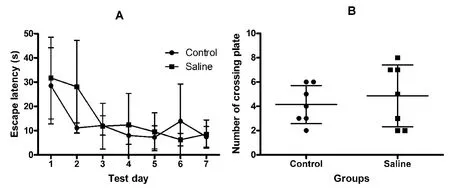
图4 腹腔注射干预对模型大鼠空间学习记忆能力的影响
3 讨论
制备重复性和稳定程度均较好的PTSD动物模型,是开展PTSD相关动物研究的基础,也是本文旨在探讨的首要问题。关于动物PTSD模型,尽管种类很多,仍没有能代表PTSD全部核心症状、理想的动物模型[13]。与创伤记忆相联结的条件性恐惧是PTSD最典型的症状之一,也是PTSD治疗的重点与难点,故通过电刺激形成条件性恐惧记忆是最常用的 PTSD 模型之一[3,6,13]。制备 PTSD 动物模型,特别是形成条件性恐惧记忆的模型,首先要考虑刺激的强度,应以能引起动物明确的恐惧反应又不对动物造成躯体伤害为目标。本文参考文献报道的刺激强度[4],并在预试过程中,反复根据不同年龄的大鼠进行电击强度的观察和相应调整,确定3 mA为有效的非条件刺激,能够较好地建立声音的条件刺激与足底电击的非条件刺激的联接。其次要考虑条件性恐惧的检测指标,应尽量避免检测操作的干扰和人为的主观影响。本文一方面采用计算机自动控制、红外监测、与环境隔音的恐惧监控系统检测大鼠的木僵反应,并采用木僵时间百分比作为观察指标。与造模前的基础数据进行对比,尽管不同动物的效果不一,甚至有的动物在造模处理后木僵时间百分比可以降低,但总体比较造模处理后木僵时间百分比明显升高,通过造模前后木僵时间百分比数据的分布情况,设定了木僵时间百分比≥50%为造模成功标准,其成功率为73.7%。最后更要考虑模型的稳定性,形成的条件性恐惧记忆至少要有较慢的消退速度,才能进行后续干预或治疗的试验。本文通过从造模处理后24 h到第15 d的观察(对照组),5次木僵时间百分比检测结果显示差异没有显著性意义,表明条件性恐惧记忆具有比较稳定的特性,为以后进行干预或治疗的研究提供了可靠的模型基础。
条件性恐惧记忆的PTSD模型是以经典的巴甫洛夫条件反射为基础的[6],条件性恐惧记忆是情绪性记忆的一种,情绪性记忆由杏仁核为中心的多个脑区共同作用产生[14]。经典巴甫洛夫条件反射性恐惧的中枢神经环路是以杏仁核为中心,岛叶、海马、边缘皮层以及小脑共同参与形成的[6,15]。条件性恐惧记忆的消退机制与内侧前额叶皮层(mPFC),尤其是腹内侧前额叶皮层(vmPFC)的功能激活密切相关[16]。已有研究显示vmPFC活动增强有助于条件性恐惧记忆的消退,参与消退记忆的巩固、保持与表达[5,8]。
PTSD的临床治疗目前主要有心理治疗和药物治疗两个方面。心理治疗主要是认知暴露疗法、心理疏导、行为治疗等[17]。药物治疗主要是用抗抑郁药(首选药是5-羟色胺再摄取抑制剂)减少多巴胺释放,使用抗惊厥药提升氨基丁酸(GABA)的功能,用抗焦虑药(如苯二氮艹卓类药物)改善GABA的功能从而调节多巴胺等递质释放[17-18]。由此可见,无论是在PTSD的机制研究,还是在PTSD的干预和治疗研究中,用药是经常需要采用的方法之一。鉴于用药等操作过程不仅对患者有安慰剂效应,即使在动物试验中也是一种刺激甚至是应激因子,对PTSD模型的影响也是进一步研究需要注意的问题。本实验采用腹腔注射这一模拟药物治疗中常采用的动物试验操作措施,来观察其对条件性恐惧记忆的影响。结果显示腹腔注射生理盐水干预即具有影响恐惧记忆消退的作用。尽管不能因此而认为生理盐水具有促进恐惧记忆消退的作用,但腹腔注射作为一种刺激或应激,对模型大鼠恐惧记忆有促进消退作用的可能性,不仅要求在类似的动物模型研究中必须考虑类似或相关因素的影响,严格对照实验设计,同时也提示类似的干预措施有可能会与相关治疗或干预方法产生相互影响。至于腹腔注射干预的作用机制,可能是由于阻断了恐惧记忆的再巩固。已有研究表明,恐惧记忆在提取时会出现消退和再巩固两种机制。消除恐惧记忆的方法可归结为增强恐惧记忆的消退以及抑制恐惧记忆的再巩固[7,19],这样在记忆被重新提取的再巩固的同时,施以行为或药物的干预措施,可能有助于消退恐惧记忆。
(致谢:王邦安高级实验师提供部分技术协助。)
[1] 王玉龙,谢伟,杨智辉,等.PTSD在中国的研究进展[J].应用心理学,2005,11(2):176 -180.
[2] 张娅玲,白艳秋,彭正午,等.创伤后应激障碍(PTSD)的生物学研究概述[J].现代生物医学进展,2011,11(1):172 -175.
[3] COHEN H,KOZLOVSKY N,ALONA C,et al.Animal model for PTSD:From clinical concept to translational research[J].Neuropharmacology,2012,62(2):715 -724.
[4] 王禾,廖维宏,吴宝明,等.创伤后应激障碍大鼠动物模型行为学表现及学习记忆功能的变化[J].中国临床康复,2004,3(10):1848-1850.
[5] 安献丽,王文忠,郑希耕.阻碍条件性恐惧记忆消退的原因分析[J].心理科学进展,2009,17(1):126 -131.
[6] JOHNSON LR,MCGUIRE J,LAZARUS R,et al.Pavlovian fear memory circuits and phenotype models of PTSD[J].Neuropharmacology,2012,62(2):638 -646.
[7] 王红波,安献丽,李幼红,等.干预条件性恐惧记忆表达的相关影响因素分析[J].心理科学进展,2010,18(5):718 -724.
[8] QUIRK GJ,GARCIA R,LIMA FG.Prefrontal mechanisms in extinction of conditioned fear[J].Biol Psychiatry,2006,60(4):337-343.
[9] 刘天雅,洪宗元.灌胃与腹腔注射对小鼠自主活动的影响[J].皖南医学院学报,2010,29(4):421 -423.
[10] JIN XC,MA CL,LI BM.The α2A-adrenoceptor agonist guanfacine improves spatial learning but not fear conditioning in rats[J].Acta Physiol Sin,2007,59(6):739 -744.
[11] VORHEESCV,WILLIAMSMT.Morris water maze:procedures for assessing spatial and related forms of learning and memory[J].Nature Protocols,2006,1(2):848 -858.
[12]秦雯,曲睿,汪萌芽.大鼠空间学习记忆能力测试的时反应量-效关系[J].皖南医学院学报,2010,29(6):462 -465.
[13]刘媛,王莉,伍亚民.创伤后应激障碍的实验动物模型[J].中国临床神经科学,2010,18(4):436 -439.
[14]唐向阳,汪凯,程怀东.情绪记忆的神经机制[J].临床神经病学杂志,2008,21(5):399 -400.
[15] KIM JJ,JUNG MW.Neural circuits and mechanisms involved in pavlovian fear conditioning:a critical review[J].Neurosci Biobehav Rev,2006,30(2):188 -202.
[16] PETERSJ,KALIVAS PW,QUIRK GJ.Extinction circuits for fear and addiction overlap prefrontal cortex[J].Learn Mem,2009,16(5):279-288.
[17]张田,傅安球.创伤后应激障碍的生物学影响因素及相关药物治疗的研究进展[J].东南大学学报(医学版),2011,30(4):649-652.
[18] DAVIS M,MYERS KM,CHHATWAL J,et al.Pharmacological treatments that facilitate extinction of fear:relevance to psychotherapy[J].NeuroRx,2006,3(1):82 -96.
[19] SCHILLER D,MONFILSMH,RAIO CM,et al.Preventing the return of fear in humans using reconsolidation update mechanisms[J].Nature,2010,463(7277):49 -53.
