地衣芽孢杆菌转化间二硝基苯为间硝基苯羟胺、间硝基苯胺和间苯二胺的研究
2012-07-28吕长维陶黎明徐文平
吕长维,陶黎明,徐文平
(1.上海师范大学生命与环境科学学院,上海 200234;2.华东理工大学药学院,上海 200237)
间二硝基苯的还原产物间苯二胺、间硝基苯胺都是重要的中间体,广泛应用于精细化工、制药、染料以及农药工业;而且由间苯二胺与苯二甲酰氯合成的耐高温芳香聚酰胺树脂和阻燃纤维具有许多特殊用途(如用于防护服、航空航天材料等[1]),因此需求量大增。目前工业化生产芳香胺主要是利用有机合成中的一个重要单元反应——芳香族硝基化合物的还原反应,实际生产中已有许多经典的方法,例如铁粉还原、碱性条件下用磺化物还原、水合肼还原、电解还原以及催化加氢还原等等[2,3],然而这些方法的反应过程需要高压、易燃氢气、有害溶剂或会发生重金属中毒等[4,5]。因此,高效安全地制备芳香胺依然是有机合成中的一个重要研究方向。
生物催化技术具有反应条件温和、专一性强等特点,受到越来越多的关注,并已广泛应用于制药和精细化工领域。已有许多文献报道了微生物降解环境中芳香族硝基化合物的研究[6,7]。Soojhawon等[8]利用AcinetobacterjuniiA8将对硝基苯酚、对硝基苯胺、对硝基甲苯、间硝基甲苯和2,4,6-三硝基甲苯等化合物在有氧条件下进行生物转化,最终降解为直链化合物。Li等[9]则利用啤酒酵母制备芳基羟胺,反应底物主要包括对二硝基苯、邻二硝基苯、对甲磺基硝基苯等。但迄今未见利用微生物对间二硝基苯进行转化的报道。
在筛选具有还原芳香族硝基化合物能力的微生物的过程中,发现了一批细菌和放线菌具有还原硝基的能力,特别是1株地衣芽孢杆菌CGMCC2280,可以以间二硝基苯为底物进行生物转化。作者在此对转化产物的分离、鉴定、转化影响因素和转化机制进行了研究。
1 实验
1.1 试剂和培养基
间硝基苯胺(纯度≥98%)、间苯二胺(纯度≥98%),美国Aldrich公司;邻二硝基苯(纯度≥98%),东京化成工业株式会社;邻硝基苯胺(纯度≥98.5%),上海国药集团化学试剂公司;间二硝基苯、间硝基苯羟胺、对二硝基苯、对硝基苯胺,纯度≥98%,常熟华泰化工厂;液相用甲醇、乙腈,色谱纯,美国Merck公司;葡萄糖、蔗糖,市售分析纯。
分离培养基Ⅰ(%):葡萄糖1,酵母提取物0.5,可溶性淀粉2,碳酸钙 1,N-amine 0.5,稀释5倍后使用。
分离培养基Ⅱ(%):可溶性淀粉0.5,葡萄糖0.5,蛋白胨0.1,酵母膏0.1,牛肉膏0.1。
发酵培养基(g·L-1):酵母浸膏10,蛋白胨10,氯化钠10,氯化钴0.005,磷酸氢二钾0.05,氯化镁0.005。
1.2 菌株的筛选和鉴定
将采集的土壤样品用水稀释后,涂布于分离培养基Ⅰ,28 ℃培养7 d后,挑选各单菌落分别培养于分离培养基Ⅱ。将配制好的间二硝基苯水溶液(200 mg·L-1)在100 ℃消毒20 min后,加入到预先配制并消毒的分离培养基Ⅱ中,使间二硝基苯终浓度为20 mg·L-1,倒入预先消毒的平皿中,待冷却凝固后,将上述分离的不同的菌种接种于平皿中。培养皿在暗室中37 ℃放置48 h。然后在每个平皿中分别加入13 mL 0.21%的三氯乙酸溶液和0.007%的亚硝酸钠溶液,室温放置20 min。再加入1 mL 0.5%的氨基磺酸铵溶液,室温下保温3 min。最后在每个平皿中加入5 mL 0.1%的N-(1-萘基)乙二胺二盐酸盐溶液,室温下仔细观察平皿中的菌落,将染上紫红色的菌株作为下一步复筛的备选菌[10]。
阳性菌株B.licheniformisCGMCC2280的培养特征、生理生化特征鉴定根据伯杰氏细菌鉴定手册[11]进行。DNA提取及16S rDNA的扩增和测序按文献[12]方法进行,将所测的16S rDNA序列与GenBank数据库中的已有序列进行分析比较,确定菌株的分类。
1.3 菌株的培养
将上述染色阳性菌株B.licheniformisCGMCC2280接种于LB培养基上,28 ℃培养2 d,将培养好的菌种接种到已消毒的发酵培养基中,250 mL摇瓶装量50 mL,于37 ℃、200 r·min-1摇床培养30 h左右。离心收集菌体,用磷酸缓冲溶液(50 mmol·L-1Na2HPO4/KH2PO4,pH值8.0)洗涤2次,然后用10 mL缓冲溶液混合均匀得静息细胞悬浮液,供生物转化用。
1.4 生物转化
先将过量的间二硝基苯结晶加入磷酸缓冲溶液中使其饱和。在100 mL锥形瓶中加入20 mL上述饱和缓冲溶液和0.5 g葡萄糖,搅拌溶解后再加入5 mL静息细胞悬浮液,在30 ℃下220 r·min-1摇床振荡转化20 h,离心(1000×g,15 min)除去菌体,上清液用于HPLC分析。同时设定无底物对照和无菌空白对照。
在转化反应时间进程实验中,在指定的时间取样0.1 mL,同样处理后进行HPLC分析。
在碳源影响实验中,以不加葡萄糖为空白对照,分别用等量的蔗糖、麦芽糖、果糖、乳糖代替葡萄糖。以3次独立实验(每个实验至少3个重复)的平均值为实验值。
1.5 HPLC分析
底物和产物的浓度测定采用HPLC法。
Agilent 1100型液相色谱仪,色谱条件:反相色谱柱(ODS C18,2.5 mm×20 mm,0.5 μm),流动相为甲醇-乙腈-水混合液(35∶15∶50,体积比),流速1 mL·min-1,检测波长235 nm,进样量20 μL。
1.6 中间体和产物的大量制备
将B.licheniformisCGMCC2280斜面菌种接种于装有300 mL已消毒LB培养基的1 L摇瓶中,于37 ℃、200 r·min-1摇床培养20 h,接种到装有10 L发酵培养基的自动发酵罐(BIOSTAT®C,B.Braun International,Germany)中,37 ℃下通气(1∶0.4,体积比)搅拌(400 r·min-1)培养24 h。发酵液用自动冷冻离心机(20PR-52D,HITACHI,Japan)离心(1000×g,15 min)后,将菌体悬浮在10 L转化液(含2%葡萄糖的磷酸缓冲溶液,pH值8.0)中,加入2.5 g间二硝基苯,在14 L自动发酵罐中36~38 ℃搅拌转化反应。0.5 h后取1 L反应液终止反应,加入1 L氯仿萃取2次,合并萃取液,低温减压(15 ℃,0.096 MPa)浓缩得到固体,用甲醇溶解后进一步用制备型HPLC[Shimadzu LC10A,甲醇-乙腈-水=35∶15∶50(体积比)]纯化,低温减压(15 ℃,0.096 MPa)浓缩后得到217 mg化合物A(纯度98.2%)。反应2 h后再取1 L反应液,同前操作,得到187 mg化合物B(纯度99.4%)。反应24 h后,用2.5 L乙酸乙酯萃取4次,合并有机相,减压浓缩得到1.27 g近无色固体,在甲醇-苯混合液(5∶1,体积比)中重结晶,得到纯度为98%以上的化合物C。
1.7 中间体和产物的结构鉴定
用LC-MS(Agilent LC/MSD)测定中间体和产物的质谱;用NMR(Varian INOVA 400 MHz)测定中间体和产物的氢谱和碳谱。
2 结果与讨论
2.1 菌株分离和鉴定
从500株菌中初筛出126株菌落染有紫红色(表明菌落在生长时可能具有将间二硝基苯还原成间硝基苯胺或间苯二胺的能力)的菌株,再经过液体发酵培养后进一步进行生物转化实验,确认19株菌株具有还原间二硝基苯的能力,其中1株菌株具有显著的还原能力。该菌株菌体呈杆状,培养36 h左右后产生芽孢,芽孢中生;营养琼脂平板上,初期菌落呈光滑状,后期呈列液状,边缘毛发褶皱。生理生化实验表明该菌革兰氏染色阳性,可水解明胶、淀粉,葡萄糖产酸,甲基红实验阳性,可耐受7%的氯化钠和60 ℃高温。16S rDNA(GenBank No.EU200968)分析表明,该菌与地衣芽孢杆菌的序列相似度为99%。综合其形态和生理生化实验结果判断该菌株属于地衣芽孢杆菌CGMCC2280(BacilluslicheniformisCGMCC2280)。
2.2 反应中间体和产物的结构鉴定
LC-MS显示化合物A分子量为154,1HNMR显示在苯环上有4个氢,各氢位移值和归属为:7.25(1H,s,2-H),7.46(1H,t,3J4-5=7.91,3J6-5=8.05,5-H),7.80(1H,d,3J=7.91,4-H),7.90(1H,d,3J=8.05,6-H),位于低场的有2个活泼氢。从而推断化合物A为间硝基苯羟胺。
化合物B和C分别与间硝基苯胺和间苯二胺标准品的保留时间一致;LC-MS分析表明,它们的分子量和碎片峰也与标准品相同,1HNMR数据也一致。从而确定化合物B和C分别为间硝基苯胺和间苯二胺。
各化合物的1HNMR数据见表1。
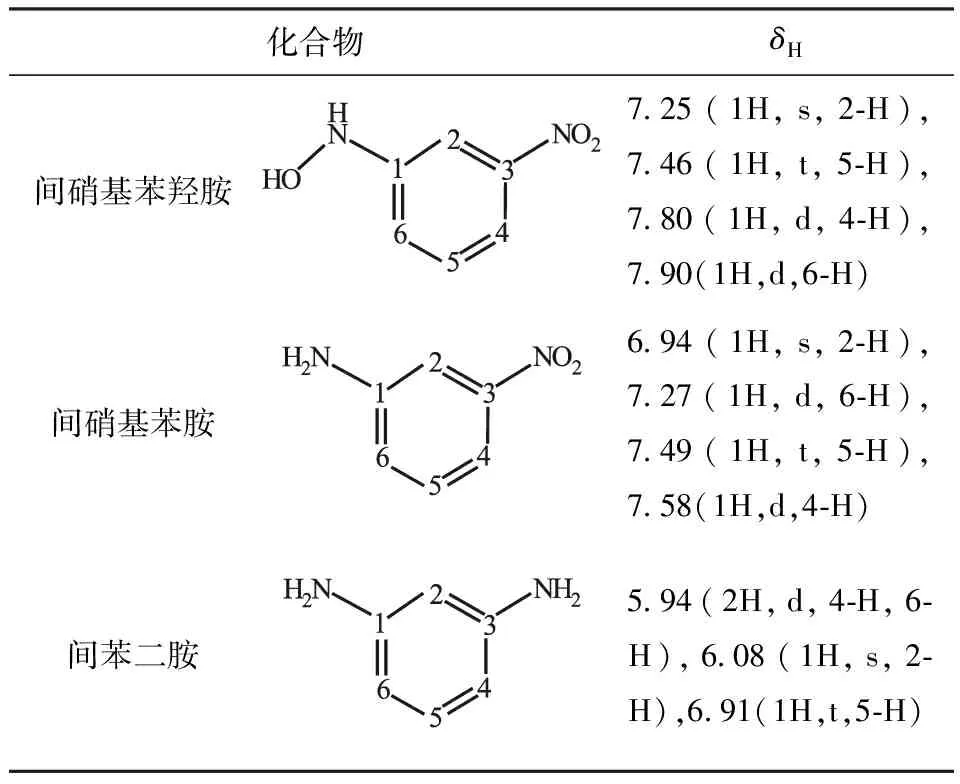
表1 中间体和产物的1HNMR数据
2.3 底物选择性
分别以间二硝基苯、间硝基苯胺、邻二硝基苯、邻硝基苯胺、对二硝基苯、对硝基苯胺6种化合物作为生物转化的底物,考察菌株的底物选择性,结果见表2。
由表2可看出,该菌株优先转化间位或邻位二硝基底物,很难转化对位二硝基底物。

表2 地衣芽孢杆菌对不同硝基化合物的选择性还原
注:转化率为被转化底物的毫摩尔数与加入底物的毫摩尔数之比,用HPLC测定
2.4 pH值和温度的影响
设定pH值为8.0、温度为26~42 ℃,每隔2 ℃为一个区间,振荡反应20 h后,液相测定被转化的底物量和产物的生成量,考察温度对转化率的影响,结果见图1。设定温度为37 ℃、pH值为4.5~10.0,振荡反应20 h后,液相测定被转化的底物量和产物的生成量,考察pH值对转化率的影响,结果见图1。

图1 pH值和温度对转化率的影响
由图1可看出,该菌株的最适反应pH值为7.5~9.0,最适反应温度为30~38 ℃。
2.5 糖类的影响
地衣芽孢杆菌CGMCC2280转化间二硝基苯反应体系各物质浓度与转化时间的关系见图2。
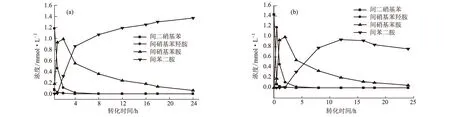
a.加2%葡萄糖 b.未加葡萄糖
由图2可知,转化液中添加2%的葡萄糖,有利于地衣芽孢杆菌对间二硝基苯的还原作用。在含有葡萄糖的转化反应体系中,转化反应初速度明显比不加葡萄糖时要快,转化4 h后产物间苯二胺的浓度仍然不断增大,但增幅趋缓(图2a);在不加葡萄糖的转化反应体系中,转化反应初速度较慢,产物间苯二胺的最高浓度较低,尤其是反应14 h后,浓度反而不断减小(图2b)。说明间二硝基苯的还原作用需要葡萄糖代谢提供能量和还原力,但该菌在没有葡萄糖存在的情况下,可直接通过进一步降解产物间苯二胺而维持反应所需的能量。
2.6 溶剂对反应进程及反应产物的影响
研究发现,甲醇、乙醇或丙酮的浓度超过20%时,可彻底终止转化反应。本实验以丙酮为反应抑制剂终止转化反应,在不同时间加入丙硐对转化反应的影响见表3。
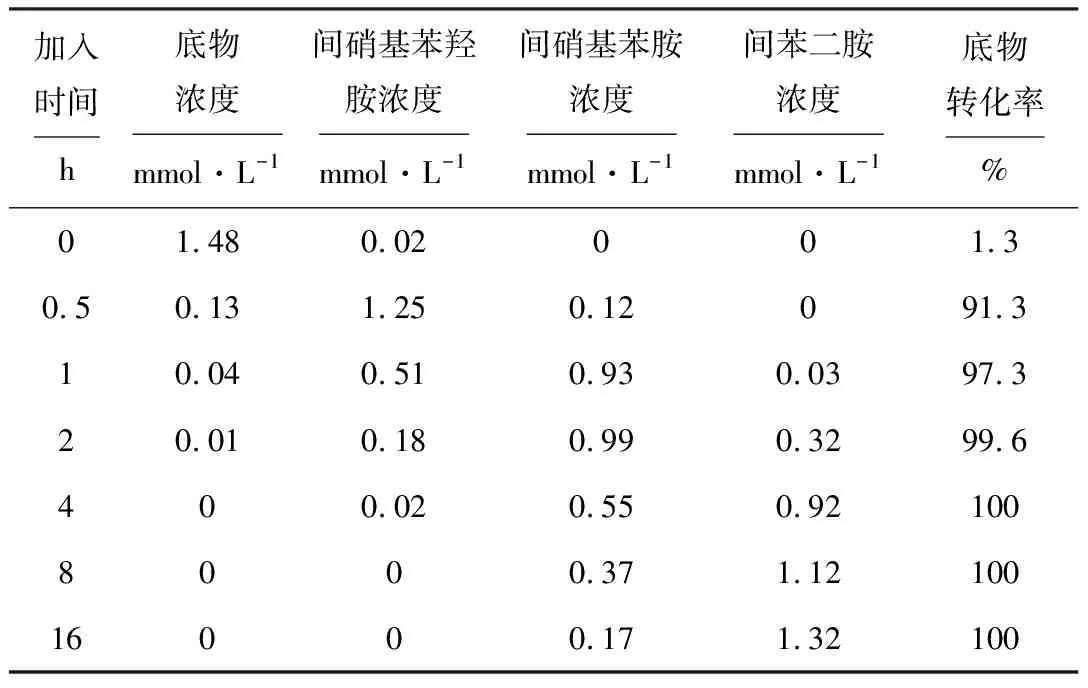
表3 不同时间加入丙酮对转化反应的影响
注:底物初始浓度1.5 mmol·L-1;转化率为减少的间二硝基苯毫摩尔数与投入反应的间二硝基苯的毫摩尔数之比,用HPLC测定
由表3可看出,在反应开始时加入丙酮,底物转化率为1.3%,微量的间硝基苯羟胺可瞬间生成;在反应0.5 h时加入丙酮,底物转化率为91.3%,中间产物间硝基苯羟胺占91.2%,而间硝基苯胺只占产物的8.8%,无间苯二胺生成;在反应2 h时加入丙酮,底物基本被转化,转化率达99.6%,主要产物为间硝基苯胺(占66.4%),间硝基苯羟胺比例已降至12.1%,而间苯二胺则由0%上升至21.5%;在反应8 h时加入丙酮,主要产物变为间苯二胺(占75.2%),间硝基苯羟胺比例降至0%,而间硝基苯胺比例也降至24.8%。因此,可以确定地衣芽孢杆菌还原间二硝基苯的转化过程是先形成间硝基苯羟胺,再形成间硝基苯胺,最后形成间苯二胺,如图3所示。

图3 地衣芽孢杆菌CGMCC2280转化间二硝基苯的生物转化过程
2.7 讨论
目前,关于微生物进行芳香族硝基还原研究的报道主要是集中于环境中芳香硝基化合物的微生物降解,如对三硝基甲苯(TNT)、硝基苯(MNT)以及2,4-二硝基甲苯(DNT)的降解研究[13,14]。Schenzle等[15]利用Ralstoniaeutropha菌产生的3NP硝基还原酶,对2-氯-5-硝基酚进行化学选择性还原,形成相应的羟胺化合物,并对硝基苯、间二硝基苯、均三硝基苯、13种硝基酚、MNT、DNT和TNT等38种化合物进行了底物适应性比较,发现该酶对2-氨基-4-硝基甲苯的还原活性最高,与NADPH酶的相对活性为219;而对间二硝基苯的相对活性只有12。Li等[9]则利用啤酒酵母将对二硝基苯、邻二硝基苯、对甲磺基硝基苯等转化为羟胺,发现产物的比例与酵母的使用量有关,当反应底物浓度为100 mg·(100 mL)-1时,使用5 g干重的酵母可以使对二硝基苯近100%地还原为对硝基苯羟胺和对硝基苯胺,两者的比例为95∶5,但对间二硝基苯的转化作用未提及。Li等[16]还利用葡萄皮细胞进行化学选择性还原芳香族硝基化合物来制备相应的羟胺,进行反应的化合物有8-硝基-1,3-二氧基-苯基[de]吡喃、8-硝基-1,3-二氧基-苯基[de]-N-特丁基异喹啉、8-硝基-1,3-二氧基异吲哚、7-硝基-1,3-二氧基异吲哚、对二硝基苯和2-氰基-4-硝基苯腈,经过6 d的转化,前4种化合物转化为羟胺均有较高的转化率,而对后2种则无转化效果,对间二硝基苯的转化作用也未提及。本实验首次报道了利用地衣芽孢杆菌还原间二硝基苯来制备间硝基苯羟胺、间硝基苯胺和间苯二胺的方法。而且根据丙酮对反应的抑制作用原理,通过在不同的反应时间添加丙酮终止反应以控制反应进程,可以得到不同的反应产物,以适应不同的转化产物要求。根据反应进程可以确定本研究中地衣芽孢杆菌还原间二硝基苯的转化过程是先形成间硝基苯羟胺,再进一步形成间硝基苯胺,这一过程与其它芳香胺的形成原理基本一致[7,17~19]。
Blackie等[20]在研究酵母菌还原硝基和亚硝基化合物的过程中,发现反应条件不同可以发生2种不同类型的反应,第一类型的反应中加入糖可促进胺类化合物的生成。Li等[9]在制备芳羟胺的反应体系中也加入了2%的葡萄糖,但并未对葡萄糖的影响作说明。尹萍等[21]筛选了17株能够降解TNT的酵母和类酵母菌,并发现培养基中加入一定量的碳、氮源可以促进降解。李湛江等[22]利用吉氏拟杆菌和尿拟杆菌与葡萄糖共代谢降解硝基苯,但在不加葡萄糖的情况下降解活性为零,认为这是由于这些菌株不能以硝基苯为唯一碳源的缘故。而本实验中的地衣芽孢杆菌即使在没有葡萄糖的情况下,开始也能将底物迅速降解,只是随后将部分产物降解,以维持菌体活力而导致产物生成率下降。因此,在利用地衣芽孢杆菌CGMCC2280转化制备间硝基苯胺,尤其是间苯二胺的时候,需要加入少量的葡萄糖等碳源,以提高转化率,同时可以避免产物被进一步降解。
根据B.licheniformisCGMCC2280的转化进程,可以清楚地发现该菌在转化间二硝基苯的过程中,将间二硝基苯还原为间硝基苯羟胺是一步快速的酶促反应,无论葡萄糖是否加入,都不影响这步反应的进行。但是正如溶剂影响实验中所揭示的那样,由于丙酮对细胞间二硝基苯还原酶具有抑制作用,因此在各反应阶段加入丙酮等溶剂后,即可终止反应。据此在转化反应进行0.5 h后加入丙酮溶剂终止反应,可以很方便地得到中间产物间硝基苯羟胺,而不会产生过多的间硝基苯胺和间苯二胺,这也为制备采用化学合成手段难以得到的间硝基苯羟胺提供了一条新的途径。
Li等[9]认为酵母菌对底物的选择性与苯环上所连接基团的特性有关,基团吸电性越强,转化越容易进行;如果是供电子基团则转化无法进行。但是本实验结果却表明底物选择性与基团的吸电性没有显著的相关性,如邻二硝基苯和对二硝基苯的电子云分布相似,但地衣芽孢杆菌CGMCC2280对两者的转化率却有很大的差别;即使对邻硝基甲苯这样有供电子基团的化合物,该菌依然具有很好的转化活性(数据未列出)。这些结果表明地衣芽孢杆菌CGMCC2280对底物的选择性主要与化合物的空间结构有关。
3 结论
从土壤中筛选得到1株转化间二硝基苯的芽孢杆菌,经生理生化实验及16S rDNA序列分析,确定其为地衣芽孢杆菌CGMCC2280。对含间二硝基苯的菌体转化液在不同时间取样,分离纯化得到化合物A、B和C,通过LC-MS和1HNMR分析,同时与标准品对照,确定化合物A、B和C分别为间硝基苯羟胺、间硝基苯胺和间苯二胺。底物特异性表明,该菌对间二硝基苯和邻二硝基苯的底物转化率10 h达到98%以上,但对对二硝基苯的底物转化率却不到10%。转化液中葡萄糖具有促进间二硝基苯还原的作用,在没有葡萄糖存在的情况下,转化反应速度较慢,且反应后期反应产物间苯二胺会进一步降解。在转化反应的不同时间加入丙酮终止反应并进行产物分析,发现该菌还原间二硝基苯的转化过程是先形成间硝基苯羟胺,再形成间硝基苯胺,最后形成间苯二胺。
(致谢:感谢华东理工大学李忠教授在核磁共振测定方面的帮助!感谢上海南方农药研究中心陆迪生先生在LC-MS测定中给予的帮助!)
参考文献:
[1] 刘迎新,陈吉祥,张继炎.间苯二胺生产工艺研究进展[J].精细石油化工,2003,18(4):53-56.
[2] Mizuta H,Nishimura T,Wada M,et al.Preparation of highly purem-phenylenediamine[P].JP 05 331 113,1993-12-14.
[3] Desai D G,Swami S S,Hapase S B.Rapid and inexpensive method for reduction of nitroarenes to anilines[J].Synthesis Communication,1999,29(6):1033-1036.
[4] Tafesh A M,Beller M.First selective reduction of aromatic nitro compounds using water soluble catalysts[J].Tetrahedron Letters,1995,36(51):9305-9308.
[5] 周海滨,陈宏博.高纯度间苯二胺的制备[J].染料工业,2002,39(1):41-44.
[6] Kulkarni M,Chaudhari A.Mircobial remediation of nitro-aromatic compounds:An overview[J].Journal of Environmental Management,2007,85(2):469-512.
[7] McCormick N G,Cornell J H,Kaplan A M.Identificaiton of biotransformation products from 2,4-dinitrotolunene[J].Applied and Environmental Microbiology,1978,35(5):945-948.
[8] Soojhawon I,Lokhande P D,Kodam K M,et al.Biotransformation of nitroaromatics and their effects on mixed function oxidase system[J].Enzyme and Microbial Technology,2005,37(5):527-533.
[9] Li F,Cui J N,Qian X H,et al.A novel strategy for the preparation of arylhydroxylamines:Chemoselective reduction of aromatic nitro compounds using bakers′ yeast[J].Chemical Communications,2004,4(20):2338-2339.
[10] Rafil F,Franklin W,Heflich R H,et al.Reduction of nitroaromatic compounds by anaerobic bacteria isolated from the human gastrointestinal tract[J].Applied and Environmental Microbiology,1991,57(4):962-968.
[11] Breed R S,Murray E G D,Smith N R.Bergey′s Manual of Determinative Bacteriology[M].Baltimore:Williams & Wilkins Co.,1957:619-620.
[12] Woo P C,Lau S K,Fung A M,et al.Gemella bacteraemia characterised by 16S ribosomal RNA gene sequencing[J].Journal of Clinical Pathology,2003,56(9):690-693.
[13] Spanggord R J,Spain J C,Nishino S F,et al.Biodegradation of 2,4-dinitrotoluene by aPseudomonassp.[J].Applied and Environmental Microbiology,1991,57(11):3200-3205.
[14] Park H S,Lim S J,Chang Y K,et al.Degradation of chloronitrobenzenes by a coculture ofPseudomonasputidaand aRhodococcussp.[J].Applied and Environmental Microbiology,1999,65(3):1083-1091.
[15] Schenzle A,Lenke H,Spain J C,et al.Chemoselective nitro group reduction and reductive dechlorination initiate degradation of 2-chloro-5-nitrophenol byRalstoniaeutrophaJMP134[J].Applied and Environmental Microbiology,1999,65(6):2317-2323.
[16] Li F,Cui J N,Qian X H,et al.Highly chemoselective reduction of aromatic nitro compounds to the corresponding hydroxylamines catalysed by plant cells from a grape(VitisviniferaL.)[J].Chemical Communications,2005,5(14):1901-1903.
[17] Kinouchi T,Ohnishi Y.Purification and characterization of 1-nitropyrene nitroreductases fromBacteroidesfragilis[J].Applied and Environmental Microbiology,1983,46(3):596-604.
[18] 周集体,黄丽萍,王竞,等.芳香族硝基化合物生物降解代谢研究现状与展望[J].大连理工大学学报,2000,40(Z1):46-54.
[19] Ang E L,Zhao H M,Obbard J P.Recent advances in the bioremediation of persistent organic pollutants via biomolecular engineering[J].Enzyme and Microbial Technology,2005,37(5):487-496.
[20] Blackie J A,Turner N J,Wells A S.Concerning the baker′s yeast (Saccharomycescerevisiae) mediated reduction of nitroarenes and other N-O containing functional groups[J].Tetrahedron Letters,1997,38(17):3043-3046.
[21] 尹萍,白逢彦,周培瑾.降解三硝基甲苯的酵母菌和类酵母菌的研究[J].微生物学报,1998,38(4):295-299.
[22] 李湛江,韦朝海,任源,等.硝基苯降解菌生长特性及其降解活性[J].环境科学,1999,20(5):20-24.
