利用羟胺实现城市污水短程硝化最优投加点选择
2021-09-03徐昊天张树军彭永臻北京工业大学城镇污水深度处理与资源化利用技术国家工程实验室北京004北京城市排水集团有限责任公司科技研发中心北京000
徐昊天 ,张树军 ,杜 睿 ,彭永臻 * (.北京工业大学,城镇污水深度处理与资源化利用技术国家工程实验室,北京004;.北京城市排水集团有限责任公司科技研发中心,北京 000)
传统生物污水处理技术——硝化/反硝化是目前处理城市生活污水的主要方式[1].而我国城市污水普遍碳氮比(C/N)较低,传统城市污水处理厂不仅需要巨大曝气能耗[2-3],往往需要投加大量外加碳源,剩余污泥产量大且可能造成二次污染.另一方面,污水排放标准不断提高,污水处理能耗急剧增加[4].短程硝化/反硝化工艺是污水处理节能降耗的重要途径[5].短程硝化过程是利用氨氧化菌(AOB)和 NO2--N氧化菌(NOB)在活性污泥法动力学特性上存在的生化反应固有差异,富集AOB并抑制NOB,控制NH4+-N仅氧化为NO2--N而不被继续氧化为硝态氮(NO3--N)[6-7].目前实现短程硝化的常用手段有高温[8]、低溶解氧(DO)[9]、基于pH值及DO等参数的实时控制策略[10]、游离亚硝酸抑制NOB[11-12]、短污泥龄(SRT)[13]等.然而,针对低C/N、低温、水质波动大的城市污水,现有方法仍难以快速启动与稳定维持短程硝化过程[14-15].研究发现,投加羟胺作为 NOB抑制剂可以启动短程硝化,具有操作简便和较高 NO2--N积累效率的优势[13,16].Okabe 等[17]利用 8.25mg/L 羟胺,在模拟废水中实现了短程硝化,最大 NO2--N生成率达到1.12kgN/m3/d.Xu等[18]在SBR系统中投加10mg/L的羟胺,快速实现了短程硝化,NO2--N积累率达到99.8%.
然而,羟胺具有一定生物毒性,过量投加会同时抑制AOB与NOB活性[13,19].因此,投加方式不当可能会导致硝化效果不理想,甚至破坏系统硝化性能.有研究表明,羟胺作为一种还原性物质,易在碱性条件下被氧化[20-22].那么,好氧硝化过程投加羟胺降低其对NOB的抑制效果,以及如何降低其对AOB活性的不利影响仍有待探究.本研究通过批次试验,探究了有氧和缺氧时间对羟胺抑制作用的影响,确定了可优化的投加点;并通过长期对比试验,考察了缺氧/好氧(A/O)模式下运行的SBR系统中实现短程硝化的最优羟胺投加点及短程硝化效果.
1 材料方法
1.1 试验装置
本研究中,批次试验采用有效容积1L的反应装置,配有曝气设备和pH/DO在线检测设备,通过磁力搅拌器充分混合;长期试验采用有效容积为 7L的SBR,(图 1).SBR 每天以缺氧/好氧(A/O)模式运行(4周期/天),每个周期(6h)运行时序如下:缺氧反应30min,好氧反应 2h,沉淀(30min),排水(10min),,排水比50%. SBR运行图例见图2.
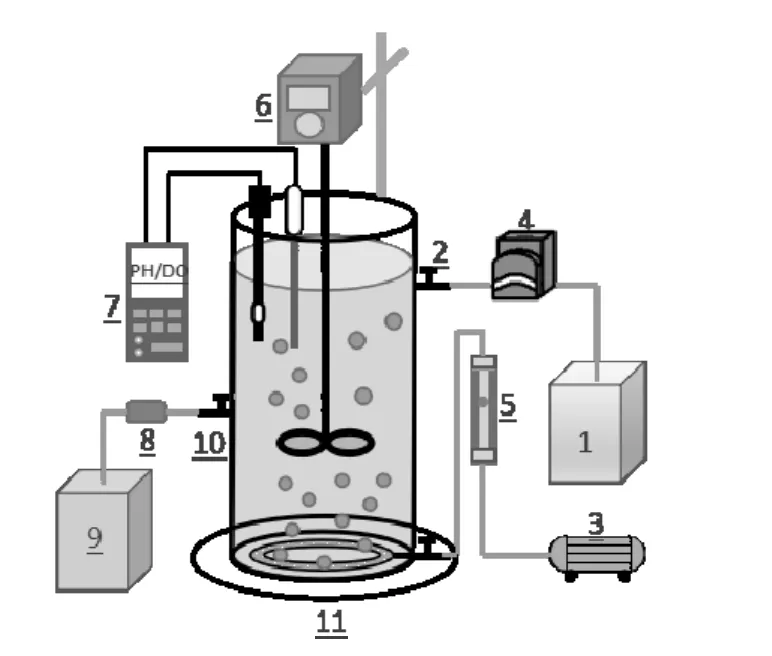
图1 SBR装置示意图Fig.1 Schematic diagram of SBR
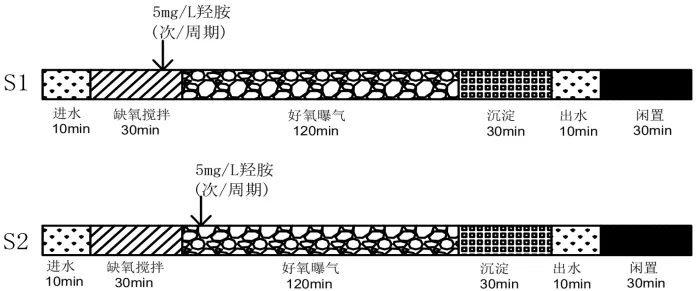
图2 SBR运行模式示意图Fig.2 The operational mode of SBR
1.2 试验用水与污泥
长期试验用水采用实际生活污水,取自北京高碑店污水处理厂初沉池出水,其水质如下:NH4+-N 27.8~39.8mg/L;NO2--N、NO3--N 0~0.2mg/L;COD 110~140mg/L.
批次试验用水采用在自来水中加入一定质量制成氯化铵(NH4Cl)的人工合成废水,其中 NH4+-N 40mg/L;NO2--N 0~0.1mg/L;NO3--N 0~0.1mg/L.
批次试验以及长期试验接种污泥来自北京高碑店污水处理厂曝气池污泥,污泥浓度(MLSS)约为8000mg/L;接种污泥具有良好硝化性能,该厂稳定运行期间平均出水 NH4+-N<1.0mg/L,NO2—N<1.2mg/L,COD<65mg/L.
1.3 羟胺投加方式对NOB抑制作用批次试验与长期试验
批次试验探究有氧和缺氧时间对羟胺抑制NOB效果的影响,确定羟胺投加点.
(1)将全程污泥洗泥后置于编号为P1、P2和P3的3组容积为1L的锥形瓶中待使用.根据相关文献[23]配置5mg/L羟胺,将其分别置于编号为A1、A2、A3的烧杯中并控制其溶解氧分别为 0、3、8mg/L.均处理5分钟后,人工废水与羟胺对应加入P1、P2、P3中,同时开始曝气90min.
(2)将全程污泥洗泥后置于编号为H1、H2、H3、H4的4组容积为1L的锥形瓶中待使用.将5mg/L羟胺与配水对应加入 4个锥形瓶,并设置不同的缺氧反应时间分别为 0、1、5、15min.缺氧反应结束后开始曝气90min.
长期试验采用2组相同SBR装置(S1与S2),运行模式如1.1所述.启动初期MLSS为(4000±100) mg/L,不主动排泥,每个周期投加浓度为5mg/L羟胺,S1系统在缺氧段(A段)末投加,S2在好氧段(O段)初投加,探究以不同羟胺投加点的短程硝化系统长期运行效果.
1.4 试验测量方法
本试验中NH4+-N、NO2--N、NO3--N分别采用纳氏试剂分光光度法、N-(1-萘基)-乙二胺分光光度法、麝香草酚分光光度法测定.MLSS、MLVSS采用重量法.pH值、DO、温度由 pH/DO分析仪(Multi 3420,WTW)测得;qPCR采用 ABI7300实时定量仪检测,以每克干污泥中的拷贝数代表指定检测菌的含量,其全菌、AOB、NOB的特定引物对及序列见表1.

表1 QPCR扩增指定菌的特异基因、引物及序列Table 1 QPCR amplification of specific genes, primers and sequences of designated bacteria

2 结果与分析
2.1 缺氧和好氧条件下羟胺对硝化菌的抑制情况
批次试验利用不同DO浓度梯度对羟胺进行处理,控制曝气时间5min,并设置空白组对照.旨在观察缺氧和好氧条件处理后的羟胺对AOB与NOB活性抑制的影响,见图3.
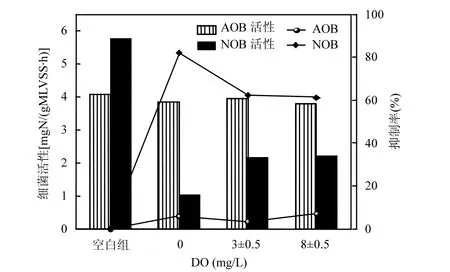
图3 不同DO环境下NH2OH对AOB和NOB活性影响Fig.3 The activity of AOB and NOB as well as the reducing ratio of their activities after adding NH2OH under different DO conditions
在不投加羟胺的情况下,AOB活性为 4.08mgN/(gMLVSS·h),NOB 的活性为 5.75mgN/(gMLVSS·h),污泥具有较好的氨氧化和NO2--N硝化性能.投加羟胺后,不同DO浓度下的AOB活性受羟胺抑制程度较小,为(8±0.6)%.有研究发现,在羟胺在 0~5mg/L 范围内,不同羟胺浓度对AOB活性无明显影响,而随着羟胺浓度的增加,NOB活性受抑制程度增大[24-25].其原因可能是,较NOB而言,AOB具有更稳定的基因结构以及具有包括代谢转换、群体感应等较复杂的生理学特性优势,使其对于恶劣条件的抵抗能力与适应能力强于NOB[16].因此,改变羟胺的投加条件,浓度为 5mg/L 的羟胺对于AOB也不会造成活性上的不利影响.
对于NOB而言,在DO为0,3,8mg/L的条件下,其活性分别下降为 1.04,2.16,2.23mgN/(gMLVSS·h),说明羟胺可以有效抑制NOB活性.而DO为0条件下的P1中NOB的活性明显低于DO为3,8mg/L条件下的P2、P3中NOB活性.其中,P1中NOB活性降低比例为81.9%,相比P2、P3中NOB活性降低比例高出约(20±0.5)%.然而,P2、P3中 NOB的活性相对一致,NOB活性降低比例均为(61±0.7)%.推测其原因是羟胺在DO存在环境下,与之发生了氧化还原反应[20-22],或自身歧化反应[26-29].从而将羟胺转化为了其他物质,影响了羟胺本身所起到的抑制效果(包括毒性[13]以及作为反应中间产物被引入,导致平衡被破坏所带来的影响[19]).可见,在投加过程中,低DO环境甚至缺氧环境条件下,NOB活性较AOB受抑制作用更强,从而提高短程硝化过程NO2--N积累率.Nitrospira在活性污泥中具有抵御不良环境的能力[34-35].沈琛等[36]研究表明,在较短时间内(5min)羟胺对Nitrospira抑制作用不大,推测羟胺主要在好氧阶段发挥其抑制作用.Wan[37]指出异样微生物对于羟胺具
2.2 不同缺氧反应时间下羟胺对 AOB/NOB的抑制情况
批次试验旨在探究在确定缺氧段投加羟胺方案后,考察缺氧反应时间对羟胺抑制 AOB与 NOB活性抑制的影响(图 4).结果表明,对照组中 AOB活性为 4.13mgN/(gMLVSS·h),NOB 活性为 5.66mgN/(gMLVSS·h),可见活性均良好.在投加羟胺后,NOB 的活性受到明显抑制.其中,H2与H3中NOB活性受到抑制程度较大,缺氧时间分别为1min和5min时,NOB活性降低比例分别为81.1%和79.3%.而H1与H4中NOB活性受抑制程度较小,当缺氧反应时间分别为0和15min时,NOB活性降低比例为66.7%和56.1%.

图4 不同缺氧反应时间下NH2OH对AOB、NOB活性的影响Fig.4 The effect of NH2OH on AOB and NOB activities as well as the reducting ratio of their activities under different anoxic reaction time
陈佼等[19]利用 0.5mmol/L羟胺,在人工快渗系统(CRI)实现的短程硝化系统中 NAR大于 65%;NH4+-N去除率保持90%以上,而利用1.0mmol/L羟胺的对照组中NAR约为60%;NH4+-N去除率小于30%.结合本文结果再次表明羟胺浓度对AOB活性抑制程度具有较大影响,羟胺浓度较低时,AOB、NOB受选择性抑制程度不同[30].
因此,为实现NOB活性抑制的条件下尽可能减少羟胺对AOB活性的抑制,通过探究AOB与NOB活性降低比例的差值推测适宜的缺氧反应时间.由图3可知,缺氧反应时间为 1min时,NOB活性降低比例最大,为81.1%;AOB活性降低比例为 10.1%,其差值为 70.9%;缺氧反应5min时,NOB、AOB活性降低比例的差值为63.1%,均高于不进行缺氧反应而直接进行曝气的羟胺中两种硝化菌的活性降低比例差值(50.9%).有研究指出[31],羟胺具有较强的反应活性,体系中的条件(DO、pH值、温度等)均会影响羟胺的稳定性及其各种代谢途径.Kim等[32]在生物膜反应器中利用系统FA浓度为3mg/L实现短程硝化,需要控制DO浓度保持0.5mg/L以下;Fernandez[33]指出DO过量会提高硝化菌对于FA抑制的耐受性.推测在投加羟胺初期引入大量DO会使羟胺自身被消耗,NOB受抑制程度降低,从而表现出更强的耐受能力.因此,本文结论表明,控制适宜缺氧时间使羟胺充分发挥对 NOB活性的抑制作用对短程硝化硝化具有重要作用:缺氧反应时间过长(15min以上)不但不会进一步提高对NOB活性的抑制效果,反而会影响羟胺本身对 NOB活性的抑制.有研究认为,有差异性响应机制,结合本文结果表明,过长的缺氧时间可能导致羟胺发挥作用之前被环境中异养微生物所代谢分解,使得其在好氧阶段对NOB活性抑制下降.
2.3 不同羟胺投加方式下短程硝化稳定性与菌群活性变化
结合批次实验,确定两个不同投加时间点,分别为A段末5min之内和O段初,开展长期试验,探究两种羟胺投加方式对于短程硝化系统长期运行效果的影响.
如图所示,第Ⅰ阶段未添加羟胺时 SBR系统内氮素污染物的转化情况.由图可知,该阶段以全程硝化为主,出水中含有大量的NO3--N和极少量未被氧化的NH4+-N.从第Ⅱ阶段开始,在S1、S2反应器的A段末5min内与O段初两个投加点投加5mg/L羟胺.此时S1与S2在投加羟胺后几天内均迅速出现较高的NAR,连续投加3d后,S1中约为95.6%,S2中约为100%.而S1中NH4+-N去除率依然保持在较高水平并维持了8d,约为98.8%.
相比之下,S2中 NH4+-N去除率自投加羟胺后出现骤降,由99.5%降低至36.3%.从第Ⅲ阶段开始停止投加羟胺进入维持阶段,观察S1与S2中氨氧化能力的恢复情况以及短程硝化过程维持情况.此外,由于实际进水氨氮含量较为波动,导致出现的过曝气现象破坏了短程硝化效果[38-39],S1在阶段Ⅲ的第15d从出水中检测到NO3--N,并逐渐累积,说明NOB活性逐步恢复,短程硝化逐渐恶化.阶段Ⅲ第 20d,NAR<90%.而 S2在阶段Ⅲ的第 4d出水中检测到NO3--N, NAR约为85.95%,与S1阶段Ⅲ比较,NAR出现更快降低,短程硝化系统仅维持了 4d.在阶段Ⅲ的第35d,S1中NAR约为44.1%,ARE约为84.0%.S2中NAR仅为11.7%,ARE也降低为69.75%.对比可知,在A段末5min内投加点每周期投加5mg/L羟胺可以迅速实现短程硝化,也可保持较高的氨氮去除率.即使在过量使用羟胺的情况下,A段末5min内投加点投加羟胺的短程硝化系统可以维持相对较长的时间,提高了后续系统的稳定性.

图5 试验不同阶段的氨氮、亚硝态氮和硝态氮浓度,氨氮去除率以及亚硝积累率的变化Fig.5 Changes of ammonia, nitrite, and nitrate concentrations,ARE and NAR in different stages
为了探究 S1、S2分别搭建的短程硝化系统的区别,进一步考察S1、S2在运行阶段Ⅱ内典型周期的氮素变化规律(图6).结果表明,S1、S2均具有良好的短程硝化效果,反应过程中出现高水平的 NO2--N积累.其中,S1系统的 NAR最高达到 98.4%,S2中NAR为 98.9%.S1具有较高的 NH4+-N去除率,NH4+-N几乎全部转化为NO2--N,过程中NO3--N含量极低.而S2中在投入羟胺以后,NH4+-N几乎未进行转化,NH4+-N去除率为 2.3%.在相关文献[13]中指出,短程硝化分两步进行,首先 NH4+-N 在氨单加氧酶(AMO)的作用下转为羟胺,进而在羟胺氧化还原酶(HAO)的作用下转化为NO2--N,而后NOB在亚硝酸盐氧化还原酶(NXR)作用下将其转化.Harper[40]等研究认为,AOB由于细胞内 HAO的存在,从而比NOB具有更好抵御羟胺毒性的能力.在S2中氨氮几乎未得到降解,但亚硝态氮依然得到积累,说明AOB中HAO较AMO更能抵御羟胺产生的毒性作用,羟胺的加入抑制了 AMO活性,使氨氮无法得到转化,使得S2中氨氧化能力受到限制.推断S2中亚硝态氮积累为所投加羟胺自身的氧化.

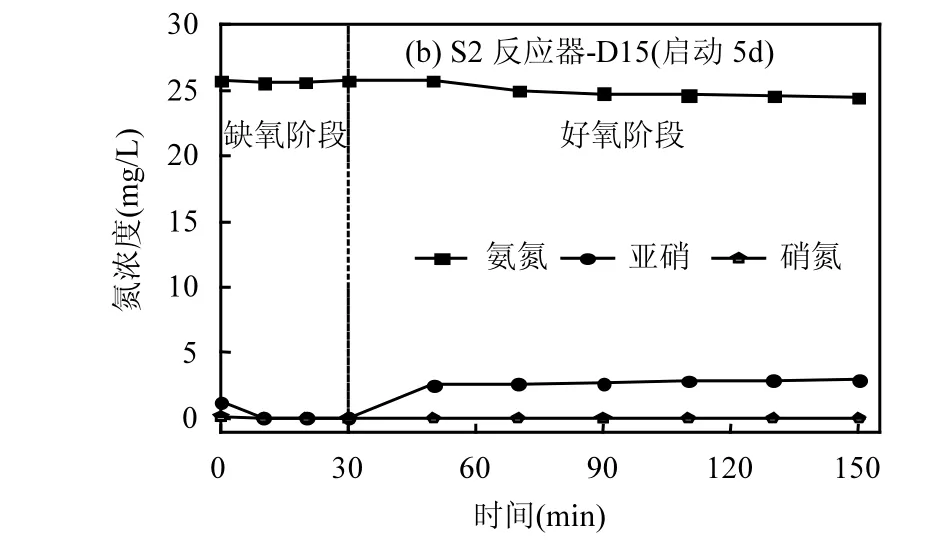
图6 阶段Ⅱ第5d的三氮素典型周期变化Fig.6 Profiles of nitrogen concentration on the fifth day of stageⅡ in typical cycle
而在S1中,A段末投加羟胺,氨氮含量有所上升,猜测由于羟胺在碱性环境下易发生自身歧化作用从而转化为氨类物质[28-29]导致.在进入好氧阶段后,降低了羟胺自身毒性对 HAO、AMO的抑制作用.而对于 NOB而言,S1、S2中均无明显硝态氮积累,说明受抑制情况与缺氧以及好氧阶段投加无关.结合上一阶段试验表明,适当的缺氧反应时间不会影响羟胺在好氧阶段发挥其对NOB的抑制作用.因此,羟胺在好氧阶段对AMO、HAO、NXR产生抑制作用,而在 A段末投加可以在一定程度上使 AOB中HAO更易于分解环境中的羟胺以保持活性.从而可以在实现短程硝化的基础上,保持AOB较高的氨氧化能力.
2.4 羟胺投加对AOB与NOB菌群结构影响
分别在S1、S2两个反应器第Ⅰ阶段第5d(总运行时间的第 5d)与第Ⅱ阶段第 5d(总运行时间的第15d),取相同时间点做qPCR检测见图7.通过计算3种菌(AOB、Nitrobacter、Nitrospira)的丰度变化,得到S1中对AOB、Nitrobacter、Nitrospira的抑制率分别为12.8%、61.8%、70.8%.S2中分别为66.7%、39.2%、51.6%.

图7 投加羟胺启动短程硝化第5d与第15d AOB与NOB丰度Fig.7 Abundances of AOB and NOB on day 5 and day 15 during the start-up of partial nitrification with hydroxylamine addition
通过对比发现,在O段初投加较A段末5min内投加羟胺对AOB的抑制高出53.9%,进而导致S2中NOB占比由 94.58%上升至 96.26%,而 S1中 NOB占比由95.12%下降至82.96%.因此在每个周期的A段末5min内投加羟胺更有利于发挥羟胺对于AOB和NOB的选择性抑制[30],将NOB充分淘洗,从而降低NOB在菌群中所占的比例,实现更加稳定的短程硝化过程.Li等[16]模拟A/O模式运行的SBR反应中,在好氧阶段连续投加5mg/L羟胺,于投加第5dNAR接近100%,同时NH4+-N去除率开始迅速下降,至第14d下降为 0,且于 51d后短程硝化系统被完全破坏,NAR下降为0一现象,与本研究中S2试验现象相近.而乔昕[41]等人,利用 SBR 模拟厌氧/好氧/缺氧(AOA)模式运行,将 5mg/L羟胺以不同频次投加至好氧阶段初,并未出现氨氧化能力的下降.可能是由于运行模式的改变导致 AOB具有更强抵御羟胺抑制的作用.
综上,在A/O模式运行下的SBR反应器,每个周期A段末5min内投加5mg/L羟胺可以在快速实现较高NAR的同时,保持一段时间内较高的氨氧化能力,维持NAR 92%以上.通过每周期投加5mg/L羟胺,对AOB、Nitrobacter、Nitrospira均产生较为明显抑制效果,其中A段末5min内投加会减少对AOB的抑制效果,有利于淘洗 NOB富集 AOB,从而实现菌群结构的优化[18].
3 结论
3.1 DO以及缺氧反应时间(15min及以上)会对羟胺投加后的短程硝化过程产生15%~21%的抑制作用
3.2 在缺氧段末5min内投加羟胺可以使得投加羟胺建立的短程硝化系统在保持较高NAR(92%以上)的同时保持系统较好的氨氧化能力,氨氮去除率达到88%.
3.3 在A/O运行的SBR反应器中,羟胺在好氧阶段对AMO、HAO、NXR产生抑制作用;而在缺氧段末投加可以在一定程度上使AOB中HAO更易于分解环境中的羟胺以保持活性.从而可以在实现短程硝化的基础上,降低AOB氨氧化能力受到的不利影响.
