喉外伤后声带瘢痕形成机制的实验研究
2012-04-29潘叶挺邹坚定龚梁陈建强
潘叶挺 邹坚定 龚梁 陈建强
[摘要] 目的 通过研究兔声带损伤后不同时期的组织病理学改变、上皮增殖活性及主要细胞外基质(ECM)的变化,探讨声带瘢痕形成机制。 方法 实验用兔声带锐性损伤后1周~6个月,通过HE染色、免疫组化染色、ELISA测定及Masson染色法,观察声带组织学结构变化、上皮增殖活性及固有层内透明质酸、胶原纤维等主要ECM的分布及含量变化。 结果 兔声带损伤后3个月内上皮增殖活性增强;6个月内胶原纤维含量明显高于正常对照组(P < 0.05);透明质酸增加不明显。 结论 兔声带损伤后早、中期各种ECM分泌增加,主要表现为以胶原为主的纤维组织明显增多且呈无序排列,透明质酸增加不明显;在损伤后期胶原持续高于正常,导致声带局部瘢痕形成。
[关键词] 声带瘢痕;细胞外基质;组织学
[中图分类号] R739.65[文献标识码] B[文章编号] 1673-9701(2012)29-0016-03
近年来,耳鼻咽喉外伤逐渐增多,声带损伤后瘢痕形成是永久性嗓音障碍的难治原因之一,严重者将出现喉腔粘连、狭窄,甚至引起呼吸困难,将严重影响患者的正常工作、社交和生活,但迄今尚无针对瘢痕本身的有效治疗。这一问题长期以来一直困扰着临床医生和患者。近些年来很多国内外相关研究将目光聚集于声带固有层内细胞外基质(extra cellular matrix,ECM)上,越来越多的研究表明,ECM的有序化排列是维持声带正常振动的基础,是干预声带疤痕形成的希望。声带损伤后ECM的组成和结构改变,纤维组织的大量增生、无序沉积、局部挛缩,影响声带形态、振动及声门闭合,往往引起不可逆的变化[1,2]。我们从2011年1月开始,通过研究兔声带损伤后不同时期的组织病理学改变、上皮增殖活性及主要ECM(胶原纤维、透明质酸)的变化特点,了解声带自身的修复特点,为声带损伤后选择合理的治疗方案提供理论依据。
1 材料与方法
1.1 实验动物及分组
新西兰白兔25只(上海医科院,普通级),雌雄不限,体重2.5~3.0 kg,采用随机数字表法分为两组,创伤组20只,对照组5只。
1.2主要试剂
透明质酸(hyaluronic acid,HA)酶联免疫吸附测定(enzyme-linked immunosorbent assay,ELISA)试剂盒(Rapid Bio Lab,美国),小鼠抗大鼠增殖细胞核抗原(proliferating cell nuclear antigen,PCNA)单克隆抗体(Santa Cruz,美国)。
1.3主要仪器及设备
小号支撑喉镜(Karl Storz Gmb H,德国),喉刀。
1.4方法
1.4.1喉外伤的兔动物模型的建立[3,4] 手术操作均由同一人完成。创伤组:新西兰兔耳缘静脉注射3%戊巴比妥钠1 mL/kg行静脉麻醉后,固定于手术台上,以支撑喉镜暴露声门。用微型喉刀机械切划声带前中部至声韧带,造成声带机械性损伤。左右侧均同法处理。对照组:声带不作创伤处理。
1.4.2 术后检测①HE染色:术后1周、1个月、3个月、6月,分别在创伤组中随机(采用随机数字表法)抽取5只新西兰兔处死,将喉取出,可获得40份声带标本,术后6个月后处死对照组5只新西兰兔,获得10份声带标本。从手术损伤部位切取1 mm×1 mm×1 mm的声带黏膜组织,于4%甲醛中固定后,清水漂洗,石蜡包埋后切片,片厚4 μm,行苏木精-伊红染色,光学显微镜下观察。②透明质酸(HA)检测:将各时间点所取50份声带标本中手术损伤部位切取0.1 g的声带黏膜组织(重量由电子天平称得)研磨成组织匀浆。用ELISA测定共计50份样本中的透明质酸(HA)含量。测定具体步骤按试剂盒说明书进行,在酶标仪上读取吸光度(A)值,通过标准曲线换算成相应质量浓度,结果以pg/mg表示。③上皮细胞增殖强度检测:标本切片后采用免疫组化法检测声带黏膜上皮中的PCNA表达。具体步骤:组织石蜡切片,厚4 μm,60℃恒温箱内烤片1 h。二甲苯脱蜡和水化,酒精梯度脱二甲苯,蒸馏水清洗。微波法修复抗原,置于3% H2O2溶液中室温下孵育30 min,以去除内源性过氧化物酶活性。PBS液洗,滴加正常血清封闭液,37℃孵育10 min。滴加一抗PCNA抗体,4℃过夜,PBS清洗。滴加二抗(生物素化羊抗鼠抗体),37℃孵育20 min,PBS清洗。加链霉菌生物素—过氧化物酶溶液,37℃孵育20 min,PBS清洗。DAB显色剂显色,苏木素复染,片烤干,封片,光镜下观察。免疫组化检测结果的观察及判断细胞计数:以细胞核呈弥漫棕黄色细小颗粒为阳性细胞,每张切片上皮层随机取8幅视野,采用全自动图像分析仪对阳性细胞进行计数,在400倍显微镜下记录每视野(10 814 μm2)中的阳性细胞数。④胶原纤维沉积量的检测:标本切片后采用Masson染色法测声带黏膜下固有层中的胶原纤维沉积情况。具体步骤:10%甲醛液固定组织,石蜡切片,苏木素染液5~10 min,1%盐酸分化,流水冲洗数分钟,Masson复合染色液5~10 min,1%磷钨酸液处理约5 min,亮绿染色液(或苯胺蓝液)复染5 min,1%冰醋酸水处理1 min,95%酒精、无水乙醇脱水,二甲苯透明,中性树胶封固。⑤胶原纤维定量分析:取Masson染色的组织切片,每张切片分别于固有层浅、中、深层各取3幅视野,采用德国KONTRON 131AS 2.5全自动图像分析系统对胶原纤维进行定量分析,于200倍显微镜下分析其各自的面密度(目标面积/统计场总面积),统计场总面积为44 783 μm2。
1.5统计学处理
采用SPSS 12.0统计软件进行处理,计量资料用(x±s)表示,创伤组术后1周、1个月、3个月、6个月分别与对照组相比较,两组间比较采用独立样本t检验,P < 0.05表示差异有统计学意义。
2 结果
2.1 HE染色
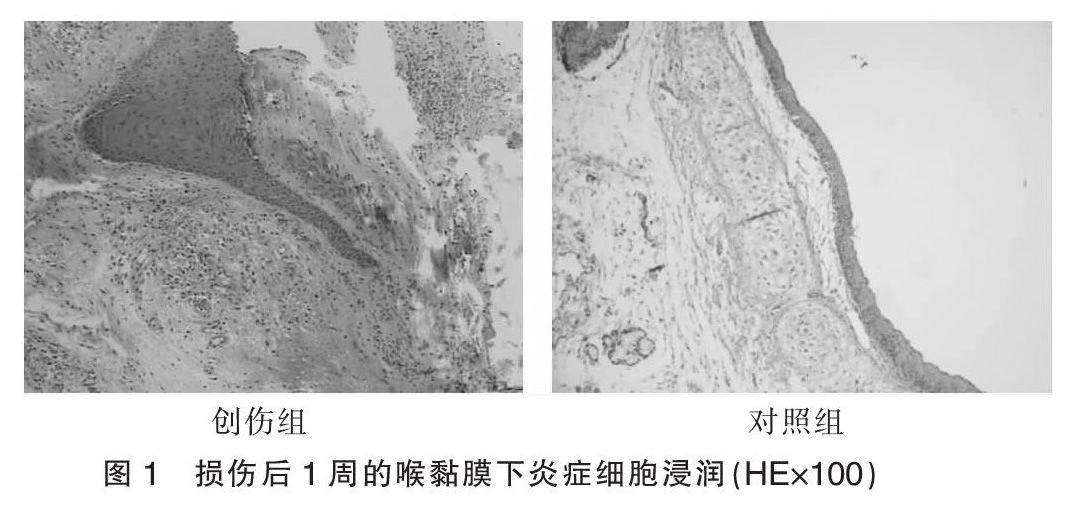
术后1个月的HE染色结果示:声带黏膜为复层鳞状上皮,外伤后创伤组观察到上皮下固有层较多炎症细胞浸润,成纤维细胞增生,胶原纤维增厚、增多,呈团状、漩涡状,间质水肿、变性。见图1。
2.2 两组间透明质酸(HA)的比较
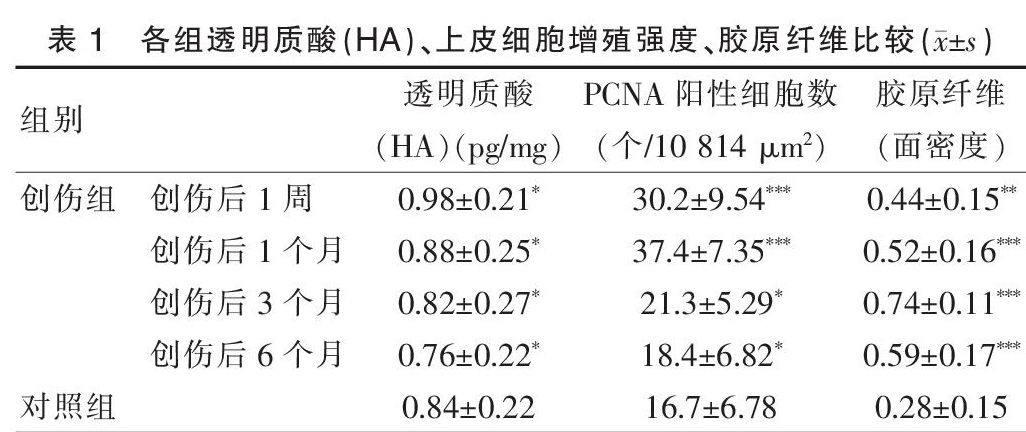
提示创伤后透明质酸(HA)在1个月内略增高,3个月后呈下降趋势,但创伤组各个时间点与对照组差异均无统计学意义(术后1周、1个月、3个月、6个月分别为t = 1.47、0.40、-0.15、-0.77,P = 0.159、0.697、0.886、0.453),详见表1。
2.3上皮细胞增殖强度检测
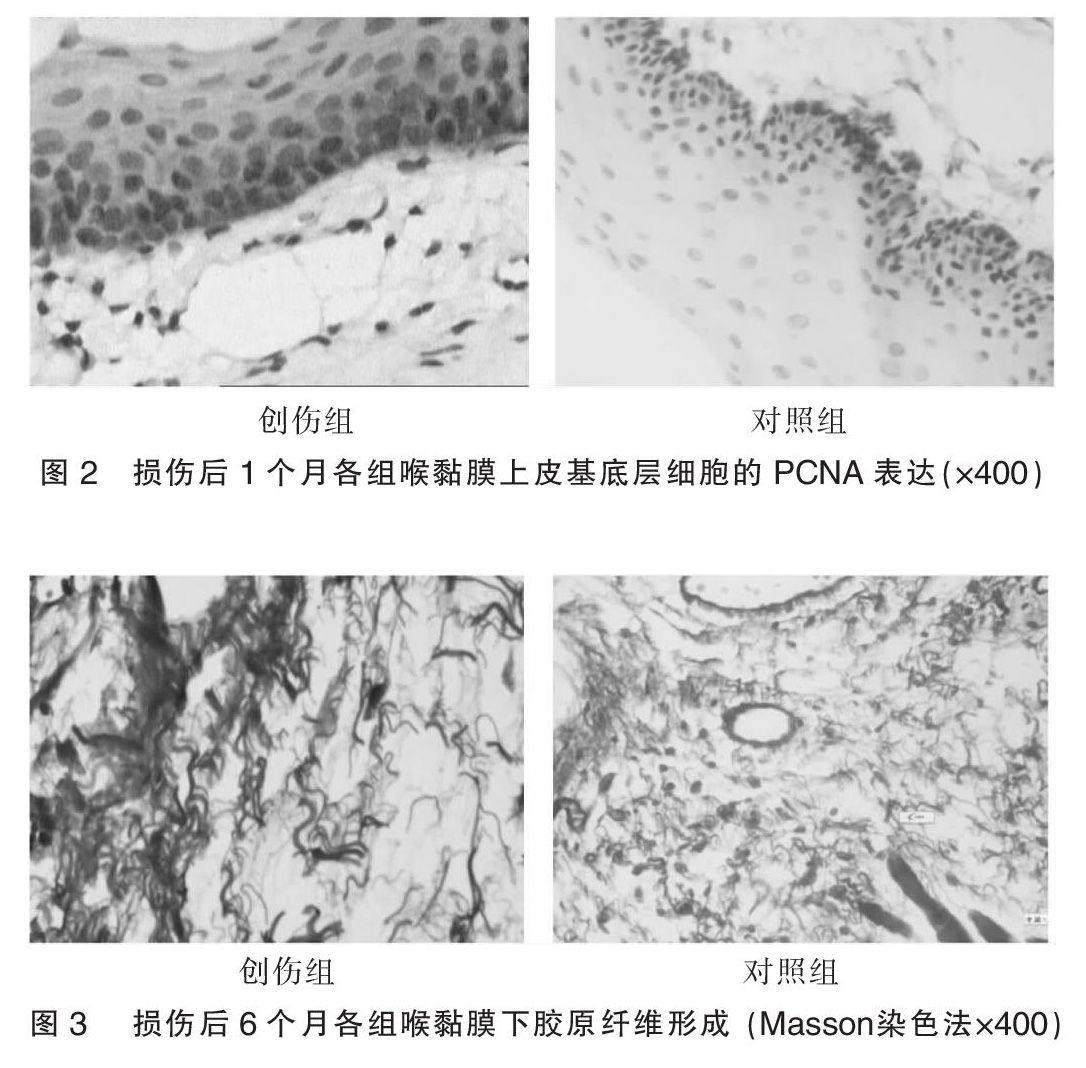
免疫组化染色示PCNA定位于细胞核内,细胞核呈棕黄色反应,胞浆和胞膜不着色。PCNA阳性细胞主要位于上皮基底层,提示创伤后上皮细胞增殖较活跃。创伤组1个月时上皮基底层PCNA着色明显较对照组深(图2),提示创伤后声带黏膜上皮增殖增强。创伤后1周及1个月时创伤组PCNA阳性细胞数与对照组比较差异显著,有统计学意义(术后1周、1个月分别为t = 3.65、6.54,P = 0.002、0.000),创伤后3个月及6个月时创伤组PCNA阳性细胞数与对照组比较虽略有增高,但差异无统计学意义(术后3个月、6个月分别为t = 1.69、0.56,P = 0.108、0.583),详见表1。
2.4 胶原纤维观察及定量分析
损伤1周后部分损伤声带出现纤维组织增生或胶原紊乱沉积,3个月后达到高峰,6个月时胶原纤维增生及沉积情况趋于稳定,胶原含量在损伤后各时期均明显高于正常对照组(术后1周、1个月、3个月、6个月分别为t = 2.39、3.61、7.87、4.47,P = 0.028、0.002、0.000、0.000),详见表1。Masson染色示组织中肌纤维呈红色,胶原纤维呈蓝色。可见创伤组组织中大量胶原纤维增生,排列较紊乱,有的成团或成束,有的扭曲缠绕。见图3。
表1 各组透明质酸(HA)、上皮细胞增殖强度、胶原纤维比较(x±s)
注:与对照组比较,*P > 0.05,**P < 0.05,***P < 0.01
3讨论
声带固有层是介于声带上皮层与声带肌之间的结缔组织,是与声带振动密切相关的最重要的特征性结构。根据分子类型,ECM成分可分为纤维蛋白、间隙蛋白及其他分子如碳水化合物、脂质等。纤维蛋白包括弹性纤维和胶原纤维,其中弹性纤维赋予组织弹性,与声带变形和回复等声带振动特性相关;胶原纤维为组织提供结构和力量,受力时可承受压力、抵抗变形。间隙蛋白围绕在弹性成分周围,包括透明质酸和纤维连接蛋白。成纤维细胞则是分泌声带ECM的主要细胞。因此,本研究通过长期动态观察兔声带损伤后不同时期的组织病理学改变、上皮增殖活性及主要ECM(胶原纤维、透明质酸)的变化特点,以了解声带自身的修复特点。
声带创伤愈合中组织修复的特征是修复细胞处于活跃的增殖状态。本实验中我们采用PCNA免疫组化染色来衡量修复细胞的增殖活性。结果显示,上皮细胞的增殖活性与ECM成分的变化相吻合。在声带创伤后1个月内,上皮细胞保持很活跃的增殖状态,而此时主要ECM(胶原纤维、透明质酸)的明显增多,成正相关。相似的结果也见于Guqatschka M的研究[5],其增殖活性可持续3个月左右。因此,本研究表明,ECM成分变化与声带创伤愈合过程中上皮细胞的增殖能力有关。
固有层中胶原纤维的增加在声带损伤后明显,特别是在3个月时。正如Branski RC等[6]的研究结果表明,声带损伤后初期,胶原纤维和纤维连接蛋白升高,弹性纤维减少。当声带损伤时各种ECM的分泌和释放逐渐增加,ECM对声带的自身修复有一定的促进作用;但过度分泌的ECM可能会影响声带的修复能力,主要表现为损伤后1个月即出现的以胶原为主的纤维组织的增生及沉积,其持续的增生状态保持至损伤后6个月,胶原纤维作为组织的支撑结构,过度增加的胶原纤维会使声带局部僵硬,是导致声带瘢痕形成的主要原因之一。在声带损伤的中后期,局部组织开始进行重塑[6],此时期胶原的含量虽略有降低,但仍明显高于正常,固有层内的胶原纤维呈不规则柱状或条索状排列,表明胶原的无序沉积状态可能是声带瘢痕形成的主要因素。因此,过度分泌及无序沉积的胶原纤维可能导致受损声带局部纤维化,从而使声带丧失正常的振动功能。
本研究组对固有层内主要ECM的检测显示,损伤后1个月内透明质酸(HA)含量略微增加,與对照组比较无显著差异。HA被认为是维持声带正常弹性及声带损伤后抑制胶原分泌的主要ECM[7]。Catten等[8]对间隙蛋白进行研究后认为,蛋白聚糖特别是HA对声带生物力学具有重要作用,HA浓度越高则声带黏性越高,振动缓冲能力越强。提示HA对声带黏膜和固有层缺失修复具有潜在的应用价值。HA是一种细胞外基质黏多糖,无抗原性,具有黏弹性和吸收冲击的特性,具有承受声带所受振动碰撞的理想的生物机械特性。HA作为减震器,保护声带缘在发声中不受振动损伤,其促进损伤修复的能力可以减少纤维化和瘢痕形成。此外,HA还在声带组织分化、再生、修复中起重要作用[9,10]。我们可以推断固有层中胶原纤维的含量变化也会影响声带的损伤后修复,其含量在中后期的持续增高直接参与声带瘢痕的形成过程,构成了声带瘢痕一部分,如能在损伤早期适当控制胶原纤维的分泌则有可能促进声带的修复。因此,如何诱导成纤维细胞增加HA的分泌,减少胶原纤维的分泌,成为声带修复的关键所在。
本研究结果提示,在声带损伤后成纤维细胞活性增强,早、中期各种ECM的大量沉积,表现为以胶原纤维为主的纤维组织持续增生和无序排列、HA少量增多;在声带损伤后期各种ECM分泌减少,但胶原纤维含量仍明显高于正常,声带固有层局部的ECM以紊乱的胶原纤维沉积为主,分层结构消失,瘢痕形成,透明质酸成分降低。
[参考文献]
[1]Hahn MS,Kobler JB,Starcher BC,et al. Quantitative and comparative studies of the vocal fold extracellular matrix-I:Elastic fibers and hyaluronic acid[J]. Ann Otol Rhinol Laryngol,2006,115(2):156-164.
[2]Hammond TH,Zhou RX,Hammond EH,et al. The intermediate layer:A morphologic study of the elastin and hyaluronic acid constituents of normal human vocal folds[J]. J Voice,1997,11(1):59-66.
[3]Rousseau B,Hirano S,Chan RW,et al. Characterization of chronic vocal fold scarring in a rabbit model[J]. Journal of Voice:Official Journal of the Voice Foundation,2004,18(1):116-124.
[4]方锐,孙敬武,万光伦,等. 几丁糖预防CO2激光声带切除术后声带粘连短期观察的实验研究[J]. 中华耳鼻咽喉头颈外科杂志,2009,4(7):581-585.
[5]Guqatschka M,Kojima T,Ohno S,et al. Recruitment patterns of side population cells during wound healing in rat vocal folds[J]. Laryngoscope,2011,121(8):1662-1667.
[6]Branski RC,Rosen CA,Verdolini K,et al. Acute vocal fold wound healing in a rabbit model[J]. Ann Otol Rhinol Laryngol,2005,114(1 Pt 1):19-24.
[7]Chhetri DK,Mendelsohn AH. Hyaluronic acid for the treatment of vocal fold scars[J]. Curr Opin Otolaryngol Head Neck Surg,2010,18(6):498-502.
[8]Catten M,Gray SD,Hammond TH,et al. Analysis of cellular location and concentration in vocal fold lamina propria[J]. Otolaryngol Head Neck Surg,1998,118(5):663-667.
[9]黄冬雁,杨伟炎,王荣光. 透明质酸在声带中的作用[J]. 国外医学:耳鼻咽喉科学分册,2005,29(5):279-281.
[10]Sato K,Sakamoto K,Nakashima T. Expression and distribution of CD44 and hyaluronic acid in human vocal fold mucosa[J]. Ann Otol Rhinol Laryngol,2006,115(10):741-748.
(收稿日期:2012-07-30)
