抗HP嗜酸乳杆菌与SGC-7901细胞的黏附及其对HP与SGC-7901细胞黏附的抑制效应
2012-02-24赵忠岩王江滨刘冬琦
赵忠岩,王江滨,刘冬琦,李 岩
(吉林大学1.中日联谊医院a.急救医学科;b.消化内科,吉林 长春 130033;2.公共卫生学院)
*通讯作者
幽门螺杆菌是人类最常见的病原性细菌,是慢性胃炎、消化性溃疡等疾病发生的主要病因,并与胃腺癌、胃粘膜相关淋巴组织淋巴瘤的发生密切相关,WHO已将其列为一类致癌因子[1]。由于目前根除HP治疗方案存在许多弊端,近年来人们逐渐开始关注微生态疗法在HP根除治疗中的应用,有研究发现,益生菌中的某些菌株对HP的生长具有抑制作用[2],本实验室经过大量的实验研究从健康人粪便中筛选并建立了具有拮抗HP国际标准菌株SS1和NCTC11637作用的嗜酸乳杆菌L6,对其耐酸、耐碱等生物学特性及其在胃内存留时间和毒理进行了深入的研究[3],证明该株嗜酸乳杆菌具有稳定的抑制HP国际标准菌株作用。本研究旨在探讨该株嗜酸乳杆菌拮抗幽门螺杆菌作用的可能机制。
1 资料与方法
1.1 嗜酸乳杆菌L6的建立及培养方法 L6由本实验室通过从健康体检者粪便中筛选而建立,采用固体培养法传代培养,收集细菌后调整细菌浓度分别为9logCFU/ml、8logCFU/ml、7logCFU/ml。
1.2 SGC-7901细胞株及培养方法 SGC-7901细胞株购自中国科学院上海细胞生物研究所。细胞培养基为含10%胎牛血清的RPMI1640(Gibco BRL)完全培养液,细胞置于含5%CO2、95%空气的CO2孵箱中,在37℃、95%湿度条件下培养。
1.3 L6与SGC-7901细胞的黏附及其对细胞存活率的影响 将SGC-7901细胞接种于内置载玻片的含20%胎牛血清的RPMI1640培养液的6孔培养板中,待细胞密度达80%时,用RPMI1640冲洗2次,分别加入终浓度为7logCFU/ml、8logCFU/ml和9logCFU/ml的嗜酸乳杆菌L6 PMI1640培养液,在37℃,5%CO2环境中培养,分别于1、6、12、和24 h终止培养,取出载玻片,PBS漂洗2次,自然干燥,甲醇固定15 min,革兰染色,油镜下随机选择50个细胞,计算其可视性细胞表面的细菌数,计算黏附指数(黏附细菌数/细胞数×100%)的均数及标准差,同时选择与L6粘附的SGC-7901细胞以台盼蓝进行染色并计数其细胞总数和存活细胞数,换算成细胞存活率(活细胞数/细胞总数x 100%)。
1.4 嗜酸乳杆菌L6对HP与SGC-7901细胞黏附的拮抗效应 将已有SGC-7901细胞贴壁生长的载玻片置于6孔培养板中,当SGC-7901细胞密度达80%时,以下述3种方法分别观察嗜酸乳杆菌L6对HP的拮抗效应。(1)排除实验:先将不同浓度的嗜酸乳杆菌L6分别加入6孔培养板上(37℃,5%CO2)30 min,洗涤去除未黏附的L6,然后再加入HP悬液,继续孵育30 min后计数HP黏附指数。(2)竞争实验:将HP悬液与不同浓度L6同时加入6孔培养板中混匀,1 h后洗涤3次,以后处理方法同上。(3)替换实验:先将HP悬液加入6孔培养板中(37℃,5%CO2),30 min后,洗涤去除未黏附的HP,然后再加入不同浓度的L6,混匀后继续孵育30 min,处理方法同上。
1.5 上清液中IL-8的测定 将SGC-7901细胞悬浮在24孔板RPMI1640培养液中,37℃,5%CO2环境中培养24 h后,将HP与不同浓度的嗜酸乳杆菌L6加入培养液中共同培养,分别于培养6、12、24 h后取上清液通过ELISA方法测定IL-8的含量,并与单独加入HP和单独加入9logCFU/ml嗜酸乳杆菌进行比较。
1.6 统计学分析 所有数据均采用方差分析及t检验进行统计学处理,P<0.05为有统计学意义。
2 结果
2.1 嗜酸乳杆菌L6具有与SGC-7901细胞黏附的能力,其黏附指数在一定时间范围内随作用时间的延长而增高,在黏附后12 h达高峰。此外,黏附指数还随细菌浓度的增加而增高,与对照组比较有显著性差异,P<0.05,见表1。
2.2 嗜酸乳杆菌 黏附 、12和 的7901细胞的存活率与未被黏附的细胞存活率相比无显著差异,且细胞存活率不受细菌浓度及黏附时间的影响,见表2。
2.3 嗜酸乳杆菌L6对HP与SGC-7901细胞的黏附具有明显的拮抗作用,且这种拮抗作用随细菌浓度的增加而逐渐增强,与单纯HP组比较差异显著,P<0.05;与L6的作用时间早晚有一定关系,排除实验比替换实验明显增强,两者比较差异显著,P<0.05,见表3。
2.4 嗜酸乳杆菌L6可以明显拮抗HP诱导SGC-7901细胞产生IL-8,且随着细菌浓度的增加和作用时间的延长,其对HP诱导的IL-8分泌的拮抗作用逐渐增强,12 h后,浓度为9logCFU/ml组明显高于浓度为7logCFU/ml组和浓度为8logCFU/ml组,各组比较差异显著,P<0.05;而嗜酸乳杆菌L6本身几乎不刺激上皮细胞分泌IL-8,见表4。

表1 嗜酸乳杆菌L6与SGC-7901细胞粘附能力分析
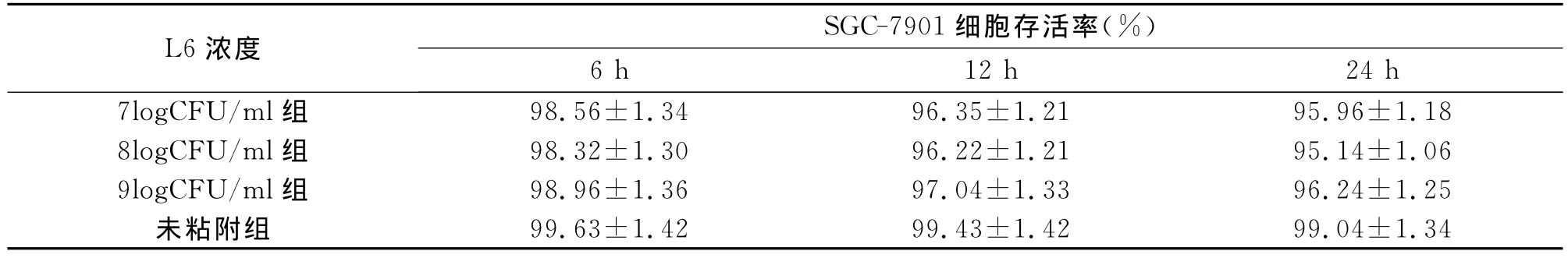
表2 嗜酸乳杆菌L6粘附SGC-7901细胞后细胞存活率的比较

表3 嗜酸乳杆菌L6对HP与SGC-7901细胞粘附拮抗作用分析
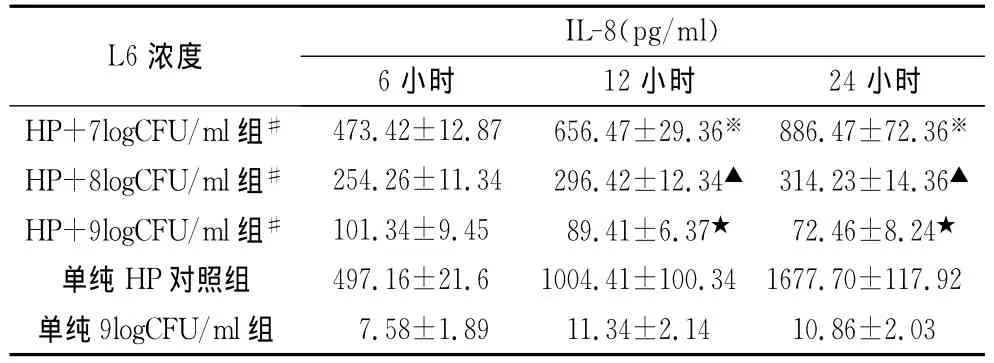
表4 嗜酸乳杆菌L6对HP诱导IL-8分泌的抑制效应
3 讨论
幽门螺杆菌(HP)是人类最常见的病原性细菌,是慢性胃炎、消化性溃疡等疾病发生的主要病因,并与胃腺癌、胃粘膜相关淋巴组织淋巴瘤的发生密切相关,WHO已将其列为一类致癌因子。HP对胃粘膜造成损害的前提是必须黏附于胃粘膜上皮细胞,进一步引起上皮细胞的某些行为改变,如分泌炎性细胞趋化因子,激活中性粒细胞等,同时胃上皮细胞还可作为抗原呈递细胞引发T淋巴细胞的活化,最终导致中性粒细胞和淋巴细胞在胃粘膜内浸润,引起胃粘膜炎症反应[4,5]。HP在人类的感染率已高达50%以上,其感染引起的炎症反应是其重要的致病机制之一[6]。由于HP为非侵入性细菌,其所引起的炎症反应是通过第二信使来完成的,关于第二信使目前研究较多的是炎症细胞趋化因子,如IL-2、IL-6、IL-8及肿瘤坏死因子等,特别是IL-8研究的比较深入,是目前比较肯定的炎症介质,其诱导的炎细胞聚集是HP引起胃粘膜病变的关键因素,并且有研究进一步证明,只有活的HP才能诱发IL-8的分泌,且HP与胃粘膜上皮细胞的黏附是诱发上皮细胞IL-8分泌的先决条件[7]。从以上的研究中我们可以看出,阻断HP的黏附是治疗HP感染的重要环节。
益生菌是通过改善胃肠内菌群的平衡,对宿主起到有益作用的活性微生物,具有抵御外源细菌定植所表现出的定植抗性,即益生菌通过黏附素与粘膜上皮细胞受体黏附,然后占位定植,以阻止病原菌与粘膜受体结合从而抑制病原菌的黏附[8]。黏附是益生菌发挥作用的首要条件,因此,益生菌的定植抗性是衡量其生态效应的重要指标。
嗜酸乳杆菌是人类胃肠道内主要的益生菌,有研究表明,其有明显的拮抗HP的作用,但其作用机制尚不清楚,可能与嗜酸乳杆菌对胃上皮细胞的高度亲和力有关,由于嗜酸乳杆菌的快速生长使得它能分泌大量的乳酸,可以直接对黏附在上皮细胞的HP起抑制作用,而不干扰胃粘膜的粘液层[10]。动物实验研究发现乳酸杆菌能阻止HP在鼠胃内的定植,这可能与嗜酸乳杆菌阻碍了HP的黏附有关[10]。嗜酸乳杆菌对胃粘膜表面的选择性黏附被认为是影响其在有胃液存在的环境中定植的一个重要因素,嗜酸乳杆菌产生的乳酸、乙酸、乙酰醋酸等有机酸在消化道粘膜的分布明显多于消化道内容物的分布,这些黏附在消化道粘膜表面的有机酸,对消化道病菌的黏附也起到一定的屏障作用[13-14]。
本研究以黏附和黏附抑制为切入点,选用胃粘膜上皮细胞为靶细胞,观察了嗜酸乳杆菌对胃黏膜上皮细胞的粘附情况,结果显示,本实验室筛选的嗜酸乳杆菌L6对胃黏膜上皮细胞具有粘附性,随浓度的增加粘附性逐渐增强,且粘附后不影响细胞的存活率;L6对HP与胃黏膜上皮细胞的粘附起拮抗作用,且在HP与胃黏膜细胞粘附之前应用嗜酸乳杆菌的拮抗作用更明显;嗜酸乳杆菌L6还可抑制HP诱导胃上皮细胞分泌Il-8,而其本身并不引起IL-8的分泌,为嗜酸乳杆菌L6在微生态制剂开发中的价值提供依据。
[1]Sakai T,Ognra Y,Narita J,et al.Simultaneous early adenocarcinoma and mucosa-associated lymphoid tissue(MALT)lymphoma of the stomach associated with Helicobacter pylori infection[J].Gastric Cancer,2003,8:191.
[2]Brzozowski T,Konturek PC,Sliwowski Z,et al.Interaction of nonsteroidal anti-inflammatory drugs(NSAID)with Helicobacter pylori in the stomach of humans and experimental animals[J].J Physiol pharmacol,2006,57 (Supple 3):67.
[3]王锦鸿,王江滨,李 岩,等.抗HP嗜酸乳杆菌的筛选及其相关生物学特性的研究[J].中国免疫学杂志,2007,(4):1116.
[4]Pillinqer MH,Marianovic N,Kim SY,et al.Helicobacter pylori stimulates gastric epithelial cell MMP-1 secretion via Cag A-dependent and independent ERK activation[J].J Biol Chem,2007,282(26):18722.
[5]Couturier MR,Tasca E,Momtecuccoc C,et al.Interaction with Cag F is required for translocation of Cag A into the host via the Helicobacter pylori type IV secretion system[J].Infect Immun,2006,74(1):273.
[6]Sunir AE,et al.Typing of Campylobacter pylori by bacterial DNA Brestriction endonuclease analysis and determination of plasmid profile[J].J Clin Microbiol,1990,28:83.
[7]Ding S Z,Cho C H,Lam S K.Helicobacter pylori induces interleukin-8 expression in endothelial cells and the signal path way is protein tyrosine kinase dependent[J].Biochem Biophys Res Commun,1997,240(3):561.
[8]郭兴华.益生菌基础与临床[M].北京:科学技术出版社.2002:36.
[9]Ryan KA,Daly P,Li Y,er al.Strain-specific inhibition of Helicobacter pylori by Lactobacillus salivarius and other lactobacilli[J].J Antimicrob Chemother,2008,61(4):831.
[10]Sqouras DN,Panayotopoulou EG,Martinez-Gonzalez B,et al.Lactobacillus johnsonii La1 attenuates Helicobacter pylori-associated gastritis and reduces levels of proinflammatory chemokines in C57BL/6 mice[J].Clin Diagn Lab Immunoll,2005,12(12):1378.
[11]Collado MC,Jalonen L,Meriluoto J,et al.Protection mechanism of probiotic combination against human pathogens:in vitro adhesion to human intestinal mucus[J].Asia Pac J Clin Nutr,2006,15(4):570.
