小鼠仙台病毒ELISA抗体检测规范化试剂盒的研制与应用
2012-02-03向志光刘先菊张丽芳李雨函王艳蓉刘云波
向志光,佟 巍,刘先菊,张丽芳,李雨函,王艳蓉,刘云波,魏 强
(中国医学科学院,北京协和医学院,医学实验动物研究所,卫生部实验动物检测中心,北京 100021)
仙台病毒是实验用大鼠和小鼠严格控制的病毒性疾病,严重影响实验动物的质量,因此清洁级以上实验大小鼠中必须严格控制[1]。目前在病毒性病原体的检测中多采取血清学方法,在我国的实验动物国家标准中也推荐了如免疫荧光法(IFA)、免疫酶法(IEA)和酶联免疫吸附试验(ELISA)等传统的血清学方法[2]。但是目前我国的实验动物的检测过程中多是以各自实验室自行制备的试剂进行检测,而检测过程中检测试剂的质量会最终影响到检测结果的判定,因此对现有的检测试剂进行标准规范化的研究十分必要。
根据我中心多年的工作积累,我们按照我国农业部对于兽医诊断制品的要求[3],对小鼠仙台病毒抗体ELISA检测试剂盒进行了较为规范的研制。
1 材料和方法
1.1 病毒、细胞等的来源和种子批、库的建立
仙台病毒和病毒培养细胞BHK-21来自美国ATCC。培养仙台病毒用SPF鸡胚来自北京梅里亚维通实验动物技术有限公司。培养BHK-21细胞的EMEM培养基来自美国ATCC。胎牛血清和其他添加剂为Invitrogen公司产品。100μL仙台病毒原液接种SPF鸡胚收获尿囊液,继续在鸡胚传代分别混合成批,经病毒的种子批纯净性和毒力等检定分别建立仙台病毒的原始种子批,基础种子批和工作种子批。BHK-21细胞经扩大培养传代建立相应的3层细胞库。
1.2 病毒抗原的生产和纯化
以一定毒力的工作种子批病毒接种培养成单层的BHK-21细胞,培养一定时间后对培养物做反复冻融,经56℃30 min对培养物做灭活处理,经连续的差速离心去除细胞碎片,收集病毒。病毒经超声处理,离心后的可溶性蛋白组分测定浓度,作为仙台病毒ELISA检测中的抗原蛋白进行后续包被。
1.3 标准血清的制备
以鸡胚尿囊液培养的仙台病毒多次不同途径接种6~8周龄SPF级BALB/C小鼠,最后一次接种一周后收集血清,并作灭活处理[4]。以IFA方法和ELISA方法对免疫血清做滴度检测,IFA滴度大于1∶160的血清可混合成批,对每批混合血清做IFA滴度测试使其达到1∶160以上。批次免疫血清做梯度稀释后进行ELISA检测,按照测定值在1.1~1.6范围内的稀释度稀释免疫血清可以做后续ELISA检测的阳性对照(阳性标准血清)。能够用IFA方法做阳性判定的最低稀释度免疫血清作为ELISA检测的阳性临界判定血清(阳性临界值血清)。普通的SPF小鼠经鉴定排除仙台病毒感染,血清混合作为阴性对照(阴性标准血清)。
1.4 ELISA反应板体系的优化
分别以不同浓度的抗原蛋白包被ELISA平板,测定梯度稀释的免疫血清,选择最优的抗原包被浓度。测定不同反应条件(反应温度)对于检测结果的影响。确定最优反应条件。
1.5 样品的检测
对照标准血清和待检样品做1∶40倍稀释100μL,加入预先水化的ELISA孔中,每个样品做复孔,留空白孔做对照,37℃孵育1 h;扣除孵育液,PBST洗板3次后加入酶标记物,37℃孵育1 h;扣除孵育液,PBST洗板3次后加入酶底物液,室温孵育10 min以内,待阳性标准血清显色至OD600读值至0.8加入终止液终止显色反应,OD450读值检测。阳性临界血清测量值作为阳性样品判定标准;阴性标准血清测量值加0.15做阴性样品判定标准。
1.6 IFA和Westernblot对于结果的验证
参照国家标准中的IFA方法制备仙台病毒感染细胞的抗原玻片,进行IFA方法检测。使用包被ELISA平板的抗原蛋白行SDS-PAGE电泳转至NC膜上和1∶100稀释的血清样本进行杂交,使用酶标记二抗显示特异条带,ECL发光显影。
1.7 检测体系的质量控制
对ELISA试剂盒的生产、保存、使用等环节进行质量控制。关键质控点包括:抗原蛋白的纯度测定;酶标板批内批间的稳定性检测;标准血清的批次滴度测定;检测体系中空白孔、阴性标准血清、阳性标准血清、阳性临界浓度血清测量值范围做限定。
2 结果
2.1 仙台病毒种子批和BHK-21细胞库的建立和鉴定
将500μL仙台病毒原液接种5只SPF鸡胚收获尿囊液混合成批,作为原始病毒的种子批,在鸡胚继续传代混合成批,分别制备基础种子批和工作种子批,使用血凝法对病毒的毒力进行测定,血凝毒力达到要求的1∶128以上。3层种子批通过了无菌检验、支原体检验、病毒的特征性血凝抑制实验,达到农业部对于病毒的种子批纯净性和毒力等检定的要求。BHK-21细胞经扩大培养分别建立了原始细胞库、基础细胞库、工作细胞库,通过了农业部要求的检验。每3个月对病毒种子批进行毒力测定,发现病毒保存6个月内毒力无明显变化,细胞库6个月复苏测定细胞复苏效率未发现明显变化。建立了病毒种子批和细胞库的保藏管理和更新维护的体系,以满足后续试剂盒的长期生产需求。
2.2 病毒抗原的生产和纯化工艺研究
以不同剂量的仙台病毒接种培养成单层的BHK-21细胞,结果发现血凝滴度低于1∶64的仙台病毒鸡胚尿囊液培养物感染BHK细胞在1周以内不能很好的引起细胞病变,测试血凝滴度低于1∶32;当血凝滴度高于1∶512时细胞病变发生迅速(小于24 h),但血凝滴度未能达到1∶64;使用血凝滴度1∶128的仙台病毒培养物感染BHK-21细胞,在60~84 h间细胞培养物中病毒的滴度处于增殖状态,而之后的时间段病毒滴度下降,在更换培养基后滴度有少量提高。

图1 不同剂量仙台病毒接种BHK-21细胞培养病毒血凝滴度变化Fig.1 HI changes of Sendai virus cultured in BHK-21 cells with different inoculation doses
对病毒细胞培养物做反复冻融,经56℃30 min对培养物做灭活处理,做后续抗原蛋白纯化。直接使用细胞培养物作为ELISA抗原,结果显示抗原特异性差;使用10000 rpm低温离心30 m in能有效去除细胞碎片,在经过35000 rpm低温离心3 h收集病毒颗粒。直接使用病毒颗粒进行ELISA平板包被,和对照血清的反应结果显示不同孔之间检测数值存在差异,差值较大。对病毒颗粒进行超声处理,收集可溶性抗原蛋白进行平板包被,平板孔与孔之见差异极小,适用于ELISA抗原生产(具体数据另文报告)。因此确定为病毒抗原生产工艺。
2.3 标准血清的制备
每批50只国家标准检测合格的6周龄SPF级 BALB/c小鼠,使用SeV鸡胚尿囊液,浓度为100 TCID50/100μL,先后以一次腹腔、2次滴鼻的方式每隔一周进行一次接种。最后一次免疫后第10天,尾尖采血,56℃30 min灭活,5000 rpm/min离心20 m in后取上清测定抗体IFA效价。效价高于1∶160认为免疫合格进行后续采血。对同一批次的免疫血清进行检验。每批混合血清做IFA滴度测试,3批次免疫血清均达到1∶320。
混合成批的免疫血清从1∶40开始进行倍比稀释至1∶40960将稀释好的血清加入用已包被有SeV抗原的ELISA板中,根据ELISA反应条件进行操作,最后在450 nm波长处测OD值。测定值在1.1~1.6范围内的稀释度为1∶640左右,对3批次免疫血清做1∶16倍稀释后作为阳性对照。再做1∶40稀释达到1∶640,多次测量OD450吸光度在1.1~1.6范围内。检测吸光度达到合理范围,可以做后续ELISA检测的阳性对照(阳性标准血清)。阳性标准血清再进行8倍稀释后可以被IFA方法做阳性判定。继续稀释不能做IFA法阳性判定。因此将阳性标准血清做8被稀释可做ELISA检测的阳性临界判定血清(阳性临界值血清)。普通的SPF小鼠经鉴定排除仙台病毒感染,血清混合成批作为阴性对照(阴性标准血清)。
2.4 ELISA反应板体系的优化
将抗原稀释成10μg/m L、5μg/m L、2.5μg/ m L、1.25μg/m L蛋白浓度,小鼠抗SeV免疫血清从1∶40开始倍比稀释,进行间接ELISA实验,结果表明,包被抗原为1.25μg/m L时为最适抗原包被浓度。
对于30份标准样品进行检测,选择不同的血清孵育温度,以及不同二抗孵育反应的温度分析标准样品在不同条件下的检测结果,结果发现不同反应温度的变化影响到ELISA检测读数,也会影响实验结果的判定。控制反应温度在37℃,反应1 h可以保证免疫反应的充分进行,实验结果较为稳定。因此确定血清样本的反应温度和二抗的反应温度均在37℃,各自反应1 h可作为试剂盒检测的最适条件。
2.5 小鼠血清样品测试ELISA试剂盒
来源清晰的SPF级小鼠血清样本、仙台病毒免疫小鼠血清和其它方法测定仙台病毒阳性小鼠血清样本的作为测试样本,测定多批次小鼠仙台病毒ELISA检测试剂盒阴性样本的均值和标准差。结果发现:513份SPF小鼠血清ELISA检测OD450均值在3次实验中分别为0.043±0.035;0.056±0.045; 0.067±0.052;IFA法判定的仙台病毒阳性的免疫血清的临界浓度在ELISA检测中OD450的测量值在0.3~0.45之间变动;672份待测血清样本使用阴性对照测量均值+0.15(3倍标准差)作为阴性样本的判定标准,测得试剂盒的特异性高于99.7%;使用仙台病毒阳性的免疫血清的临界浓度在ELISA检测中OD450的测量值作为阳性样本的判定标准,敏感性高于99.5%。
2.6 IFA和Westernblot对于结果的验证
参照国家标准中的IFA方法制备仙台病毒感染细胞的抗原玻片,进行IFA方法检测。小鼠仙台病毒ELISA检测试剂盒与国家标准IFA方法的符合率为98.33%;将ELISA检测结果处于2个临界浓度之间的血清进行Western blot检测,在被检的10份血清中有6份存在阳性条带。
2.7 ELISA试剂盒的质量控制
3批次抗原蛋白行SDS-PAGE电泳,转至NC膜和免疫血清进行杂交,结果如图3所示:3批抗原蛋白均显示出主要抗原蛋白条带,无明显杂带存在。符合此标准的抗原蛋白可以进行后续抗原包被工作。
为了测定小鼠仙台病毒ELISA检测试剂盒批间和批内检测标准样品的实验重复性,测定同一样品的在不同批次产品测试结果的变异率,以及批间和批内的测试变异对于检测结果的影响,随机抽取3批ELISA平板样品,每批样品随机抽取6块ELISA平板,使用同一组测试血清样品30份,在每个测试平板上测试,并做复孔。统计测试结果在不同批次和批内的变异率,同时计算测试的敏感性和特异性,评价批内结果的变异率和批间结果的变异率对检测结果的影响。结果发现:用IFA方法测定30份血清样品,其中5份为阳性,25份为阴性血清样品。使用ELISA方法测定阳性样本为5份,阴性样本为25份。不同批次和批内不同试剂盒平板不影响检测结果的判定。阴性样本OD450测定数值的批内变异率小于5%,批间变异率小于5%(图4);阳性样本OD450测定数值的批内变异率小于5%,批间变异率小于10%(图5)。

图3 3批抗原和标准免疫血清杂交的结果Fig.3 Western blot reaction of 3 batches antigens with standardized immune serum

图4 25份阴性样本测试ELISA试剂盒批内变异率和批间变异率Fig.4 The variability of 3 batches ELISA kitstested by 25 SeV negative sera
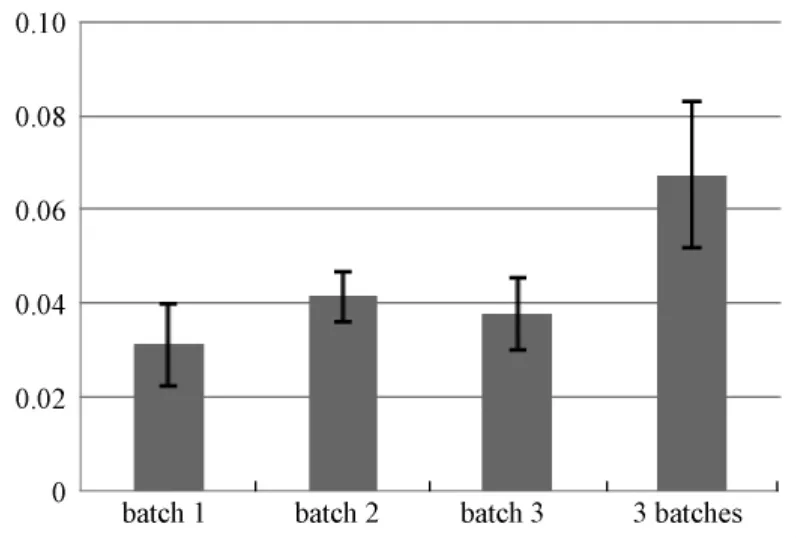
图5 5份阳性样本测试ELISA试剂盒批内变异率和批间变异率Fig.5 The variability of 3 batches ELISA kitstested by 5 SeV positive sera
混合制备的小鼠仙台病毒阴性血清ELISA检测多次重复试验OD450的测量值在0.1以下;对3个批次的免疫血清的批次滴度进行测定,结果如图6所示,进行倍比稀释用ELISA试剂盒进行检测,3批次免疫血清测量值重复性较好。

图6 3批仙台病毒免疫血清用ELISA方法做质控检验Fig.6 The quality control tests of 3 batches SeV immune sera
3 讨论
酶联免疫吸附试验作为较为常规的血清学检测方法操作简便,对设备要求不高,样品检测通量较大,目前在实验动物的质量控制方面应用前景广阔。但是作为一种实验动物的诊断用试剂,其质量的稳定性十分重要。在ELISA试剂盒的质量控制中最为关键的问题包括抗原的质量,生产工艺的稳定性,参比血清的稳定性等,因此本文就我中心研发小鼠仙台病毒ELISA试剂盒过程中的质控技术做了阐述。
包被抗原是酶联免疫吸附试验的重要因素。天然抗原目前仍是最具代表性的抗原物质,因此我们在本试剂盒的开发中首选天然病毒抗原。考虑到生产成本和生产工艺的稳定性,本试剂盒采用BHK-21细胞作为病毒扩大培养的载体,和鸡胚来源的病毒相比,该方法排除了鸡胚蛋白对于实验的干扰(结果未展示),生产工艺稳定。在病毒抗原生产中感染用仙台病毒的接种剂量有一定的范围要求。当病毒接种剂量过低时,短时间内不能很好的引起细胞的病变,一方面影响了病毒的增长,对于生产的病毒的质量产生影响;同时病毒生产的周期过长,不利于病毒培养的条件控制,也提高了生产的成本。而病毒接种剂量过高导致被感染细胞病变速度过快,同样影响了病毒的质量,使得病毒的生长不完全,而细胞破碎严重。适当接种剂量的仙台病毒(在本研究中选择了血凝滴度1:128的接种剂量)可以在感染细胞2~3 d的时间范围出现病毒的快速增长,病毒的培养较为稳定,在接种后72 h收获病毒,符合试剂盒病毒生产的需要,可以作为最适的培养条件。
仙台病毒作为颗粒性抗原,大小在100 nm以上,对于酶标板表面的吸附性较差。本研究中将病毒抗原做超声处理,收集可溶性成分进行酶标板的抗原包被,结果显示包被孔之见差异较小,有效的提高了抗原包被的稳定性。而对于抗原纯度的控制我们采用了免疫印记的方法对于主要抗原带型进行了鉴定。通过此种质控手段,本试剂盒的批间检测结果的变异率控制在较低水平。
通过对大量检测样品的测试,我们发现SPF级动物的血清检测数据多控制在0.2以下。而不同实验对此标准会有一定影响,例如显色时间和显色程度,因此我们采取阴性参比血清的检测结果加0.15作为阴性判定标准。以此标准对大量样品做多次检测,检测的特异性达到99%以上。因此在检测过程中低于此标准的样品可做阴性判定。而高于此标准的血清样品,仍有少量不能用IFA和Western blot等其他方法做阳性判定,而高于IFA法临界浓度的样品,在阳性结果的判定上有较高的一致性。可以看出对于小鼠仙台病毒的检测最为灵敏的方法为ELISA方法,其次为Western blot,而IFA方法灵敏度相对较低。因此在本试剂盒中增设了阳性临界浓度血清判定指标,当ELISA检测结果高于此标准时,使用其他方法可对此样品做出一致的判断。而低于此标准高于阴性判定标准的样品,其来源动物的种群需要做进一步的检测。我们对仙台病毒感染小鼠也做了消长规律的研究,在感染一周后就可以用ELISA试剂盒检测抗仙台病毒的抗体,而感染3个月后抗仙台病毒抗体的水品任然维持在高位,因此目前国家标准对于实验小鼠仙台病毒检测周期的要求是合理的。
[1]国家标准:实验动物微生物学等级及监测,GB14922.2 -2001.
[2]国家标准:实验动物仙台病毒检测方法,GB/T 14926.23 -2001.
[3]兽医诊断制品注册分类及注册资料要求。农业部公告第442号发布.
[4]侯丽波,谢军芳,佟巍,等.小鼠仙台病毒标准化血清的制备及鉴定[J].中国比较医学杂志,2008,18(9):57-59.
