硫氧还蛋白在凋亡途径中的作用机制
2012-02-03徐涛,于涛
徐 涛,于 涛
(东北林业大学盐碱地生物资源环境研究中心/东北油田盐碱植被恢复与重建教育部重点实验室,哈尔滨150040)
硫氧还蛋白(Trx)是一种小分子蛋白质,它广泛存在于原核和真核生物中。1964年,Trx在大肠杆菌中首次被定义为氧化还原蛋白[1]。随后,1967年,Moore EC[2]在大鼠的肝癌细胞中发现了硫氧还蛋白,1977年,Pigiets.P[3]在大肠杆菌中提取纯化得到硫氧还蛋白,并发现它参与到一系列的氧化还原途径中。1995年,Gasdaska.PY[4]成功克隆出胞浆中的Trx1和线粒体中的Trx2。至此,一系列有关Trx的研究相继展开。近些年,人体内癌细胞中Trx的含量,以及Trx1和Trx2在体内参与的代谢途径成为研究的热点。
1 Trx的结构特点
Trx的分子量约是12×103,是由4个β折叠和3个α螺旋组成的球状蛋白。4个β折叠构成一个疏水核心,核心的终末端被3个α螺旋包绕。这种折叠结构普遍存在于氧化还原蛋白家族中。Trx参与氧化还原反应的重要活性位点是Cys-Gly-Pro-Cys,它相对来说比较保守,可以与二硫键相互作用,还原被氧化的多种蛋白,而其自身从还原态(SH2 -)变成氧化态(S-),又可以通过TrxR的作用,恢复到还原态[5]。
目前Trx主要分为Trx1和Trx2两种类型,Trx1位于细胞浆和细胞核中,包含105个氨基酸,而Trx2仅位于线粒体中,不同于Trx1,Trx2由166个氨基酸构成,除了保守的还原结构外,还包含了60个氨基酸组成的N末端延伸(图1),这段引导序列对于Trx2存在于线粒体内部起关键作用[6]。Trx1和Trx2由于存在的位置不同,所以他们介导的氧化还原途径也有所不同。

图1 Trx1和Trx2氨基酸序列示意图Fig.1 The amino acid sequence of Trx1 and Trx2
2 Trx在凋亡途径中的功能
2.1细胞凋亡
细胞凋亡是一种程序性坏死过程,它是体内进行正常新陈代谢时所必须的,正常情况下,体内会根据机体自身的情况以及对外界的应激情况做出相应的调整,包括细胞的迁徙,增殖,分化和凋亡[7]。细胞凋亡整体分为两大途径,一是受体配体结合的外源途径,一是线粒体参与的内源途径。外源途径是通过死亡配体与相应受体(主要是肿瘤坏死因子:tumor necrosis factor:TNF)结合,活化半胱天冬酶家族成员,致使细胞凋亡。内源途径则是通过线粒体为中心引发的凋亡途径。当外源途径中的半胱氨酸天冬酶8(caspase8)活化后,会切割促凋亡因子Bid,促使促凋亡因子Bax从胞浆中转移到线粒体的膜上,改变线粒体膜的通透性,释放细胞色素C(cytc),最终导致细胞的凋亡[8-9]。
引发凋亡途径的起始因子有很多,而其中最为重要的是TNF家族成员TNF-а和活性氧簇(reactive oxygen species:ROS),TNF-а也是引发ROS产生的重要途径之一[10],所以两条途径并不是独立存在而是相互联系相互调节的,内源途径对外源途径起到级联放大的作用[9.11],两条途径中涉及的许多凋亡因子都与Trx有一定的相关性,研究他们之间的关系对于进一步了解细胞凋亡有着重要的意义(图3)。
2.2 Trx在凋亡途径中的作用
2.2.1 Trx的抗氧化作用
在细胞凋亡的过程中,会产生引发凋亡的关键因子ROS,它会诱发凋亡途径,致使细胞凋亡。这时体内的还原系统Trx会直接清理ROS,起到抗氧化的作用[12]。
作为体内的还原系统,Trx具有对抗自由氧基的功能,主要源于以下两个因素,第一:它包含保守序列-Cys-Gly-Pro-Cys-,可以与巯基作用,还原已氧化蛋白的巯基基团,自身形成二硫键,恢复蛋白的生理功能,维持细胞的生理活性,这段保守的氨基酸序列是Trx还原氧化物的关键活性位点。32位的半胱氨酸(C32)和35位的半胱氨酸(C35)对于Trx1的还原起重要作用,当受到氧化作用时,C32和C35内部会形成二硫键,这时Trx会暂时失去还原功能,再由硫氧还蛋白还原酶(thioredoxin reductase:TrxR)还原成本身的状态[13],参与体内可逆的氧化还原反应(图2)。人体正常代谢会导致许多自由氧基的产生,一般情况下,体内通过还原系统进行清理,但如果电子传递的过程中出现电子链的断裂,产生大量的ROS,体内的还原系统不足以清除,就会导致细胞凋亡。清理ROS的功能,体现了Trx的抗氧化作用,而这种抗氧化作用也间接的抑制了由ROS介导的细胞凋亡。第二,Trx对于各种还原酶系统都有显著的调节作用,例如超氧化物歧化酶(super oxidase dimutase:SOD),SOD对于治疗因超氧离子引起的各种疾病均有一定的疗效,Trx1可以上调SOD的mRNA,间接地活化SOD[10,14](图3),从而抵抗体内的氧化反应。又如谷胱甘肽还原系统,Trx是人体内谷胱甘肽过氧化物酶的电子供体,所以它的上调和下调都对谷胱甘肽系统有很大的调节作用[15-16]。所以Trx除了自身具有还原的作用外,对于其他的还原酶系统也起到了一定的上调作用,通过各种酶的相互协作,共同抵抗体内的氧化反应。
在Trx系统中,由于Trx2存在于线粒体内部,而线粒体是进行氧化呼吸的重要场所也是引发内源途径的发生场所,所以Trx2的抗氧化作用就显的尤其的突出,从而对线粒体引发的凋亡有重要的调节作用[17]。在整个氧化磷酸化的过程中,会有0.4%-4%的氧被释放到线粒体中,也就是ROS[10]。线粒体中包含三大复合体,Ⅰ和Ⅲ对于ROS的产生是必要的,但机制并不清楚,而Trx2对于呼吸链的复合体Ⅰ有抑制的作用,可以提高线粒体的膜电位,使活性氧逆转线粒体膜电位产生困难,从而抑制细胞的凋亡[18]。事实上,ROS的产生途径有很多,生理条件下的呼吸链以及病理条件下都会产生ROS。在病理条件下产生的ROS会导致细胞的过度凋亡,致使疾病的发生,所以Trx表现出来的抗氧化作用对于维持体内正常的生理条件是至关重要的。

图2 Trx氧化还原过程Fig.2 The redox processes of Trx
2.2.2 Trx调节凋亡转录因子的作用
Trx除了可以起到抗氧化的作用外,还可以调节一些凋亡转录因子,例如转录因子NF-κB(nuclear factor-k-gene binding)和AP-1(activator protein-1)等[19]。
Trx对于NF-κB有一定的调节作用(图3),NF-κB属于Rel家族的转录因子,参与调节与机体免疫、炎症反应、细胞分化有关的基因转录,进一步对凋亡和肿瘤的发生进行调节。在有氧化剂存在的情况下,NF-κB与DNA的连接会受到抑制,还原型的Trx可以抑制氧化剂,提高DNA和NF-κB的连接,活化NF-κB,并且这种还原作用比L-Cys和还原型的谷胱甘肽的作用更为强烈[17,20]。同时Trx可以通过c-Jun氨基末端激酶(Jun N-term inal Kinase:JNK)途径调节NF-κB。但若过量的表达Trx2也会有效地抑制NF-κB的活性[11]。NF-κB的活化在炎症诱发的肿瘤形成中发挥重要作用,同时发现NF-κB除了可以促进细胞存活外也可发挥促凋亡的作用,抑制肿瘤发生发展。由于NF-κB在肿瘤形成中存在两方面的作用,因此了解Trx对NF-κB两方面的调节机制,可以为肿瘤临床治疗提供理论依据[21-23]。
Trx还可以调节Ap-1,AP-1会对各种刺激如应激、辐射或生长信号等作出生理或病理应答,同时参与细胞的增殖、分化和转化等过程,在肿瘤的形成、转移和侵袭中发挥重要作用,研究发现AP-1与肿瘤的转化及转移密切相关,Trx可以通过JNK途径调节Ap-1,提高AP-1的表达,从而促进细胞的存活[24]。
2.2.3 Trx的抗凋亡作用
Trx对细胞的存活有重要的作用,若在细胞内转染Trx1SiRNA或Trx2SiRNA,都会造成细胞的凋亡。在凋亡过程中,凋亡信号调节激酶1(apoptosis signal-regulating kinase:ASK1)参与了细胞的凋亡过程[12]。
ASK1是凋亡途径中的重要的蛋白,C末端为调节性结构域,此结构域可以与调节TNF受体家族的成员因子(TNF receptor associated factor:TRAF)结合[25],当TNF与其受体结合之后,会募集接头蛋白(TRAF2),TRFA2会连接ASK1和MEKK1[7],使信号得到传递,TRAF对于ASK1结合活化促分裂素原活化蛋白激酶(m itogen-activated protein kinase:MAPKs)起重要作用。ASK1的N末端为功能性结构域,有648个氨基酸组成,N末端对于MAPKs起到活化作用,MAPKs是ASK1可活化多种下游信号中最为重要的一个,许多内源性的刺激,包括生长因子、细胞因子和应激反应都会活化MAPKs的三级联反应,即MAP3K-MAP2K-MAPK,MAPKs家族的成员共有3个,其中应激激活的蛋白激酶p38 (p38MAPKs),c-Jun氨基末端激酶(c-Jun N-term inal kinase:JNK),胞外信号调节激酶(extracellular signal-reg-ulated kinase:ERK)是细胞凋亡的重要信号途径,参与不同的应激反应。在ASK1缺失的细胞中,可以抵抗TNF和ROS诱导的细胞凋亡[26],说明ASK1在细胞凋亡途径起着中间枢纽的作用。ASK1可以通过丝裂原活化蛋白激酶MKK4/丝裂原活化蛋白激酶MKK7活化p38MAPKs,也可以通过丝裂原活化蛋白激酶MKK3/丝裂原活化蛋白激酶MKK6途径活化p38[27]。体内存在许多的抑制因子可以抑制ASK1介导的细胞凋亡,在哺乳动物中,Trx则是ASK1的直接抑制剂[28],而Trx/ASK1-MAPKs也成为引发细胞凋亡的经典途径[29]。
Trx一般会与ASK1的N末端相连,在体内抑制ASK1的活性,同时也就抑制了ASK1下游的MAPKs家族的活性,但当机体内产生某种氧化剂的时候,例如:TNF-а,氧化应激导致的ROS的产生等,就会阻断Trx-ASK1复合体的连接,氧化Trx(使C32和C35之间形成分子内的二硫键),释放ASK1(图2),在TRAF2的作用下活化下游的MAPKs家族成员,启动凋亡程序,调节MAPKs的TRAF2必须在Trx和ASK1分离之后,才会与ASK1结合[30],启动下游MAPKs的级联反应,所以Trx对于ASK1引发的凋亡途径起到了重要的调节作用。
Trx,由于存在的位置不同,导致抑制凋亡的途径也不同。Trx1主要抑制外源途径的凋亡,Trx2则阻止内源途径的凋亡。已经证实ASK1即存在于胞浆中,又存在于线粒体中,Trx1和Trx2分别抑制胞浆和线粒体内的ASK1,以阻断不同途径的细胞凋亡。但胞浆和线粒体中的ASK1启动的凋亡途径并不相同,在TNF诱导的细胞凋亡中,若在细胞中加入JNK的抑制剂,则可以完全的抑制TNF诱导的JNK途径以及Bid的切割和Bax的转位,但在存在JNK抑制剂的线粒体中发现ASK1大量的活化,而且cytc的释放也没有完全被阻断,说明胞浆中的ASK1介导的细胞凋亡包含了JNK途径,但在线粒体中ASK1并没有通过JNK途径致使细胞凋亡[31],但也有一些学者认为JNK对于cytc的释放必不可少,他们认为JNK可以使Bcl-2磷酸化,改变线粒体的膜电位同时改变线粒体膜的通透性,释放cytc,启动cytc介导的凋亡途径,JNK对于线粒体诱发的细胞凋亡起到信号转导的作用[7,32]。综合以上两种说法可以推测TNF促使了Trx1/ASK1的分离,导致ASK1活化了JNK途径,进而JNK在外源途径切割Bid,活化Bax,以促进内源途径的凋亡。而内源途径中ROS引发的Trx2/ASK1引起的凋亡也是细胞损伤的重要途径[33],虽然这条途径并没有完全被了解清楚,但是可以确定Trx2对于ROS起到清理作用,同时抑制线粒体中的ASK1,对线粒体介导的凋亡途径起到一定的抑制作用。Trx1和Trx2都是通过锚定凋亡信号分子,从而抑制细胞的凋亡(图3)。
由于线粒体膜的通透性与Bcl-2家族的成员有密切的关系,所以在研究细胞凋亡时,Bcl-2家族成员也常常成为研究焦点。在研究肺缺血再灌注损伤时,发现Trx干预组的Bax和ASK1表达显著下降,说明Trx可以对Bax起到抑制的作用,阻止了Bax对于线粒体膜通透性的改变,抑制细胞的凋亡[34]。
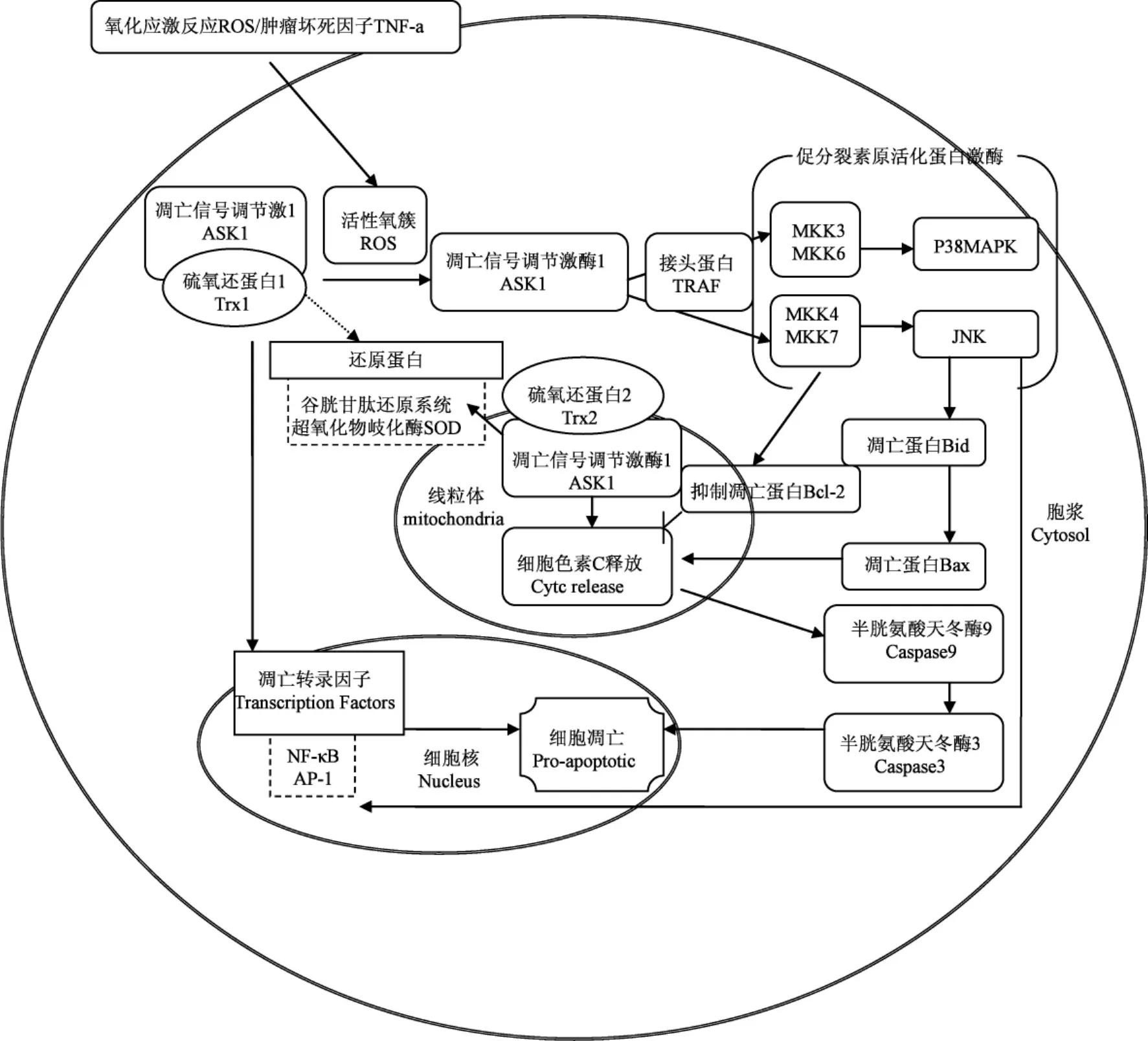
图3 Trx与凋亡相关因子之间的关系Fig.3 Trx relate to apoptotic factors
3 Trx与疾病
许多疾病的产生都是由于凋亡途径受损而引起的,而Trx广泛表达在各种细胞中,在凋亡途径中也起到了上游调控调因子的作用,因此在与凋亡引起的相关疾病中起着重要的调控作用。而由于Trx具有生长因子,抗凋亡,抗氧化的作用,因此许多肿瘤细胞中Trx的含量都会高于正常细胞,其中包括肺癌细胞,结肠癌细胞,胰腺癌细胞,乳腺癌细胞,胃癌细胞等。所以利用Trx在凋亡途径中的重要作用来治疗疾病也成了现在的研究热点。
Trx参与到许多的肺部疾病中,Trx-ASK1-JNK在吸烟引起的细胞凋亡中经常见到,Lee YC[31]等人发现吸烟会导致大量的ROS产生,而Trx的高表达可以抑制JNK的表达从而减少细胞的凋亡;同时Sato A[36]等人发现提高Trx1可以改善吸烟引起的肺部炎症;在临床实验中,发现如果提高Trx的表达可以保护肺部组织免受损伤,暗示着未来Trx可能作为关键因素来治疗肺部疾病[37]。
某些病毒的作用机制包含了Trx-ASK1-MAPKs这条途径,Yang TC发现日本脑炎病毒又称为乙型脑炎病毒进入体内,引起氧化应激的发生,Trx的含量下降,ASK1-MAPKs途径启动,导致细胞凋亡引发神经性的疾病[38]。
同样,许多药物的作用机制也包含Trx-ASK1-MAPKs途径,Lim PLK在研究曲格列酮的副作用时,发现曲格列酮破坏了电子传递链,导致线粒体内产生ROS,Trx2被氧化,从而引发ASK1-JNK途径,最终引起肝损伤[33]。YH Ma[39]等人发现,人重组的Trx1对脑缺血有治疗作用,由于脑缺血会导致ONOO-引起的氧化应激和细胞凋亡,而人重组的Trx1可稀释ONOO-并抵抗氧化/氮化引起的细胞凋亡。
4 展望
由于Trx在许多肿瘤细胞中的含量都比正常的细胞高,而且在凋亡途径中又起着至关重要的作用,所以透彻的了解Trx在凋亡途径中的作用机制,可对预防和治疗疾病开辟一条新的道路,相信Trx将成为肿瘤治疗中有前景的又一靶点分子。
[1]Moore EC,Reichard P.Enzymatic synthesis of deoxyribonucleotides VI.Isolation and characterization of thioredoxin,the hydrogen donor from Escherichia coli B[J].J.Biol.Chem.,1964,239:3453-3456.
[2]Moore EC,Reichard P.A thioredoxin-thioredoxin reductase system from rat tumor[J].Biochem.Biophys.Res.Commun.,1967,29(3):264-8.
[3]Pigiets PV,Conley RR.Purification of Thioredoxin,Thioredoxin Reductase,and Glutathione Reductase by Affinity Chromatography[J].The Journal of Biological Chemistry.1977,252(18):6367-6372.
[4]Gasdaska PY,Gasdaska JR,Cochran S,et al.Cloning and sequencing of human thioredoxin reductase[J].FEBS Lett.,1995,373(1):5-9.
[5]Holmgren A.Thioredoxin structure and mechanism:conformational changes on oxidation of the active-site sulfhydryls to a disulfide[J].Structure,1995,3:239-243.
[6]Powis G,Montfort WR.Properties and biological activities of thioredoxins[J].Annu Rev Pharmacol Toxicol.2001,41:261-95.
[7]Davis RJ.Signal transduction by the JNK group of MAP kinases[J].Cell,2000,103(2):239-252.
[8]Hatai T,Matsuzawa A,Inoshita S,et al.Execution of apoptosis signal-regulating kinase1(ASK1)induced apoptosis by the mitochondria-de-pendent caspase activation[J].Biol Chem,2000,275(34):26576-26581.
[9]Fulda,S.Betulinic acid:a natural product with anticancer activity[J].Mol Nutr Food Res,2009,53(1):140-146.
[10]Nonn L,W illiams RR,Erickson RP,et al.The absence of mitochondrial thioredoxin 2 causes massive apoptosis,exencephaly,and early embryonic lethality in homozygous mice[J].Mol Cell Biol,2003,23(3):916-922.
[11]Hansen JM,Zhang H,Jones DP.Mitochondrial thioredoxin-2 has a key role in determining tumor necrosis factor-alpha-induced reactive oxygen species generation,NF-kappa B activation,and apoptosis[J].Toxicol Sci,2006,91(2):643-650.
[12]Yang L,Wu D,Wang X,et al.Depletion of cytosolic or mitochondrial thioredoxin increases CYP2E1-induced oxidative stress via an ASK-1-JNK1 pathway in HepG2 cells[J].Free Radic Biol Med.2011,51(1):185-196.
[13]Holmgren A,Lu J.Thioredoxin and thioredoxin reductase:Current research with special reference to human disease[J].Biochem.Biophys.Res.Commun.,2010,396(1):120-124.
[14]Das KC,Lewis-MY,White,CW.Elevation of manganese superoxide dismutase gene expression by thioredoxin[J].Am.J.Respir.Cell Mol.Biol.,1997,17(6):713-726.
[15]Bjornstedt M,Xue J,Huang W,et al.The thioredoxin and glutaredoxin systems are efficient electron donors to human plasma glutathione peroxidase[J].Biol.Chem.,1994,269:29382-29384.
[16]Maulik N,Das DK.Emerging potential of thioredoxin and thioredoxin interacting proteins in various disease conditions[J].Biochim Biophys Acta,2008,1780(11):1368-1382.
[17]Circu ML,Aw TY.Reactive oxygen species,cellular redox systems and apoptosis[J].Free Radic Biol Med.2010,48(6):749-762.
[18]Chen Q,Vazquez EJ,Moghaddas S,et al.Production of reactive oxygen species by mitochondria:central role of complex III[J].Biol Chem,2003,278(38):36027-36031.
[19]Powis G,Mustacich D,Coon A.The role of the redox protein thioredoxin in cell growth and cancer[J].Free Radic.Biol.Med.,2000(3-4),29:312-322.
[20]Heilman JM,Burke TJ,McClain CJ,et al.Transactivation of gene expression by NF -κB is dependent on thioredoxin reductase activity[J].Free Radical Biol.Med.,2011,51(8):1533-1542.
[21]Zhang LQ,Blackwell K ,Altaeva A,et al.TRAF2 phosphorylation promotes NF-κB-dependent gene expression and inhibits oxidative stress-induced cell death[J].Mol Biol Cell,2011,22(1):128-140.
[22]Das KC.c-Jun NH2-terminal kinase-mediated redoxdependent degradation of IkappaB:role of thioredoxin in NF-kappaB activation[J].JBiol Chem,2001,276(7):4662-4670.
[23]Deng YB,Ren XY,Yang L,et al.A JNK-Dependent Pathway Is Required for TNFа-Induced Apoptosis[J].Cell Press,2003,115(1):61-70.
[24]Das KC,Muniyappa H.c-Jun-NH2 terminal kinase(JNK)-mediates AP-1 activation by thioredoxin:phosphorylation of cJun,JunB,and Fra-1[J].Mol Cell Biochem,2010,337(1 -2):53-63.
[25]Liu H,Nishitoh H,Ichijo H,et al.Activation of Apoptosis Signal-Regulating Kinase 1(ASK1)by Tumor Necrosis Factor Receptor-Associated Factor 2 Requires Prior Dissociation of the ASK1 Inhibitor Thioredoxin[J].Mol.Cell.Biochem.,2000,20(6):2198-2208.
[26]Tobiume K,Matsuzawa A,Takahashi T,et al.ASK1 is required for sustained activations of JNK/p38 MAP kinases and apoptosis.EMBO Rep,2001,2(3):222-228.
[27]Nagai H,Noguchi T,Takeda K,et al.Pathophysiological Roles of ASK1-MAP Kinase Signaling Pathways[J].Biochem.Mol.Biol.,2007,40(1):1-6.
[28]Saitoh M,Nishitoh H,Makiko Fujii M,et al.Mammalian thioredoxin is a direct inhibitor of apoptosis signal-regulating kinase(ASK)1[J].EMBO J,1998,17(9):2596-2606.
[29]Wu DF,Cederbaum A.Activation of ASK-1 and downstream MAP kinases in cytochrome P4502E1 potentiated tumor necrosis factorαliver injury[J].Free Radical Biol.Med.,2010,49 (3):348-360.
[30]Jun Matsukawa,Matsuzawa A,Takeda K.The ASK1-MAP Kinase Cascades in Mammalian Stress Response[J].Biochem.2004,136(3):261-265.
[31]Zhang R,Lamki RA,Bai LF,et al.Thioredoxin-2 Inhibits Mitochondria-Located ASK1-Mediated Apoptosis in a JNKIndependent Manner[J].Circ Res.2004,94:1483-1491.
[32]Tournier C,Hess P,Yang DD,et al.Requirement of JNK for Stress-Induced Activation of the Cytochrome c-Mediated Death Pathway[J].Science,2000,288(5467):870-874.
[33]Lim PLK,Liu JC,Go ML,et al.The Mitochondrial Superoxide/ Thioredoxin-2/Ask1 Signaling Pathway is Critically Involved in Troglitazone-Induced Cell Injury to Human Hepatocytes[J].Toxicol.Sci.,2008,101(2),341-349.
[34]Damdimopoulos AE,Vizuete AM,Huikko MP,et al.Human Mitochondrial Thioredoxin[J].J.Biol.Chem,2002,277 (36):33249-33257.
[35]Lee YC,Chuang CY,Lee PK,et al.TRX-ASK1-JNK signaling regulation of cell density-dependent cytotoxicity in cigarette smoke-exposed human bronchial epithelial cells[J].Am J Physiol Lung Cell Mol Physiol,2008,294(5):921-931.
[36]Sato A,Hoshino Y,Hara T,et al.Thioredoxin-1 Ameliorates Cigarette Smoke-Induced Lung Inflammation and Emphysema in Mice[J].J.Pharmacol.Exp.Ther.,2008,325(2):380 -388.
[37]Xu J,Li TP,Wu HQ,et al.Role of thioredoxin in lung disease.Pulm Pharmacol Ther.2012,25(2):154-162.
[38]Yang TC,Lai CC,Shiu SL et al.Japanese encephalitis virus down-regulates thioredoxin and induces ROS-mediated ASK1-ERK/p38 MAPK activation in human promonocyte cells[J].Microbes Infect.,2010,12(8-9):643-651.
[39]Ma YH,Su N,Chao XD et al.Thioredoxin-1 attenuates postischemic neuronal apoptosis via reducing oxidative/nitrative stress[J].Neurochem.Int.,2012,60(5):475-483.
