清开灵体外抗氧化活性与机制研究*
2012-01-15程发峰畅洪升钟相根王庆国
鲁 艺, 程发峰, 畅洪升, 钟相根, 王庆国
(1.北京中医药大学基础医学院, 北京 100029; 2.北京中医药大学中药学院, 北京 100102)
体内过多的活性氧(ROS)引起的氧化应激(Oxidative stress)是涉及人类多种疾病的发展与生理功能改变的一个重要因素。ROS是一类化学性质非常活泼的含氧原子或原子团,主要包括超氧阴离子自由基(02-)、羟自由基(-OH)和过氧化氢(H2O2)等。自由基增多对机体的毒害作用是多方面的,其中最容易受到攻击的是细胞膜及脂蛋白中的多聚不饱和脂肪酸,导致所谓的脂质过氧化。自由基可以通过氧化、交联、肽链断裂或聚集等方式使蛋白质、脂蛋白、酶蛋白、受体蛋白变性,引起酶失活和脑细胞结构功能损伤、坏死;也可以破坏RNA、DNA,引起基因突变,使转录异常、DNA复制异常,使机体发生免疫反应及癌变,细胞也可能因此而死亡。脑组织由于耗氧量较高而抗氧化酶活性较低,容易遭受自由基等氧化剂的损伤。因此,应用抗氧化剂清除大脑中起到破坏作用的自由基,对于预防和治疗中风以及神经退行性疾病具有重要意义。
清开灵在清热解毒通络机理方面已进行了深入研究,但其体外抗氧化能力及其相关机制尚缺乏足够的证据。因此,本实验从抗氧化反应的不同环节和靶点为切入点,在化学反应体系及基于细胞活性的生物体外反应体系中,分别观察了清开灵对自由基的清除能力、对黄嘌呤氧化酶的抑制作用以及对氧化损伤细胞的保护作用,并与已知的天然抗氧化剂槲皮素进行比较来研究清开灵的体外抗氧化机制。
1 材料与方法
1.1 实验试剂 Xanthine,xanthine oxidase(XO),hypoxanthine,XTT,MTT 购自Sigma,Taufkirchen,Germany。清开灵注射液由北京中医药大学药厂提供,槲皮素(quercetin)由FU实验室提供。SK-N-SH人神经母细胞瘤细胞株,购自 American Type Culture Collection(ATCC,No.HTB-11)。细胞培养液DMEM(sigma公司,D5796),500 mL DMEM中加入5mL Na3PO4(sigma公司,10101-89-0),5 mL非必需氨基酸溶液(GIBCO公司,1127865)及50 mL胎牛血清(Hyclone公司,SH30070),胰蛋白酶(美国sigma公司,T4799)。
1.2 方法
1.2.1 XO/XTT体系中自由基清除能力检测 模拟人体黄嘌呤/黄嘌呤氧化酶反应系统,产生O2-。参照Ukeda 等[1]方法操作,简述如下:50 mM Na2CO3buffer 调整PH值为10,取25 mL,与3 mM xanthine,3 mM EDTA,1.6 Mmxtt溶液各1 mL混合,充分混合溶解后,将溶液转入96孔酶标盘中,每孔230 μL。清开灵稀释为浓度分别为100、10、1 mg/mL,对照组加入等量的0.2% DMSO溶液。槲皮素作为阳性对照物。起始反应前每孔加入10 mL xanthine oxidase(0.056 unit),反应1 h。1 h后测定470 nm处吸光度。以对照孔的吸光度值代表对照组O2-的量为100%,其余各组超氧阴离子以百分数表示,(各组吸光度值/对照组吸光度值)×100%。
1.2.2 黄嘌呤氧化酶致尿酸生成检测 试管中分别加入40 mM Na2CO32.5、0.1 mM EDTA,0.04 mL,mM xanthine 0.04 mL and 0.04 mL 清开灵与槲皮素溶液并充分混合。反应开始前加入0.01 mL xanthine oxidase(0.04 Units)在293 nm分光光度仪检测吸光度。
1.2.3 SK-N-SH细胞的培养 SK-N-SH细胞在含10%胎牛血清的MEM细胞培养基中,5% CO2,37 ℃条件下培养,3 d换1次液,5 d传一代。传代时,先倒掉旧培养基,适量PBS液洗涤细胞1次以除去残留培养基,倒掉PBS液,加入0.25%胰蛋白酶液1~2 mL,消化1 min后,轻轻拍打细胞培养瓶,镜下观察细胞,待细胞变圆并分散游动后,倒掉胰蛋白酶液,加入新鲜的含10%胎牛血清的MEM培养基2 mL,用吸管吹打使细胞均匀分散为单层细胞,按1∶2分装入新的细胞培养瓶中。
1.2.4 次黄嘌呤/黄嘌呤氧化酶诱导的细胞氧化损伤及药物保护作用 SK-N-SH 细胞接种在96孔板中,每孔细胞数为1×104cells/well。24 h后将培养液移走,100 μM,50 μM,10 μM hypoxanthine 和2 mU/mL xanthine oxidase 溶解在 PBS中,每孔加入100 μL。分别孵育0.5、1、1.5 h。孵育相应的时间后,用MTT法检测各个浓度及作用时间的细胞存活率。
SK-N-SH 细胞接种在96孔板中,每孔细胞数为1×104cells/well。24 h后将培养液移走,100 μM hypoxanthine 和2 mU/mL xanthine oxidase 溶解在 PBS中,每孔加入100 μL。清开灵与槲皮素溶解在0.2%DMSO溶液中,终浓度为100、10、1 μg/mL也加入到细胞孔中,每孔100 μL。孵育 0.5、0.5 h 后,上清液吸走,换成含胎牛血清10%的MEM培养液,培养24、24 h后,新鲜配制MTT溶液,将MTT盐溶解在PBS溶液中,使其浓度为5 mg/mL。每孔加入MTT溶液20 μL,摇床上轻轻震荡3 min,继续培养2 h,弃上清,每孔加入100 lDMSO,摇床轻度震荡15 min,待紫色沉淀充分溶解后,测OD值,检测波长为580 nm,参考波长为620 nm。以对照组细胞存活率为100%,其余各组按存活率(%)=(各组吸光度值/对照组吸光度值)×100%。
2 实验结果
2.1 清开灵的自由基清除能力 在浓度为100 μg/mL时,清开灵的自由基清除率高达56.43±3.98%(P<0.01),略高于槲皮素;在浓度为10 μg/mL时,清开灵的自由基清除率28.07±2.52%(P<0.05)与同浓度槲皮素相当;在浓度为1 μg/mL时,二者自由基清除率均未与对照组显示显著差异。见表1。
2.2 清开灵对黄嘌呤氧化酶的抑制作用 清开灵在3个浓度均显示显著的抑制黄嘌呤氧化酶的作用,其在浓度100、10、1 μg/mL时,对黄嘌呤氧化酶的抑制率分别为72.59±4,76,66.1±2.98,57.94±3.81%,说明其对黄嘌呤氧化酶具有明显的抑制作用。见表1。
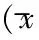
表1 自由基清除能力和黄嘌呤氧化酶活性 ±s ,%,n=8)
2.3 清开灵对次黄嘌呤/黄嘌呤氧化酶诱导的细胞氧化损伤的保护作用 在生理条件下,次黄嘌呤(hypoxanthine,HPX)在黄嘌呤氧化酶(xanthine oxidase,XO)的催化下可以生成黄嘌呤,并进一步氧化生成尿酸,同时产生超氧阴离子自由基,大量超氧阴离子堆积可以产生毒性,从而引起细胞和组织损伤。本实验在SK-N-SH细胞模型上,应用hypoxanthine 和xanthine oxidase反应体系(HPX/XO)建立细胞氧化损伤模型,通过MTT比色法分析细胞存活率的变化,从而揭示清开灵对细胞氧化损伤的保护作用。SK-N-SH细胞在hypoxanthine 100 μM,xanthine oxidase 2 mU/mL浓度下,作用0.5 h的条件下,细胞存活率明显下降,为正常组的58%。见表2。所以在该浓度及作用时间下,细胞氧化损伤的模型建立成功。在此模型上,加入药物之后可以看到,清开灵在100、10、1 μg/mL浓度下,可使细胞在HPX/XO氧化反应损伤条件下的存活率较模型组分别有显著提高,见表3。
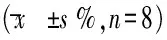
表2 不同时间点,不同浓度的HPX 在SK-N-SH细胞上对细胞生存率比较
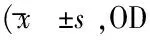
表3 清开灵注射液对SK-N-SH细胞生存率比较或%,n=8)
4 讨论
氧化应激是指机体或细胞内氧自由基的产生与清除失衡,导致活性氧在体内或细胞内蓄积而引起的氧化损伤过程。活性氧包括H2O2、O2·-、OH·,NO·等[2]。在病理因素作用下,氧化应激造成细胞损伤包括:(1)氧化DNA,攻击核物质,使染色质浓缩,DNA断裂,引起核苷酸二聚体化,复制过程出现错误,基因表达和调控异常[3];(2)氧化细胞内很多重要的蛋白质,改变其成分和活性,如酶、结构蛋白等,使其功能改变[4];(3)氧化细胞及亚细胞成分脂膜,引起生物膜不饱和脂肪酸的脂质过氧化反应,造成膜完整性及通透性破坏,最终导致膜功能障碍以及细胞溶解死亡[5]。上世纪70年代以来,生物学和医学的研究与实践积累了大量资料,证明氧化应激可导致人类多种疾病的发生发展,加速人体的衰老。近年来的研究显示,氧化应激是导致多种神经退行性疾病主要的病理因素之一,其中包括慢性神经退行性疾病如阿尔茨海默病(AD),和急性脑神经性疾病如中风[6]。
清开灵注射液被广泛用于治疗脑病,尤其是急性中风。目前,有文章已经研究证实清开灵对卒中动物模型具有良好的抗氧化作用,可以下调脑组织中MDA含量和SOD活性,并可减少ROS含量[7]。但是目前研究较多的集中在中药对氧化终产物含量的干预作用上,而对生理条件下超氧自由基离子生成过程及环节的干预作用研究甚少。槲皮素是一种良好的抗氧化成分[8],体外抗氧化作用主要包括直接清除超氧阴离子、羟自由基、脂质过氧化自由基等活性氧自由基,及可以抑制黄嘌呤氧化酶活性[9~10]。本实验结果表明,清开灵对氧自由基有很强的清除作用,其清除能力与天然槲皮素相当;在抑制黄嘌呤氧化酶作用方面,清开灵的作用优于槲皮素。可见,清开灵的抗氧化作用,不仅体现在清除自由基,也体现在干预氧化反应的酶活性方面,揭示了清开灵可从多个环节和途径阻止氧化反应的发生和发展。HPX/XO诱导的细胞氧化损伤模型进一步证实了清开灵的抗氧化作用。经过HPX/XO反应体系处理后的SK-N-SH细胞,细胞存活率明显下降,清开灵可显著提高细胞生存率,进一步显示出清开灵良好的体外抗氧化活性。笔者也证实了清开灵在缺血性中风及某些神经退行性病变中有一定的治疗作用[11~12],而其从多个环节和途径的抗氧化活性可能是其主要药效机制之一。
[1]Ukeda H,Maeda S.Spectrophotometric assay of superoxide anion formed in Maillard reaction based on highly water-soluble tetrazolium salt[J].Anal Sci,2002 ,18(10):1151~4.
[2]Maxwell SRJ.Prospects for the use of antioxidant therapies[J].Drugs,1995(49):345~361.
[3]Delanty N,Dichter MA.Oxidative injury in the nervous system[J]. Acta Neurol Scand,1998,(98):145~153.
[4]Robert B,Petersen,Akihiko Nunomura,et al. signal transduction cascades Associated with oxidative stress in Alzheimer’s disease[J].Alzheimer’s disease,2007,(11):143~152.
[5]Stohs SJ.The role of free radicals in toxicity and disease[J].Basic Clin physiol pharmacol,1995,(6):205~28.
[6]Finkel T,Hoolbrook NJ.Oxidants,oxidative stress and the biology of aging[J].Natuer,2000,(408):239~47.
[7]CHENG Fa-feng,GUO Shao-ying,ZHONG Xiang-gen,et al,a traditional Chinese medicinal preparation,protects from focal cerebral ischemia/reperfusion injury with a broad therapeutic window [J].Neural Regeneration Research,2011,6(21):1605~1611.
[8]Jovici A,Jovanovic M.Oxidative and antioxidative activity in the patients with disseminated demyelinating disease of central nervous system[J].Vo jnosanit Pregl,1997,(54):193~202.
[9]Noriyoshi Masuoka,Takahiko Isobe.Antioxidants from Rabdosia japonica[J].Phytother Res.2006,(20):206~213.
[10]Bray RC.Molybdenumiron-sulfur flavin hydroxylases and related enzymes[J].In the Ensymes Boyer PD,1975,(12):299~419.
[11]程发峰,郭少英,钟相根,等.清开灵注射液治疗小鼠局灶脑缺血损伤的时间窗研究[J].中华中医药杂志,2010,(12):2207~09.
[12]程发峰,郭少英,钟相根.清开灵注射液不同时间给药对MCAO小鼠血清SOD的影响[J].中国比较医学杂志,2011,21(3):43~48.
