反胶束萃取大豆蛋白前萃过程的动力学研究
2011-10-24高亚辉张淑霞陈复生
高亚辉,张淑霞,陈复生,万 珊
(1.洛阳理工学院环境工程与化学系,河南洛阳 471023;
2.洛阳出入境检验检疫局,河南洛阳 471023;
3.河南工业大学粮油食品学院,河南郑州 450052)
反胶束萃取大豆蛋白前萃过程的动力学研究
高亚辉1,张淑霞2,陈复生3,万 珊1
(1.洛阳理工学院环境工程与化学系,河南洛阳 471023;
2.洛阳出入境检验检疫局,河南洛阳 471023;
3.河南工业大学粮油食品学院,河南郑州 450052)
系统研究了影响总传质系数的各个主要因素(缓冲溶液pH、反胶束含水量W0、表面活性剂浓度、KCl浓度、振荡速度操作温度),探讨了以丁二酸二异辛酯磺酸钠(AOT)/异辛烷反胶束体系萃取大豆蛋白前萃过程的动力学。结果表明,大豆蛋白前萃过程中总传质系数随缓冲溶液pH和KCl浓度的升高先增大后减小,分别在pH7.0和KCl浓度0.1mol/L附近出现最大值;随W0和AOT浓度的增加而增大,当W0大于12时,总传质系数基本不变;随温度的变化总传质系数变化不大。由此可以推断出蛋白质的加溶过程,不仅与蛋白质分子和表面活性剂之间的静电相互作用力和疏水力有关,而且与界面阻力有关。
反胶束,大豆蛋白,动力学,机理,静电作用
反胶束是指表面活性剂在非极性有机溶剂中自发形成的热力学稳定和光学透明的纳米级聚集体。反胶束中极性头朝内,非极性尾朝外,排列形成亲水内核,称为“水池”。此水池具有增溶蛋白质、氨基酸和酶等生物物质的能力。自从20世纪70年代末提出用反胶束技术萃取蛋白质的概念以来,这一技术由于它的诸多优点而得到国内外学者的广泛研究[1-5]。为了深入了解反胶束萃取蛋白质或酶的机理,研究者报道了反胶束萃取蛋白质[6-9]、酶[10-12]和氨基酸[13-14]的动力学以及萃取后反胶束体系性质的变化[15]。但绝大多数都是使用低分子量的标准蛋白、一些高纯度的酶类和氨基酸在液-液萃取的体系中进行研究的,对于用反胶束体系从植物蛋白原料中萃取大分子蛋白质的动力学方面的研究至今未见报道。陈复生、赵俊廷[16-18]等人在国内首次报道了用反胶束萃取技术同时分离植物蛋白原料(花生和大豆)中的蛋白质和油脂,积累了一些基本数据,并且得到了萃取的最佳工艺参数。因此,本文在AOT/异辛烷反胶束体系萃取大豆蛋白最佳工艺基础上,直接选取缓冲溶液pH、W0、表面活性剂AOT浓度、离子强度、振荡速度和温度5个主要的影响因素对大豆蛋白前萃过程传质动力学进行探讨,为深入了解萃取过程的机理、强化萃取过程和开发适宜于本操作的关键设备提供理论基础。
1 材料与方法
1.1 材料与仪器
全脂大豆粉 过80目筛,粗脂肪21.75%,粗蛋白37.15%,水分5.88%,安阳升华植物蛋白有限公司;AOT 纯度98%,上海联民化工厂;异辛烷、卡尔费休试剂(无吡啶甲乙型) 天津市科密欧化学试剂开发中心;Na2HPO4、KH2PO4、KCl、浓硫酸、盐酸 洛阳化学试剂厂;NaOH、H3BO3开封化学试剂厂;K2SO4,CuSO4·5H2O 北京化工厂;所用试剂 均为分析纯;所用水 均为重蒸水。
自动水分测定仪 ZSD-I型,上海安亭电子仪器厂;气浴恒温振荡器 THZ-82B型,江苏省金坛医疗仪器厂;集热式磁力搅拌锅 DF-2型,上海沪西分析仪器厂;紫外分光光度计 UV-2000型,尤尼柯(上海)有限仪器公司;高速冷冻离心机(GL-12B型)、高速台式离心机(TGL-16G型) 上海安亭科学仪器厂;酸度计 HANNA pH211型,意大利。
1.2 实验方法
1.2.1 不同浓度反胶束溶液的配制 按照反胶束浓度(在0.03~0.12g/m L之间)的要求(如0.08g/m L)称取一定量的表面活性剂AOT,将其置于锥形瓶中,加入一定体积的异辛烷,磁力搅拌使表面活性剂完全溶解,然后加入浓度在0~1.0mol/L之间的KCl缓冲溶液(本实验用KH2PO4-Na2HPO4的缓冲体系配制KCl缓冲溶液,调节KH2PO4与Na2HPO4的比例,使溶液pH在4.0~9.0之间),于振荡器中振荡2h,然后在离心机上以5000 r/m in的转速离心20m in,溶液若透明则为反胶束,反之则不是[18]。
1.2.2 反胶束溶液中含水量(W0)的测定 采用卡尔费休氏滴定法[18]。
1.2.3 蛋白质前萃实验 取1.2.1中配制的一定浓度反胶束溶液20.0m L于100m L的锥形瓶中,加入0.3~0.6g全脂豆粉(精确到0.0001g),将其置于振荡器中,调节振荡器温度在20~50℃之间,以50~250r/min的速度振荡,每隔一定的时间取出1m L的样品置于离心管中,在离心机上以6000 r/m in的转速离心10m in后,然后以GB/T 5009.5-2003法测其中有机相中蛋白质含量(以萃取前的反胶束溶液作为空白样)。
2 前萃过程动力学方程的推导
前萃过程中蛋白质在(s)时间内从水相转移到有机相。假设水相体积为V1(m3),蛋白质在水相的浓度为C1(t)(mol· m-3);有机相的体积为V2(m3),蛋白质在有机相的浓度为C2(t)(mol· m-3)。

式(10)可用来描述前萃取蛋白质时萃取率随时间的变化,其中β可由体积比Vr和平衡常数m求得,而α值必须对式(10)进行迭代法求解。重复迭代计算α值直到所得E的计算值与实验值误差小于10%。从α的定义式中可以求得总质量传质系数KLA(因为无法求得两相界面面积,只能用KLA代替传质系数)。
3 结果与讨论
蛋白质萃取过程与蛋白质的表面电荷和反胶束内表面电荷间的静电相互作用,蛋白质的疏水性以及反胶束的大小的变化等因素有关,任何对这些作用产生影响的因素都将对蛋白质的萃取过程产生影响[1,4,8],如表 1 所示。本研究从传质动力学的角度直接选取pH、表面活性剂AOT浓度和KCl浓度和操作温度四个主要的影响因素对大豆蛋白前萃过程传质动力学进行探讨。

表1 影响蛋白质萃取过程的主要因素
3.1 振荡速度对总传质系数的影响
由图1可知,总传质系数随振荡速度的提高而增大,但高速区总传质系数的增大速率比低速区快。由于转速过高时,相界面发生波动,体系易乳化,所以最高转速限定为200 r/m in。振荡速度对总传质系数影响主要有两方面:增大振荡速度使得反胶束分散良好,增大了蛋白质与“空胶束”接触的相界面积;由于振荡使液体产生流动,对“空胶束”界面单分子层产生冲击作用。转速低时,对“空胶束”表面的冲击作用较小,当转速提高到相当的程度后,对“空胶束”的表面产生冲击作用较大,使得表面变得较“松散”,蛋白质较容易传递到反胶束内部。因此,其在高转速区的影响程度比在低速区高。

图1 振荡速度对总传质系数的影响
3.2 缓冲溶液pH对总传质系数的影响
由图2可以看出,总传质系数随pH的升高先增大后减小,在pH7.0附近出现最大值。因为开始时,pH接近大豆蛋白等电点(p I),蛋白质越接近等电点,溶解度越小,越难加溶于反胶束的“水池”中,导致总传质系数较小;随着pH的增大而远离p I,蛋白质的溶解度增大,有利于加溶至反胶束的“水池”中,总传质系数增加。但是,当 pH>p I时,蛋白质分子呈负电荷状态,AOT分子是阴离子表面活性剂,也呈负电荷状态,通常认为它们之间应呈静电斥力,而传统理论认为,蛋白质分子与阴离子型表面活性剂AOT分子之间的静电吸引力是蛋白质加溶于反胶束“水池”的主要推动力,因此,蛋白质加溶的主要原因不仅是静电吸引力的作用,而是还有其他的原因,如蛋白质具有的疏水性有时甚至起着主要作用[21]。
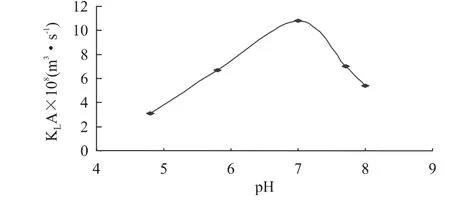
图2 缓冲溶液pH对总传质系数的影响
3.3 离子强度对总传质系数的影响
如图3所示,加入少量的KCl缓冲溶液时总传质系数迅速增大,KCl浓度在0.1mol/L附近总传质系数出现最大值;而当KCl浓度继续增大时,总传质系数反而减小。KCl浓度对总传质系数的影响主要有两方面:一是少量的KCl起盐溶作用,增加蛋白质的溶解度,从而总传质系数增大;当KCl浓度较大时,蛋白质与反胶束内表面之间的静电吸引减弱,界面阻力反而增强,因而总传质系数降低。结果表明,蛋白质加溶与反胶束的主要推动力不仅与两者间的静电引力有关,还与主体的扩散阻力有关。

图3 KCl浓度对总传质系数的影响
3.4 反胶束含水量(W 0)对总传质系数的影响
类似于水相胶束能加溶非极性液体,反胶束能加溶水或极性液体。加溶的推动力在于加溶物与反胶束内核中的表面活性离子的反离子之间的强离子-偶极子相互作用及加溶物与表面活性离子之间的强相互作用。反胶束内加溶水量W0是一个决定反胶束结构及物理性质的一个重要物理量。水的加溶对双亲分子的溶解性和胶束聚集数有较大的影响,从而导致胶束尺寸的增加。它与反胶束的尺寸之间的关系可以用水壳模型进行描述[22]。若用dWP表示反胶束“水池”的直径,V为反胶束溶液体积。则:
假定所有表面活性剂的极性头为刚性,且以As表示一个表面活性剂极性头所占面积,Cs表示溶液中表面活性剂的浓度。则:

式(18)为反胶束的“水池”直径和含水量W0与单个表面活性剂分子所占表面积之间的关系As,因此,W0的值本身也反映了反胶束的大小。
如图4所示,总传质系数随着W0的增加迅速增大,当W0大于12时,总传质系数基本不变。W0增大意味着反胶束中加溶水的量增加,水的加溶量对双亲分子的溶解性和胶束聚集数有较大的影响,并且影响反胶束的大小。一般认为,反胶束尺寸越大,越有利于蛋白质的加溶。

图4 含水量W0对总传质系数的影响
3.5 表面活性剂AOT浓度对总传质系数的影响
由图5可知,随着表面活性剂浓度的提高,总传质系数逐渐增大,再进一步增加AOT浓度,总传质系数的变化趋于平缓,再提高AOT的浓度并不会增大总传质系数的值。这可能是因为AOT浓度的增加使得单位体积反胶束溶液的反胶束的聚集数增加,增大了相界面积,从而增加了反胶束溶液的萃取能力,提高了总传质系数。然而,AOT浓度达到临界反胶束浓度时,相界面积相对恒定,因此总传质系数基本不变。

图5 AOT浓度对总传质系数的影响
3.6 萃取温度对总传质系数的影响
如图6所示,温度在25~45℃时,总传质系数稍有增加;在45~50℃时,总传质系数稍有减少。总的看来,在实验温度下,总传质系数随温度变化不大。可能有两方面的原因:一方面,温度的升高增加了反胶束微粒之间碰撞的几率,有利于蛋白质加溶于反胶束“水池”内;另一方面,温度的增大却降低了反胶束溶液的稳定性,不利于蛋白质的加溶。
4 讨论与结论

图6 温度对总传质系数的影响
根据上述研究,大豆蛋白萃取过程中增溶水的pH和离子强度对总传质系数的影响表明,大豆蛋白质的萃取过程不仅与蛋白质分子和表面活性剂之间的静电相互作用力有关,而且与界面阻力有关。这是因为根据Debye-Huckel静电屏蔽效应理论可知,离解的反离子在表面活性剂极性头附近建立了扩散双电层,它影响到蛋白质分子与带电界面间的静电吸引力克服其热运动所能达到的限度。这种静电作用力的特征距离是Debye长度,它与离子强度的平方根成反比[21]。因此增加离子强度就可以相应缩小静电引力的作用范围,从而抑制蛋白质的加溶,并且盐浓度的增大会对反胶束相产生脱水效应,反胶束的含水量随盐浓度的增大而降低,反胶束直径减小,空间排阻作用增大,蛋白质的溶解率下降。根据振荡速度对总传质系数的影响可知,增大振荡速度可使反胶束分散良好,使液体对“空胶束”界面单分子层产生冲击作用增大,从而增大蛋白质与“空胶束”接触的相界面积机会加快传质速率。
因此可以推断,蛋白质的加溶过程不仅与蛋白质分子和表面活性剂之间的静电相互作用力和疏水力有关,而且与界面阻力有关。然而,反胶束的萃取是一个非常复杂的过程,更完善的传质机制有待于进一步的深入研究。
[1]Dekker M,Riet K V,Van J J.Effect of temperature on the reversed micellar extraction of enzymes[J].Chem Eng,1991,46:69-74.
[2]Chou S T,Chiang bH.Reversed micellar extraction of hen egg lysozyme[J].Food Sci,2008,63(3):399-402.
[3]Zhao Xihong,Li Yanmei,He Xiaowei,et al.Study of the factors affecting the extraction of soybean protein by reverse micelles[J].Molecular Biology Reports,2009(3):10-17.
[4]Kinugasa T,Kondo A,Mouri E,et al.Effects of ion species in aqueous phase on protein extraction into reversed micellar solution[J].Separation and Purification Technology,2003,31(3):251-259.
[5]Zhao Xiaoyan,Chen Fusheng,Xue Wentong,et al.FTIR spectra studies on the secondary structures of 7S and 11S globulins from soybean proteins using AOT reverse micellar extraction[J].Food Hydrocolloids,2008(22):568-575.
[6]Dungan S R,Bausch T,Hatton T A.Interfacial transport processes in the reversed micellar extraction of proteins[J].Colloid Interface Sci,1991,145(1):33-50.
[7]Poppenborg L H,Brillis A A,Stuckey D C.The Kinetic Separation of Protein Mixtures Using Reverse Micelles[J].Separation Science and Technology,2000,35(6):843-858.
[8]Pinero J,Bhuiyan L B,Bratko D.Electrostatic interaction of charged dipolar proteins in reverse micelles[J].Chem Phys,2004,120(24):11941-11947.
[9]陆强,李宽宏,施亚钧.反胶束液-液萃取牛血清白蛋白的动力学研究[J].华东理工大学学报,1994,12(6):723-734.
[10]Ruey-Shin Juang,Hsiang—Chien Kao,Chiau-lin Shiau.Kinetic analysis on membrane-based reverse micellar extraction of lysozyme from aqueous solutions.[J].Membrane Sci,2006,281:636-645.
[11]Mathew D S,Ruey-Shin Juang.Improved back extraction of papain from AOT reversemicelles using alcohols and a counterionic surfactant[J].Biochemical Engineering,2005,25(3):219-225.
[12]陈少欣,林文銮.反胶束提取脂肪酶动力学研究(Ⅰ)萃取过程[J].华侨大学学报,1999,20(1):89-94.
[13]Nishiki T,Nakmura K,Kuto D.Forward and back extraction rates of amino acid in reverse micellar extraction[J].Biochem Eng,2000(4):189-195.
[14]Plucinski P,Nitsch W.Kinetics of interfacial phenylalanine solubilization in a liquid/liquid microemulision system[J].Phys Chem,1993,97:8983-8988.
[15]Gochman-Hecht H,Bianco-Peled H.Structure modifications of AOT reversemicelles due to protein incorporation[J].Colloid Interface Sci,2006,297(1):276-283.
[16]陈复生,赵俊廷,娄源功.利用反胶束萃取技术同时分离植物蛋白和油脂[J].食品科学,1997,18(8):43-46.
[17]杨宏顺,陈复生.反胶束中蛋白酶对前萃蛋白和油脂的影响[J].大豆科学,2003,22(4):257-260.
[18]磨礼现.利用反胶束技术萃取大豆蛋白的研究[D].郑州:郑州工程学院硕士学位论文,2004.
[19]Lye gL,Asenjo J A,Pyle D L.Protein extraction using reverse micelles:kinetics of protein partitioning[J].Chem Eng Sci,1994,49(19):3195-3204.
[20]Dovyap E,Bayraktar E,Mehmetoglu U.Amino acid extraction and mass transfer rate in the reverse micelle system[J].Enzyme Microbial Technology,2006,38(4):557-562.
[21]孙彦,史清洪,赵黎明.反胶束萃取蛋白质的模型:静电和疏水作用的贡献[J].化工学报,2003,54(6):796-801.
[22]Rabie H R,Vera JH.A Simple Model for Reverse Micellar Extraction of Proteins[J].Sep Sci Technol,1998,33(8):1181-1193.
Kinetics of the pre-extraction process of soybean protein by reversed micelles
GAO Ya-hui1,ZHANG Shu-xia2,CHEN Fu-sheng3,WAN Shan1
(1.Department of Environment Engineering and Chemistry,Luoyang Institute of Science and Technology,Luoyang 471023,China;2.Luoyang Entry-Exit Inspection and Quarantine Bureau,Luoyang 471023,China;3.College of Food Science and Engineering,Henan University of Technology,Zhengzhou 450052,China)
The kinetics of pre-extraction process of soybean protein were studied through systemical study on the effect of main factors(pH and ionic strength of buffer solution,W0,surfactant concentration,shaking speed and temperature)on total mass transfer coefficient in AOT(sodium bis-(2-ethylhexy)sulfosuccinate)-isooctane reverse micelle system.The results indicated that the total mass transfer coefficients increased first and then decreased with the buffer solution pH and the increasing of KCl concentration,at pH 7.0 and KCl concentration 0.1mol/L near maximum.The total mass transfer coefficient increased with increasing ofW0and AOT concentration.The total mass transfer coefficients basically remain unchanged,when the W0was greater than 12.The total mass transfer coefficients basically unchanged with temperature.It can be concluded that the extraction process of soybean protein were controlled not only the electrostatic and hydrophobic interaction force between soybean protein and surfactant molecules,but also the interface resistance.
reverse micelles;soybean protein;kinetics;coalescence;electrostatics interaction
TS201.2+1
A
1002-0306(2011)07-0071-05
2009-12-10
高亚辉(1978-),女,助教,硕士,研究方向:食品化工资源开发与利用研究。
国家教育部科学技术重点资助项目(205094);河南省杰出人才创新基金项目(0521000500);洛阳理工学院青年基金项目(2008QZ05)。
