花椒水溶性多糖的提取及其体外抗氧化活性研究
2011-10-24李谷才袁立华李立军
李谷才,袁立华,张 儒,李立军
(1.湖南工程学院化学化工系,湖南湘潭 411104;
2.湖南工程学院医院,湖南湘潭 411104;
3.湖南省益阳市赫山区妇幼保健医院,湖南益阳 413002)
花椒水溶性多糖的提取及其体外抗氧化活性研究
李谷才1,袁立华2,张 儒1,李立军3
(1.湖南工程学院化学化工系,湖南湘潭 411104;
2.湖南工程学院医院,湖南湘潭 411104;
3.湖南省益阳市赫山区妇幼保健医院,湖南益阳 413002)
通过正交实验,对水提法提取花椒多糖工艺进行了优化。实验结果表明,在选定的工艺条件下,各因素对花椒多糖提取率的影响顺序为提取时间>提取温度>料液比,最佳提取条件为料液比1∶20、提取温度95℃、提取时间4h,在最佳工艺条件下测得花椒粗多糖提取率为3.49%。体外抗氧化活性实验表明,花椒多糖能有效地清除体外Fenton反应产生的·OH,当花椒多糖浓度在2.0mg/mL以上时,对羟自由基的清除率在50%以上。
花椒,多糖,提取,抗氧化活性
花椒(Zanthoxylum Bungeagum Maxim)为芸香科植物,原产于我国,是一种传统的药食两用植物,在春秋时期就开始利用花椒的果实和嫩叶作调味品。花椒果实味辛、性温,归脾、胃、肾经,是一种重要的调味品;花椒果皮是香料和香精原料,种籽是优良的木本油料[1-2]。现代研究表明:花椒的化学成分主要有挥发油、生物碱、木脂素、香豆素、脂肪酸、蛋白质、氨基酸、黄酮等[3-7],对心血管系统、消化系统、免疫系统、凝血功能、镇痛、镇静、抗菌抑菌等均具有较强的药理作用[8-12]。多糖是自然界中广泛存在于有机体中的生物聚合物。研究表明,多糖具有提高免疫力、抗肿瘤、抗病毒、抗衰老、抗感染、抗溃疡等多种生物活性功能。多糖作为生命物质的组成成分之一,广泛参与了细胞的生命活动以及生理过程的调节,如免疫细胞间信息的传递与感受、细胞的转化、分裂及再生等活动。近年来,大量药理及临床研究表明,多糖类化合物具有免疫调节作用,它能激活免疫受体,提高机体的免疫功能[13]。到目前为止,已从天然产物中分离出300多种多糖类化合物,其中从植物,尤其是从中药材中提取的多糖尤为重要[14]。目前,对花椒的研究大部分集中于种植、加工、风味物质、化学成分、药理作用等方面,对其多糖的研究鲜有报道。本实验采用浸泡提取法提取花椒中的多糖,同时对提取工艺进行优化,并对花椒多糖的体外抗氧化活性进行研究,为花椒多糖的开发利用提供科学依据。
1 材料与方法
1.1 材料与仪器
花椒 购于湖南湘潭市双舟大药房,产地为四川;浓硫酸、蒽酮、无水乙醇、水杨酸、丙酮、三氯乙酸、葡萄糖、硫酸亚铁、过氧化氢 分析纯。
WND-200型高速中药粉粹机 浙江兰溪市伟能达电器有限公司;标准筛 杭州市蓝天化验仪器厂;BS323S电子天平 北京赛多利斯仪器系统有限公司;85-2集热式恒温加热磁力搅拌器 常州澳森电器有限公司;NH-4数显恒温水浴锅 国华电器有限公司;RE-52A旋转蒸发器 巩义市英峪予华仪器厂;UV-2102PCS型紫外-可见分光光度计 尤尼柯(上海)仪器有限公司;TDZ5-WS多管架自动平衡离心机 赛特湘仪离心机仪器有限公司;其它实验室常用玻璃仪器。
1.2 实验方法
1.2.1 样品预处理 将花椒于60℃恒温箱中恒温干燥24h,称重,粉碎后回流脱脂,回流2次,每次3h,除去溶剂,残渣进行脱色处理后干燥,置于试剂瓶中密封备用。
1.2.2 花椒中多糖的提取与蛋白质的去除 称取适量花椒粉置于圆底烧瓶中,按一定的料液比、提取温度、提取时间浸提三次,冷却后过滤,合并滤液,用脱脂棉过滤后将滤液减压浓缩至适当体积,离心(3000 r/m in,30m in),收集上清液。
向上清液中加入10%三氯乙酸,调节pH至3,在冰箱中放置过夜,离心(3000 r/m in,30min),弃去沉淀,得脱蛋白多糖溶液。
1.2.3 多糖沉淀 向去除蛋白的多糖溶液中加入三倍量的95%乙醇,置于-4℃冰箱中,醇沉24h,离心(3000 r/m in,30m in),收集固态物,依次用无水乙醇、丙酮、乙醚洗涤后于60℃干燥24h,得粗多糖固体。
1.2.4 多糖含量的测定 蒽酮-硫酸试剂的配制:准确称取200.0mg蒽酮,溶于80%硫酸中,用80%硫酸定容于100m L容量瓶中,配成2mg/m L的蒽酮-硫酸试剂备用。
葡萄糖标准曲线的制作:准确称取105℃干燥至恒重的葡萄糖100.0mg,用蒸馏水溶解定容于100m L容量瓶中,准确从中移取 1.0、2.0、3.0、4.0、5.0、6.0m L分别置于100m L容量瓶中,用蒸馏水定容。从6个梯度溶液中各移取1.0m L标准溶液加到6支具塞试管中,另一支具塞试管中加入1.0m L蒸馏水,然后向这7支试管中分别加入4.0m L上述蒽酮-硫酸试液,加入后立即置于冰水浴中冷却5m in,然后将7支试管同时浸入沸水浴中加热15min后取出,在自来水中冷却后,于620nm波长处用分光光度计测定其吸光度。得标准曲线方程为 A=0.01399c-0.00179,R2=0.999,符合线性关系。
1.2.5 多糖提取率的测定 称取适量粗多糖样品,定容于100m L容量瓶中,取1m L,按1.2.4方法测定其吸光度,根据标准曲线,算出多糖含量与质量。
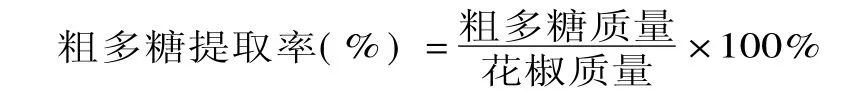
1.2.6 正交实验 提取过程中,对提取效果影响较大的因素主要有料液比、提取温度、提取时间、提取次数等,其中提取次数以2~3次为宜。因此本实验固定提取次数为3次,以料液比、提取温度、提取时间为变量,花椒中多糖提取率为评价指标,通过L9(33)正交实验(见表1),考察多糖最佳提取工艺。

表1 花椒中多糖提取因素水平表
1.2.7 体外清除羟基自由基活性实验 利用Fe2+与H2O2发生Fenton反应,产生羟基自由基,在体系内加入水杨酸捕捉羟基自由基,并产生有色物质,该物质在510nm处有最大吸收。本实验按照文献[15]的方法,在10m L离心管中依次加入0.5m L 9.0mmol/m L FeSO4溶液和0.5m L 30%H2O2溶液,混合后加入1m L 9.0mmol/m L水杨酸溶液和1m L蒸馏水。在37℃恒温水浴中反应30m in后流水冷却,2000 r/m in离心10m in,在510nm波长处测定其吸光度,将该吸光度值记为A0;分别用1m L样品溶液代替蒸馏水、1m L蒸馏水代替水杨酸,测定吸光度,并记为 A1、A2,则:
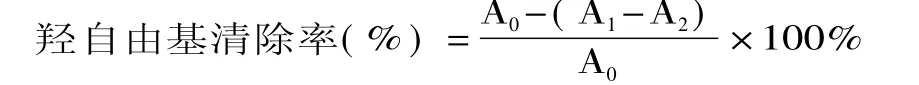
其中,A0为对照的吸光度,A1为样品的吸光度,A2为空白的吸光度。
2 结果与讨论
2.1 多糖提取与含量测定
正交实验结果及分析见表2。由表2可知,在选定的条件下,从花椒中提取多糖的最佳组合是A2B3C3,即料液比1∶20、提取温度95℃、提取时间4h;极差越大,因素的影响越大,在选定的工艺条件内,上述各因素的影响次序为:提取时间>提取温度>料液比。称取一定量花椒粉,在最佳工艺条件下提取三次,测得粗多糖提取率为3.49%。
2.2 花椒粗多糖体外抗氧化活性
羟自由基是活性氧中最活泼的自由基,也是毒性最大的自由基,它几乎能与活细胞中任何分子发生反应,且反应速度极快。花椒多糖对羟基自由基的清除效果见图1。由图1可知,花椒多糖对Fenton反应产生的·OH有清除作用。当反应体系中花椒多糖的浓度增大时,对·OH的清除作用明显增大,表明清除自由基能力与花椒多糖浓度之间有比较明显的量效关系。实验结果表明,花椒多糖能有效地清除体外Fenton反应产生的·OH,当花椒多糖浓度在2.0mg/m L以上时,对羟自由基的清除效率在50%以上。
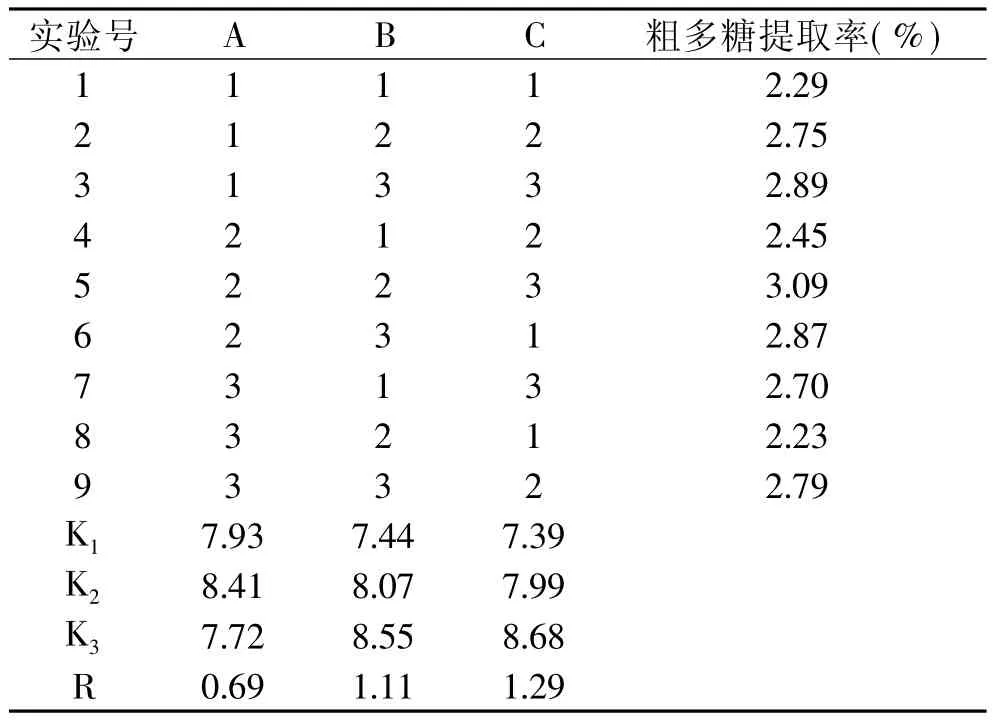
表2 正交实验结果表
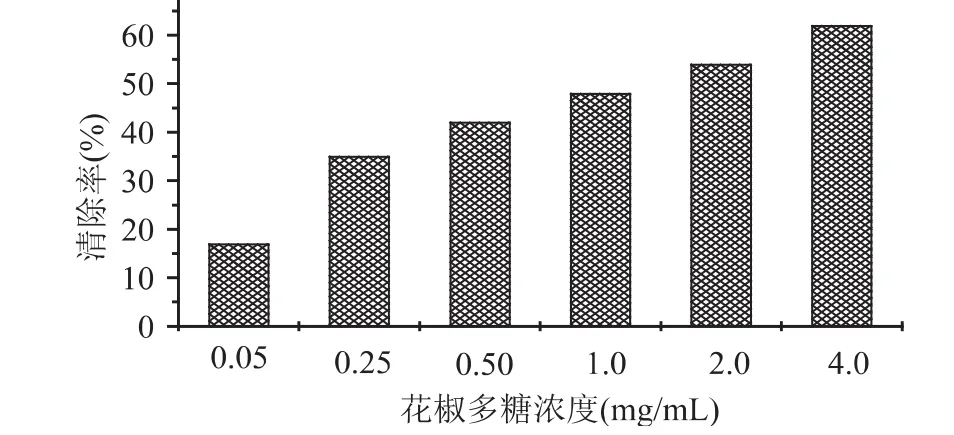
图1 花椒多糖对羟基自由基的清除作用
3 结论
影响花椒水溶性多糖提取的因素主要有提取时间、提取温度和料液比。在选定的工艺条件下,通过正交实验,确定水提法提取花椒多糖的最佳条件为料液比1∶20、提取温度95℃、提取时间4h。在此最佳条件下,提取三次,花椒多糖提取率为3.49%。在体外抗氧化活性实验中,花椒多糖能有效地清除Fenton反应产生的·OH;当花椒多糖浓度在2.0mg/m L以上时,对羟自由基的清除效率在50%以上,这表明花椒多糖体外抗氧化活性较强。花椒水溶性多糖的提取及其体外抗氧化活性结果表明,花椒可作为一种有效的自由基清除剂,具有较好的应用前景。
[1]崔俊,李孟楼.花椒开发利用研究[J].林业科技开发,2008,22(2):9-14.
[2]刘雄,阚建全,陈宗道,等.花椒风味成分的提取[J].食品与发酵工业,2003,29(12):62-66.
[3]贾利蓉,赵志峰,雷绍荣,等.汉源青花椒挥发油的成分分析[J].食品与机械,2008,24(3):105-108.
[4]祝诗平,王刚,杨飞,等.基于近红外光谱的花椒麻味物质快速检测方法[J].红外与毫米波学报,2008,27(2):129-132.[5]贺红早,陈训,李苇洁.顶坛花椒花粉活力及其对Zn的响应研究[J].安徽农业科学,2007,35(27):8432-8434.
[6]祝诗平,王刚,杨飞,等.粉末样品颗粒大小对花椒挥发油近红外光谱定量预测的影响[J].光谱学与光谱分析,2008,28(4):775-779.
[7]Eiji Yamazaki,Osamu Kurita.Extraction and characterization of the pectic substances from Japanese pepper(Zanthoxylum piperitum DC.)fruit[J].International Journal of Food Properties,2007,10(3):505-513.
[8]Eiji Yamazaki,Takayuki Fujiwara,Osamu Kurita,et al.Comparison of pectins from the alcohol-insoluble residue of Japanese pepper(Zanthoxylum piperitum DC.)fruit,a major byproduct of antioxidant extraction[J].Food Science and Technology Research,2008,14(1):18-24.
[9]William N Setzer,Joseph A Noletto,Robert O Lawton,et al.Leaf essential oil composition of five Zanthoxylum species from Monteverde,Costa Rica[J].Molecular Diversity,2005(9):3-13.
[10]Etsuko Sugai,Yasujiro Morimitsu,Kikue Kubota.Quantitative analysis of Sanschool compounds in Japanese pepper(Xanthoxylum piperitum DC.)and their pungent characteristics[J].Bioscience Biotechnology and Biochemistry,2005,69(10):1958-1962.
[11]赵晓侠.花椒的生物活性成分及其应用研究[J].长春大学学报,2008,18(1):108-110.
[12]Yang X G.Aroma constitutes and alkylamides of red and green Huajiao(Zanthoxylum bungeanum and Zanthoxylum schinifolium) [J].Journal of Agricultural and Food Chemistry,2008,56(5):1689-1696.
[13]李正鹏,吴萍,吴苏青.树舌胞内多糖抗氧化活性的研究[J].食品工业科技,2010,31(6):108-110.
[14]Qiong Wu,Cheng Zheng,Zheng-Xiang Ning,et al.Modification of Low Molecular Weight Polysaccharides from Tremella Fuciformis and Their Antioxidant Activity in Vitro[J].International Journal of Molecular Sciences,2007(8):670-679.
[15]贾之慎,邬建敏.比色法测定Fenton反应产生的羟自由基[J].生物化学与生物物理进展,1996,23(2):184-186.
Extraction and antioxidation activity in vitro of Zanthoxylum Bungeagum Maxim polysaccharides
LIGu-cai1,YUAN Li-hua2,ZHANG Ru1,LILi-jun3
(1.Department of Chemistry and Chemical Engineering,Hunan Institute of Engineering,Xiangtan 411104,China;
2.Hospital of Hunan Institute of Engineering,Xiangtan 411104,China;
3.Women and Children’s Healthcare Hospital of Heshan District,Yiyang 413002,China)
The water extraction of polysaccharides from Zanthoxylum Bungeagum Maxim was optimized by orthogonal experiments and in vitro antioxidation activity of the polysaccharides was evaluated by hydroxyl radicals scavenging method.The experimental results showed that the order of different factors affecting extraction rate was extraction time,extraction temperature and ratio of material to water.The optimal experimental parameters were 1∶30 ratio of material to water,95℃ extraction temperature,4h extraction time.Under the optimum extraction conditions,the extraction rate was 3.49%.In vitro antioxidation activity test indicated that the Zanthoxylum Bungeagum Maxim polysaccharide had powerful scavenging efficiency to hydroxyl radicals.When the content of Zanthoxylum Bungeagum Maxim polysaccharides was above 2.0m g/m L,its scavenging efficiency to hydroxyl radicals was more than 50%.
Zanthoxylum Bungeagum Maxim;polysaccharide;extraction;antioxidation activity
TS201.2+3
B
1002-0306(2011)08-0258-03
2010-07-23
李谷才(1969-),男,博士,主要从事药物及天然产物开发研究。
湖南省自然科学基金资助项目(07JJ6014);2008年度湖南工程学院科研启动基金项目(0847)。
