DNA染料结合环介导等温扩增技术检测志贺氏菌死活细胞
2011-10-24孙远明钟青萍
李 月,王 丽,孙远明,钟青萍
(华南农业大学食品学院,广东广州 510640)
DNA染料结合环介导等温扩增技术检测志贺氏菌死活细胞
李 月,王 丽,孙远明,钟青萍*
(华南农业大学食品学院,广东广州 510640)
建立了一种DNA染料(EMA)结合环介导等温扩增技术(Loop-mediated isothermal amplification,LAMP)的分析方法(EMA-LAMP),用于有效检测区分病原微生物志贺氏菌的死活细胞。基于志贺氏菌ipaH基因的六个区域设计特异性的引物,检测志贺氏菌的死活细胞。结果表明:浓度为40μg/mL的EMA能够有效抑制109CFU/mL的死细胞扩增,而对相同浓度的活菌扩增没有影响。分析表明,该方法可以有效区分细菌的死活细胞,克服了传统PCR无法区分死活细胞的弊端,同时EMA-LAMP检测方法耗时短,检测灵敏度高,是一种能够有效鉴别病原菌死活细胞的新方法。
ethidium monoazide,环介导等温扩增技术(LAMP),Shigella,死活细胞
志贺氏菌(Shigella)是引起细菌性痢疾最为常见的致病菌,食源性志贺氏菌中毒的最主要原因是从事食品加工行业的人员患痢疾或带菌者污染食品,食品接触人员个人卫生差,存放已污染的食品,储存条件不当等[1]。志贺氏菌属在我国感染性腹泻病原菌中居首位,人类对志贺氏菌有很高的易感性,103~104CFU/m L细菌可致病,在幼儿中可引起急性中毒性菌痢,死亡率很高[2]。目前国内外对于志贺氏菌的检测方法主要采用传统的分离鉴定方法,分子生物学方法如PCR以及免疫学方法等。传统的微生物培养方法不仅耗时长,而且检测的灵敏度不高;自聚合酶链式反应(PCR)技术问世以来,PCR技术在检测食源性致病菌方面得到了广泛的应用。PCR技术结合其他技术又衍生出许多PCR改良技术,如荧光定量PCR、即时PCR等,这些技术在检测食源性致病菌方面,不仅耗时短,而且检测的灵敏度高[3-4]。环介导等温扩增技术(Loop-mediated isothermal amp lification,简称LAMP)是一种新的核酸扩增方法,其特点是在恒温条件下保温十几分钟,即可完成核酸扩增反应,能够在1h之内,将目的DNA片段扩增109~ 1010倍[5]。Ethidium monozaide(EMA) 是 一 种DNA结合染料,能够渗透到细胞壁(膜)不完整的菌体内,在光激活的条件下,易形成氮宾化合物与DNA或其他分子共价结合[6-7],从而抑制死细胞DNA的扩增,而对活细胞的DNA不起作用。本实验通过EMA的选择渗透性与LAMP检测技术相结合(EMALAMP),检测志贺氏菌活细胞基因ipaH,有效区分志贺氏菌的死/活细胞。

表1 EMA-LAMP反应引物序列
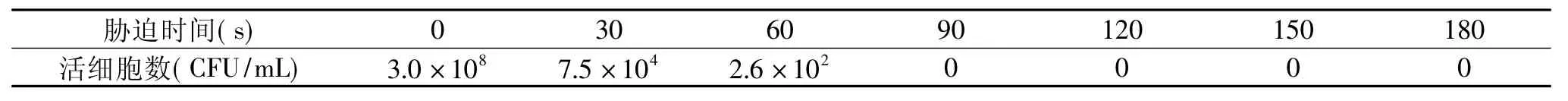
表2 胁迫条件对志贺氏菌的影响
1 材料与方法
1.1 实验材料
实验菌株 购自中国普通微生物菌种保藏中心,菌株编号为1.1869;引物 上海英俊生物技术公司合成;Ethidium Monoazide,Betaine 美国 Sigma公司;Bst DNA聚合酶 BioLabs公司。
1.2 实验方法
1.2.1 志贺氏菌的培养条件 接种志贺氏菌到灭菌Luria-Bertani(LB)肉汤培养基中(1%胰蛋白胨、0.5%酵母粉、1%NaCl,pH7.5),摇床培养过夜(37℃,120 r/m in),使用涂布平板法检测志贺氏菌可培养数为1.0×109CFU/m L。
1.2.2 胁迫条件 取1m L上述菌悬液于1.5m L的离心管中,按每隔15s放入3个管,分别置于95℃水浴锅加热处理,涂布营养琼脂平板,37℃培养24h后观察计数[8]。
1.2.3 EMA处理志贺氏菌活/死细胞 取志贺氏菌活/死细胞各1m L(1.0×109CFU/m L)置于无菌离心管中,分别加入不同浓度的EMA,并置于黑暗中常温放置5min,然后将离心管放置在冰上,用650W卤素灯曝光 10m in[9]。
1.2.4 志贺氏菌DNA制备 取细菌培养物1m L于12000r/min离心5min,弃上清并收集菌体,加入1m L细胞裂解液(2%Triton X-100,2.5mg/m L叠氮化钠,溶解在0.1mol/L Tris-HCl中,pH8.0),将沉淀充分混匀后,于100℃沸水浴10min,冰上放置5min,12000r/min离心5m in,上清即为 DNA模板,-20℃保存备用[10],实验中阴性对照采用灭菌的去离子水代替上清作为EMA-LAMP反应的模板。
1.2.5 EMA-LAMP反应体系 LAMP反应需要四条引物,包括两条外引物(F3和B3)和两条内引物(FIP和BIP)。它们能够特异结合靶序列上的6个区域,选取GenBank发布的志贺氏菌携带的ipaH基因序列,在序列1075~1268bp设计LAMP反应的引物,见表1。EMA-LAMP反应体系为 10×Thermopol reaction buffer,1.6mmol/L dNTP,5mol/L betaine,6mmol/L MgSO4,Bst DNA聚合酶及内外引物,反应体系的体积为25μL。反应条件为65℃ 45min,80℃2m in,终止反应。反应结果通过2%的凝胶电泳检测,电压75V,电泳时间45m in,如果为阳性反应,则产生典型的阶梯状条带,如果为阴性反应,则无条带产生[11-12]。
1.2.6 不同EMA浓度处理志贺氏菌活/死细胞 取不同浓度的志贺氏菌活/死细胞各 1m L(1.0×109CFU/m L)置于无菌离心管中,分别加入不同浓度的EMA并置于黑暗中常温放置5min,然后将离心管放置在冰上,用650W卤素灯曝光10m in,按照1.2.4方法提取菌体DNA,作为LAMP反应的DNA模板进行 LAMP扩增和电泳分析[13]。
1.2.7 EMA处理不同活细胞比例志贺氏菌菌悬液
将上述菌悬液配制含有一定比例活细胞菌悬液混合体系,配制完成后,使体系中活细胞的数量分别为:1.0 ×106、1.0 × 105、1.0 × 104、1.0 × 103、1.0 × 102、1.0×101、1.0CFU/m L,向体系中加入40μg/m L(终浓度)EMA,置于黑暗中常温放置5min,然后将离心管放置在冰上,用650W卤素灯曝光10min,按照1.2.4方法提取菌体DNA,作为LAMP反应的DNA模板进行LAMP 扩增和电泳分析[12]。
1.2.8 优化曝光时间 取志贺氏菌活细胞菌悬液和死细胞菌悬液各1m L(1.0×107CFU/m L)置于无菌离心管中,加入40μg/m L(终浓度)EMA并置于黑暗中常温放置5m in,然后将离心管放置在冰上,用650W卤素灯曝光,选取曝光时间为1、5、10、15m in。提取菌体DNA,作为LAMP反应的DNA模板进行LAMP扩增和电泳分析[13]。
2 结果与讨论
2.1 胁迫条件对志贺氏菌的影响
对菌悬液热处理的结果见表2。从表中可以看出,在95℃的条件下,热处理时间为90s时,平板菌落数为零,实验过程中,为了确保细菌致死率为100%,实验选择胁迫条件为95℃,3m in。
2.2 不同浓度EMA对志贺氏菌活细胞菌悬液的影响
将菌液浓度为1.0×109CFU/m L的活细胞菌悬液使用EMA处理,取细胞裂解液进行LAMP扩增,产物于2%的琼脂糖凝胶电泳分析(见图1)。结果表明,1.0×109CFU/m L的副溶血弧菌经过不同浓度的EMA处理后,仍然能够扩增出特异性的阶梯状条带,当EMA的浓度高达100μL/m L时,扩增出的条带仍然比较清晰明亮,表明EMA对活菌细胞没有影响或者影响不大。
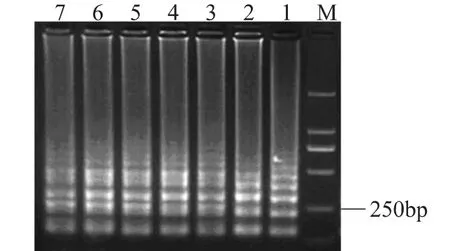
图1 不同浓度EMA对活菌(1.0×109 CFU/mL)的影响
2.3 不同浓度EMA对志贺氏菌死细胞菌悬液的影响
将菌液浓度为1.0×109CFU/m L的活细胞菌悬液进行热处理(95℃,3m in),热处理后的菌悬液使用EMA处理后,取细胞裂解液进行LAMP扩增,产物于2%的琼脂糖凝胶电泳分析(见图2)。从图中可以看出,1.0×109CFU/m L热处理的菌悬液在不使用EMA处理的情况下,能够扩增出特异性的阶梯状的条带,但是随着EMA浓度的增加,其扩增产物的电泳条带亮度逐渐减弱,当EMA的浓度达到40μg/m L或者更高浓度时,无扩增产物出现,40μg/m L EMA可以抑制1.0×109CFU/m L死细胞菌悬液DNA扩增。
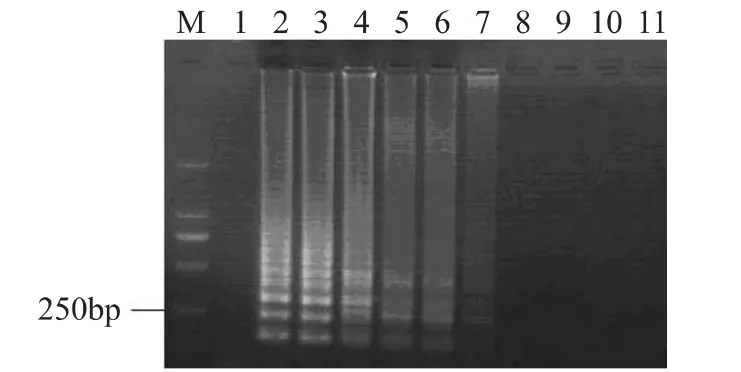
图2 不同浓度的EMA对死菌(1.0×109 CFU/mL)的影响
2.4 EMA溶液对不同活细胞比例志贺氏菌菌悬液的影响
将含不同比例的活细胞菌悬液进行热处理(95℃,3m in),热处理后的菌悬液使用EMA处理,取细胞裂解液进行LAMP扩增,产物于2%的琼脂糖凝胶电泳分析(见图3),从图中可以看出,随着活细胞数目的降低,其扩增产物的电泳条带亮度逐渐减弱,当活细胞数目降低到10CFU/m L时,EMA-LAMP没有扩增条带,说明当体系中活菌数目低于100CFU/mL,混合体系中死细胞的DNA就能够被抑制,从而可以说明EMA-LAMP检测细菌活/死细胞的灵敏度为100CFU/m L。
2.5 曝光时间对EMA-LAMP反应的影响
浓度为1.0×109CFU/m L的活细胞悬液使用40μg/m L的EMA进行处理,分别选择曝光时间为1、5、10、15m in,EMA 处理后,用裂解法对细菌悬液细胞进行裂解,使用裂解液作为模板进行LAMP反应,结果如图4所示,曝光时间从1~15m in均能扩增出特异性的阶梯状条带。
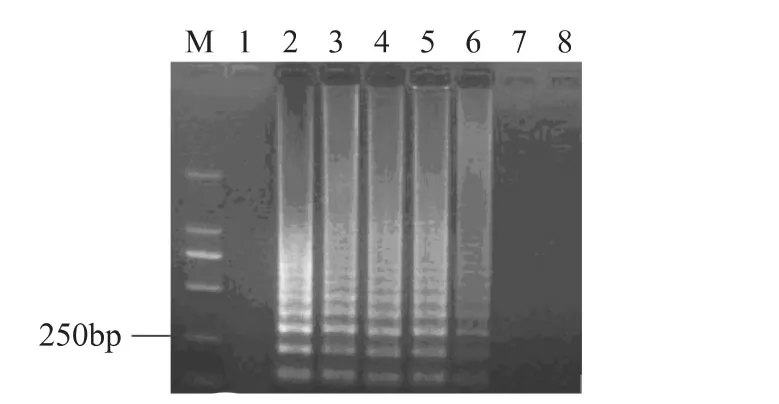
图3 40μg/mL的EMA对不同浓度比例活细胞菌悬液的影响
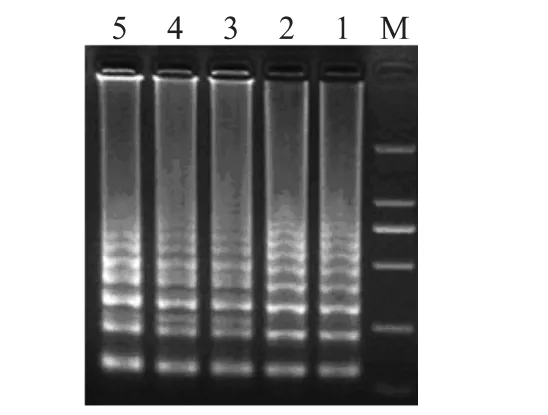
图4 曝光时间对活菌的影响
将浓度为1.0×109CFU/m L的活菌细胞悬液使用热处理的方法进行灭活后,使用40μg/m L的EMA进行处理,分别选择曝光时间为 1、5、10、15m in,EMA处理后,用裂解法对细菌悬液细胞进行裂解,使用裂解液作为模板进行LAMP反应,结果如图5所示,经过1m in曝光处理后,可抑制1.0×109CFU/m L的死细胞DNA的扩增。此结果与其他文献报道的结果一致。综合以上两种结果,本实验选择的曝光时间为10m in,以确保多余的EMA能够全部被光分解,从而不影响LAMP扩增的效果,同时花费的时间不是太长,能够有效地控制检测所需要的时间。
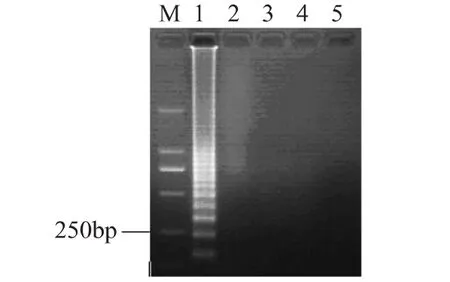
图5 曝光时间对活菌的影响
3 讨论
在国际上每年都有关于由志贺氏菌引起的食物中毒事件发生,给人类的身体健康、公共卫生等监控带来了极大的挑战。分子生物学方法能够有效地检测志贺氏菌,传统的PCR技术可用于检测包含活细胞和死细胞,因为尽管微生物细胞失去活力,其DNA仍然存在于环境中。因此,利用PCR选择性扩增细菌活细胞DNA面临着巨大挑战。通过研究发现,可以将DNA染料与PCR方法结合,进行区分致病菌死活细胞,但是PCR方法依赖精密的温度循环装置,而且必须要在实验室进行,因此一定程度上限制了其应用。
LAMP方法是一种新型的DNA扩增方法,该方法在恒温条件下即可完成反应,没有核酸的变复性过程,因此不需要特殊的仪器,只需要水浴锅即可完成反应,比较适合在实验室之外的地点进行检测,因此LAMP应用更加广泛。
EMA能够渗透到细胞壁(膜)不完整的菌体内,在光激活的条件下,易形成氮宾化合物与DNA或其他分子共价结合,从而抑制死细胞DNA的扩增,而对活细胞的DNA不起作用。利用EMA与LAMP检测技术结合,不仅可以有效区分病原菌的活死细胞,而且可以使反应迅速完成,反应的灵敏度也很高,可以达到100CFU/m L。本文采用EMA-LAMP检测方法,有效区分志贺氏菌活死细胞,实验证明,40μg/m L EMA足以抑制1.0×109CFU/m L死细胞菌悬液扩增,而对活细胞菌悬液的扩增则没有影响,考虑到实际的病原菌的检测中,109CFU/m L的菌液浓度已经是非常高的含菌量,所以实验最终确定40μg/m L的EMA为最佳的检测浓度。
[1]黄宝华,陈庆森,庞广昌.志贺氏菌研究及其快速检测技术发展现状[J].食品科学,2004,25(11):333-336.
[2]侯君.一起宋内氏志贺氏菌引起的食物中毒调查[J].预防医学文献信息,2003,9(6):707.
[3]蔡亦红.PCR快速检测食品中志贺氏菌方法的建立[J].中国人兽共患病学报,2008,24(2):150-153.
[4]胡建华,李洁莉.牛奶样品中志贺氏菌的快速PCR检测技术研究[J].食品科学,2007,28(8):433-437.
[5]Notomi T,Okayama H,Masubuchi H,et al.Loop-mediated isothermal amplification of DNA[J].Nucleic Acids Research,2000,28(12):63-70.
[6]Nocker A,Ching-Ying C,Camper A K.Comparison of propidium monoazide with ethidium monoazide for differentiation of live vs.dead bacteria by selective removal of DNA from dead cells[J].Journal of Microbiological Methods,2006,67:310-320.
[7]Walters C,Bolkan H,Luo LX,et al.Quantification of viable cells of clavibacter michiganesis subsp.Michiganensis using a DNA binging dye and a real-time PCR assy[J].Plant Pathology,2008,57:332-337.
[8]冯建军,金志娟,刘西莉,等.一种DNA染料结合聚合酶链反应检测鉴别植物病原细菌死活细胞[J].高等学校化学学报,2008,29(5):944-948.
[9]Jung-Lim L,Robert EL.Use of ethidium bromidemonoazide quantification of viable and dead mixed bacterial flora from fish fillets by polymerase chain reaction[J].Journal of Microbiological Methods,2006,67:456-462.
[10]Abolmatty A,Oliver JD,Levin RE.Development of a new lysis solution for releasing genomic DNA from bacterial cells for DNA amplification by polymerase chain reaction[J].Microbios,2000,101:181-189.
[11]Hisatoshi K,Tomohiro I,Koki A,et al.Sensitive and Rapid Detection of Herpes Simples Virus and Varicella-Zoster Virus DNA by Loop-mediated Isothermal Amplification[J].Journal of Clinical Microbiology,2005,43:3290-3296.
[12]Hayashi N,Arai R,Tada S,et al.Detection and identification of Brettanomyces/Dekkera ap.yeasts with a loop-mediated isothermal amplification method[J].Food Microbiology,2007,24(7-8):780-785.
[13]Jung-Lim L,Robert EL.Quantification of total viable bacteria on fish fillets by using ethidium bromidemonoazide realtime polymerase chain reaction[J].International Journal of Food Microbiology,2007,118:312-317.
Differentiation of the viable and dead cells of Shigella by Loop-mediated isothermal amplificaiton with a DNA binding dye
LIYue,WANG Li,SUN Yuan-ming,ZHONG Qing-ping*
(College of Food Science,South China Agricultural University,Guangzhou 510640,China)
Conventional DNA-based detection methods can be used to detect both live and dead cells.Since dead cells do not cause disease,which bring a problem in medicalor biological studies.The Loop-mediated isothermal amplification(LAMP)method combined with the ethidium monoazide(EMA)treatment was applified with viable,but not dead Shigella cells.LAMP method em ploys a DNA polymerase and a set of specially designed primers that recognize a total of six distinct sequences on the target ipaH gene conserved in Shigella.The results showed that the concentration of EMA was 40μg/m L,DNA amplification was inhibited derived from dead cellsuspensions(1.0 ×109CFU/m L),but not inhibit viable cells.These results showed that EMA-LAMP method had a potential for specific detection of viable cells,one hand,EMA had the ability to penetrate selectively through the damaged cytoplasmic membrane of dead cells and to intercalate into DNA,the gene of the dead cells could not be amplified.On the other hand,EMA-LAMP had high sensitivity and specificity.
ethidium monoazide;loop-mediated isothermal amplification;Shigella;viable-dead cell
Q789
A
1002-0306(2011)08-0216-04
2010-07-08 *通讯联系人
李月(1982-),女,硕士研究生,主要从事分子生物学方面的研究。
广东省农业攻关重点专项(2009A020101004);国家自然科学基金(31000781)。
