麦麸阿魏酰低聚糖抗氧化性的研究
2011-10-24齐希光郭晓娜钱海峰
齐希光,张 晖,王 立,郭晓娜,钱海峰
(江南大学食品科学与技术国家重点实验室,江南大学食品学院,江苏无锡 214122)
麦麸阿魏酰低聚糖抗氧化性的研究
齐希光,张 晖*,王 立,郭晓娜,钱海峰
(江南大学食品科学与技术国家重点实验室,江南大学食品学院,江苏无锡 214122)
研究了麦麸中阿魏酰低聚糖(FOs)的体外抗氧化作用。结果表明,FOs具有良好的体外抗氧化效果,并在一定范围内呈剂量效应关系。其对Fe2+具有一定的螯合作用,对H2O2的清除作用略低于同浓度的VC,而对·OH的清除作用却高于同浓度的甘露醇,对DPPH·的清除能力与BHT有相同的变化趋势,清除能力略低于同浓度的BHT,对H2O2诱导小鼠红细胞溶血具有明显的抑制作用。
麦麸,阿魏酰低聚糖,抗氧化,自由基
近年来,有关谷物和以谷物为原料制品的抗氧化性质的研究报道较少[1]。谷物中的酚酸类化合物,包括阿魏酸、香豆酸、咖啡酸、芥子酸和绿原酸,主要存在于谷物籽粒的皮层中,谷物的抗氧化活性以及富含谷物麸皮的膳食对人体健康的益处主要归功于它们的存在,这点已被广泛认同[2]。许多研究表明,酚酸抗氧化剂在很多抗氧化分析体系中具有中和自由基的能力[3]。阿魏酰低聚糖(FOs)不仅含有阿魏酰基,而且还含有亲水性的糖体部分,使其具有水溶性和热稳定性。到目前为止,有关麦麸不溶性膳食纤维中的水溶性FOs的抗氧化活性研究较少。本文通过分析FOs对Fe2+的螯合作用,对·OH、过氧化氢和DPPH·的清除作用,以及对H2O2诱导小鼠红细胞氧化性溶血的抑制作用等,对FOs的抗氧化能力进行了综合评价。
1 材料与方法
1.1 材料与仪器
耐温α-淀粉酶、水解蛋白酶和精制糖化酶 诺维信中国总部;B.subtilis木聚糖酶 武汉新华杨生物有限公司;麸皮 订购,粉碎后,过0.5mm筛备用;SD大鼠 体重200~230g,江苏省原子医学研究所;维生素C、丁基化羟基甲苯(BHT)、甘露醇、硫代巴比妥酸(TBA)、三氯乙酸(TCA) 中国医药集团上海化学试剂公司;1,1-二苯代-2-苦基酰基 Sigma公司;其它化学试剂 均为分析纯。
HITACHI 650-60荧光分光光度计 日本日立公司。
1.2 实验方法
1.2.1 FOs制备方法 参见文献[4]。
1.2.2 FOs对Fe2+的螯合作用 以EDTA作为参考物质[5],具体方法为:将 0.25m L 1.0mmol/L FeSO4溶液与等体积不同浓度(0~5.0mg/m L)的测试样品溶液混合,分别在混合物中加入0.5m L Tris-HCl缓冲液(pH7.4)、0.5m L 1.0mg/m L 2,2'-联吡啶溶液(联吡啶溶解在0.2mol/L HCl中)、0.4m L 100.0mg/m L盐酸羟胺和2.5m L乙醇,终体积定容到5m L,摇匀,在室温下反应10m in,在522nm下测定混合物的吸收度。
1.2.3 FOs对 H2O2的清除作用 用0.1mmol/L,pH7.4的磷酸缓冲液在20℃下制备2.0mmol/L H2O2溶液,取3.4m L不同浓度(0~0.6mg/m L)的样品液(样品溶解在0.1mmol/L,pH7.4磷酸缓冲液中)与600μL H2O2溶液混合,反应10m in,在230nm下测定混合物中H2O2的浓度。以磷酸缓冲液作空白,维生素 C 作为参考物质[6]。
1.2.4 FOs对·OH的清除作用 将500μL不同浓度的样品(0~1.4mg/m L)与100μL 2.8mmol/L脱氧核糖、200μL 100mol/L FeCl3(与 104mol/L EDTA 预混合液,v/v为 1∶1)、100μL 1.0mmol/L 过氧化氢和100μL 100mol/L维生素C混合,在37℃温孵60m in,加入1m L 5g/L TBA溶液(溶解在100g/L三氯乙酸中),混匀后,在沸水浴中加热15min,然后迅速用冰浴冷却,终止反应,反应液离心5m in(12000r/min),在532nm处测定上清液的吸光度,以磷酸缓冲液作空白,以甘露醇作为参考物质[7]。
1.2.5 FOs对DPPH·的清除作用 以BHT作为参考物质,具体方法为:将0.2m L不同浓度(0~10.0mg/mL)的样品溶液与0.8m L Tris-HCl缓冲液(100mmol/L,pH7.4)和1.0m L 0.5mmol/L DPPH甲醇溶液混合,摇匀后,室温避光反应30m in,在517nm下测定混合物的吸光度[8]。
1.2.6 FOs对H2O2诱导小鼠红细胞溶血的抑制作用
大鼠用20%乌拉坦麻醉,眼眶取血,肝素抗凝,4℃3000 r/m in离心10m in去除血浆,红细胞用 pH7.4 PBS洗涤3次,制成1%的红细胞悬液[9]。取红细胞悬液1m L,加入不同浓度的 FOs(0~6.0mg/m L),加H2O2(终浓度100mmol/L)混匀,37℃水浴1h,用生理盐水稀释5倍,1000 r/m in离心10m in,取上清液于415nm比色测定,以不加FOs管为100%溶血,计算溶血度及抑制率,正常组为空白组不经任何处理。

2 结果与讨论
2.1 FOs对Fe2+的螯合作用去质子酚酸化合物的苯氧基具有很高的电荷密度,能够结合一些带电的过渡金属离子,所以富含酚酸化合物的植物提取物能够螯合和稳定某些过渡金属离子,螯合金属离子的能力是抗氧化剂的重要性质之一。2,2'-联吡啶能够定量地与Fe2+形成红色螯合物,在有其它螯合剂存在的情况下,这个红色螯合物的形成将会被破坏,颜色也随之减退。因此,可以通过测定颜色的减少量来评价一些共存螯合剂的螯合作用。本实验中,FOs干扰Fe2+与2,2'-联吡啶形成红色螯合物,结果如图1所示。可见,FOs能够比
2,2'-联吡啶抢先捕获Fe2+,而显示出对Fe2+的螯合作用。FOs对Fe2+的螯合作用呈剂量效应关系,随
FOs浓度增加,其对Fe2+的螯合作用增强,当FOs浓度达到4.0mg/m L时,接近平衡,此时对Fe2+的螯合能力可以达到同浓度EDTA的67.4%。
2.2 FOs对H2 O2的清除作用
过氧化氢(H2O2)属于活性氧系列,它可由超氧歧化酶(SOD)歧化超氧阴离子(·)而来,而其中又以吞噬细胞的吞噬过程及线粒体的电子传递链为产生H2O2的主要途径。由于H2O2不具有未成对电子,因此不属于自由基,是氧被还原成水的过程中最稳定的中间物质,虽然H2O2不会立刻与生物分子作用,但其对生物体的伤害却比其他种类自由基要大,因为H2O2通常可氧化一些酶必需基团上的巯基而导致酶失活;过氧化氢还可以快速跨过红细胞膜,一旦进入细胞内,可能与胞内的Fe2+和Cu2+进行反应,对生物体造成更严重的氧化伤害[9]。
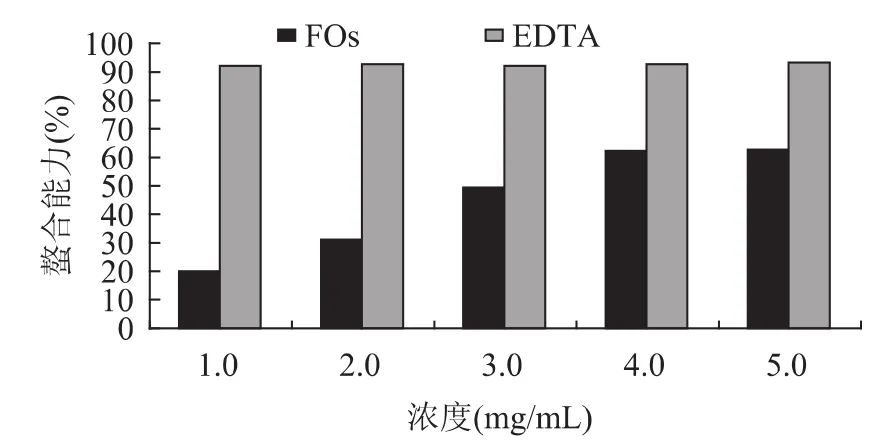
图1 不同浓度FOs和DETA对Fe2+的螯合作用
图2给出了FOs对H2O2的清除能力,表明二者之间存在浓度依赖关系,当FOs浓度达到0.5mg/m L,对H2O2的清除作用可以达到同浓度维生素C的80%。由于FOs上的阿魏酰基是一个良好的电子供体,它们可能加速H2O2转变成水,而显示出对H2O2明显的清除作用。
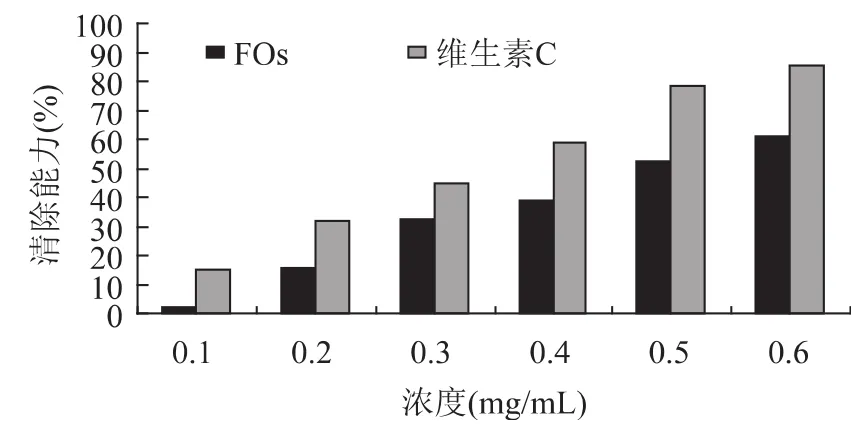
图2 FOs和维生素C对H2 O2的清除能力
2.3 FOs对·OH的清除作用
羟基自由基(·OH)是氧自由基的一种。在所有的自由基中,羟基自由基的毒性最大,对人体的危害最重,它极易与生物体分子反应,不但通过脂质过氧化反应直接损害细胞膜,而且可以使许多人体重要的酶活性降低或消失。更重要的是羟自由基能够直接损伤细胞的核酸、蛋白质、脂质等生物大分子,影响细胞的功能,最终导致细胞死亡。
采用Fe3+、维生素C和H2O2混合物在EDTA存在的条件下,反应产生·OH后[7],抗氧化剂将在一定程度上与脱氧核糖竞争和·OH的反应,从而降低脱氧核糖的降解速率。而·OH进攻脱氧化核糖所降解的产物进一步生成MDA,后者再与硫代巴比妥酸(TBA)结合生成红色的发色团,抗氧化剂清除能力越大,被降解的脱氧核糖越少,溶液的颜色也就越浅。由此也可以说明,抗氧化剂抑制脱氧核糖降解的相对程度反映了对羟基自由基的清除能力或对Fe2+的螯合能力。结果如图3所示。
在EDTA存在的情况下,甘露醇是一种羟基自由基的特异性清除剂[10],抑制脱氧核糖降解具有剂量效应关系,其EC50值为1.03mg/m L。与甘露醇相比,FOs对羟基自由基具有更明显的清除作用,其清除率与FOs存在剂量效应关系,即随着FOs浓度的增加,对·OH的清除作用增强,其EC50值为0.46mg/m L。FOs的EC50值只有甘露醇EC50值的44.7%。上述结果表明,FOs对Fe2+的螯合作用可能牵涉到对脱氧核糖降解的抑制,也说明了FOs能够保护食品、保健品等中的糖类物质免受·OH诱导的氧化损害。FOs明显的羟基自由基清除能力使得它将有可能成为一种极具潜力的天然抗氧化剂。
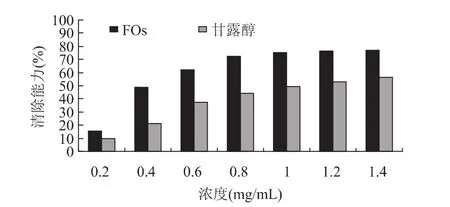
图3 FOs和甘露醇清除·OH的能力
2.4 FOs对DPPH·的清除作用
相对稳定的有机自由基DPPH·已被广泛用于测定单个化合物和植物提取物的抗氧化活性。植物化学物质通常对以氮为中心的自由基DPPH·具有很强的清除作用[11]。
FOs和BHT清除DPPH·的能力如图4所示。从图4中可以看出,FOs对DPPH·具有强烈的清除作用。当FOs的浓度在0~1.0mg/m L时,清除能力随浓度上升而增加明显;浓度高于1.0mg/m L时,清除能力趋缓,在80%左右。FOs的EC50值(0.52mg/m L)比BHT的 EC50值(0.09mg/m L)大。尽管 FOs清除DPPH·的能力低于BHT,但FOs浓度为10.0mg/m L时,其清除能力达到84.5%,可与合成抗氧化剂BHT相媲美。
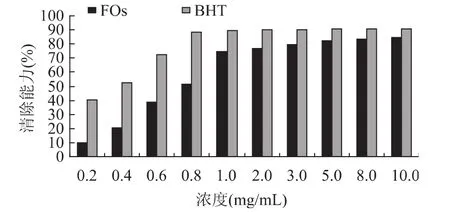
图4 FOs和BHT清除DPPH·的能力
酚酸抗氧化剂(ArOH)可以通过两种不同的机制与自由基DPPH·(X·)进行反应,一是自由基直接从酚酸上抽取氢原子;二是酚酸或酚氧阴离子(ArO·)将电子转移给自由基DPPH·,通常在极性溶剂里,抽氢反应是主要的[12]。阿魏酰低聚糖在0~1.0mg/m L浓度范围内,清除自由基DPPH·具有剂量效应关系,这可能要归功于FOs中阿魏酰基的酚羟基,其上的氢原子很容易被自由基DPPH·抽取。
2.5 FOs对H2 O2诱导小鼠红细胞溶血的抑制作用
红细胞具有典型的生物细胞膜结构,被广泛地应用于膜脂质过氧化研究。生物体内红细胞处于充足的氧环境中,含有启动和催化脂质过氧化反应的金属络合物血红蛋白,且膜上富含多价不饱和脂肪酸,这些特点均使得红细胞对氧化损伤极为敏感。因而考察抗氧化剂对红细胞结构和功能的影响被公认为是研究细胞氧化损伤的重要方法之一。H2O2可对红细胞产生氧化损伤作用,主要表现为细胞膜出现脂质过氧化、膜蛋白交联、血红蛋白氧化及细胞内还原型谷胱甘肽(GSH)浓度降低等。在氧化损伤严重的情况下,细胞骨架和细胞膜的破坏可引起细胞的死亡和破裂[13]。
从表1可以看出,加入H2O2可使红细胞膜氧化损伤,胞内容物外流,溶血量显著高于正常组。而加入不同浓度FOs后,均可抑制溶血现象发生,溶血抑制率随着FOs浓度的增加而增加,当浓度为6.0mg/m L时,对H2O2诱导红细胞的溶血抑制率接近于0.1mg/m L的VC。
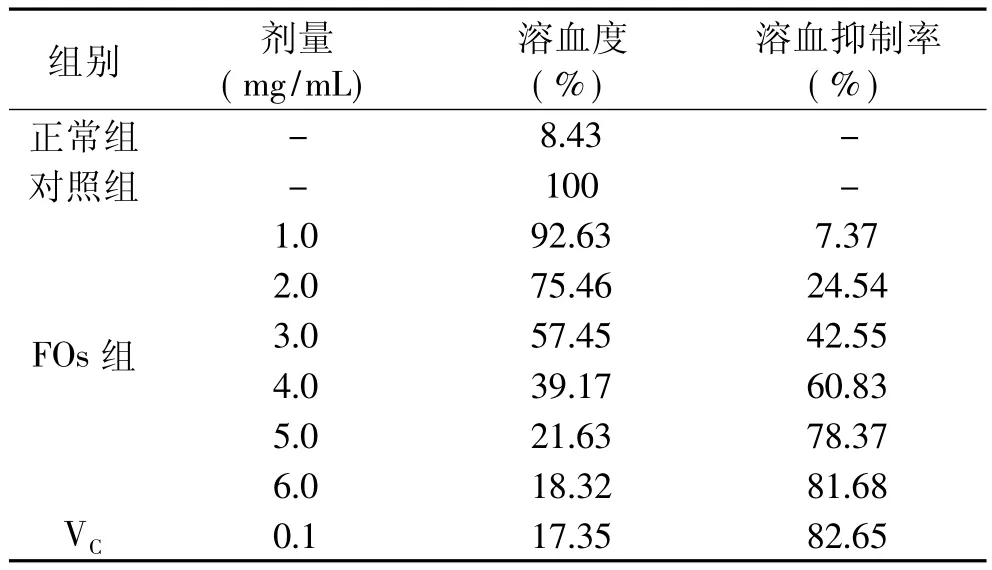
表1 FOs对H2 O2诱导红细胞溶血的影响
3 结论
FOs具有良好的体外抗氧化效果。当FOs浓度为4.0mg/m L时,其对Fe2+的螯合能力达到同浓度EDTA的67.4%;浓度为0.5mg/m L时,对 H2O2的清除作用达到同浓度维生素C的80%;FOs的EC50值只有甘露醇EC50值的44.7%;FOs浓度为10.0mg/m L时,其对DPPH·的清除能力达到84.5%,可与合成抗氧化剂BHT相媲美;浓度为6.0mg/m L时,对H2O2诱导红细胞的溶血抑制率接近于0.1mg/m L的VC。
[1]Baublis AJ,Lu C,Clydesdale FM,et al.Potential of wheat based breakfast cereals as a source of dietary antioxidants[J].J Am Coll Nutr,2000,19:308S-311S.
[2]Yu LL,Perret J,Harris M,et al.Antioxidant properties of bran extracts from“Akron”wheat growth at different locations[J].JAgri Food Chem,2003,51:1566-1570.
[3]Aruoma OI.Methodological considerations for characterizing potential antioxidant actions of bioactive components in plant foods[J].Mutat Res,2003,523-524:9-20.
[4]姚惠源,胡敏,袁小平,等.酶法制备阿魏酰低聚糖的研究[J].食品与机械,2008,24(4):3-7.
[5]Yamaguchi F,Toshiaki Ariga,Yoshihiro Yoshimura,et al.Antioxidative and anti-glycation activity of garcinol from Garcinia indica fruit rind[J].JAgric Food Chem,2000,48:180-185.
[6]Ruch KJ,Cheng SJ,Klauning JE.Prevention of cytotoxicity and inhibition of intercellular communication by antioxidant catechin isolated from Chinese green tea[J].Carcinogensis,1989,10:1003-1008.
[7]Halliwell B,Gutteridge JMC,Aruoma OI.The deoxyribose method:A simple Test-Tube assay for determination of rate constants for reactions of hydroxyl radicals[J].Anal Chem,1987,165:215-219.
[8]Brand-Williams W,Cuvelier ME,Berset C.Use of a free radical method to evaluate antioxidant activity[J].Lebensm-Wiss Technol,1995,28:25-30.
[9]王辉,刘刚,杨柳,等.莲心碱的体外抗氧化作用[J].中国中药杂志,2005,30(14):1132-1135.
[10]吴碧华,杨得本,龙存国,等.甘草总黄酮的体外抗氧化作用[J].中国临床康复,2004(8):8262-8263.
[11]Depkevicius A,van Beek TA,Lelyveld GP,et al.Isolation and structural elucidation of radical scavengers from Thymus vulgaris leaves[J].J Nat Prod,2002,65:892-896.
[12]Foti MC,Daquino C,Geraci C.Electron-transfer reaction of cinnamic acids and their methyl esters with the DPPH·radical in alcoholic solution[J].JOrg Chem,2004,69:2309-2314.
[13]Ferreira IC,Baptista P,Vilas-Boas M.Free-radical scavenging capacity and reducing power of wild ediblemushrooms from northeast Portugal:Individual cap and stipe activity [J].Food Chem,2007,100(4):1511-1516.
Study on antioxidative activity of feruloyl oligosaccharides
QIXi-guang,ZHANG Hui*,WANG Li,GUO Xiao-na,QIAN Hai-feng
(State Key Laboratory of Food Science and Technology&School of Food Science and Technology,Jiangnan University,Wuxi214122,China)
Antioxidative activity of feruloyl olig osaccharides(FOs)was investigated.The results showed that FOs had excellent antioxidative activity and revealed dose-effect relationship.It could chelate Fe2+to some extent.Its scavenging activity for hydrogen peroxide was slightly inferior to VC,but was better than mannitol for·OH.Its scavenging capability for DPPH·was similar to that for BHT.The effect on red blood cell hemolysis induced by H2O2could be markedly inhibited by FOs.
feruloyl;olig osaccharides;antioxidation;free radical
TS201.1
A
1002-0306(2011)08-0071-04
2010-07-19 *通讯联系人
齐希光(1968-),男,在职硕士,研究方向:食品功能因子。
国家863项目(2006AA10Z333);国家十一五科技支撑计划项目(2006BAD27B06)。
