乳香提取物对HL-60细胞株VEGF分泌及其Flt-1受体表达的影响
2011-10-07齐振华李乐赛符晓华彭小宁于才红
张 勇 ,齐振华 ,李乐赛 ,符晓华 ,彭小宁,张 娜 ,于才红
(1.中南大学湘雅医院,湖南 长沙 410008;2.湖南师范大学医学院,湖南 长沙 410013;3.中南大学湘雅三医院,湖南 长沙 410013)
乳香作为橄榄科植物卡氏乳香树脂,中药乳香能活血行气、通经止痛、消肿生肌。主治心腹疼痛、风湿痹痛、经闭痛经、跌打淤痛、痈疽肿毒等。乳香作为一种应用广泛的植物药,在我国和印度都有广泛的应用[1]。20世纪中后期,自Tschirch和Halbey等第一次从Boswellic carterii乳香中分离到α和β乳香酸的混合物以来,国内外学者便开始了乳香酸类化合物的抗肿瘤活性研究[2-3]。本实验拟探讨乳香提取物对急性早幼粒性白血病HL-60细胞增殖的作用及分泌蛋白的影响。
1 材料和方法
1.1 材料
人早幼粒细胞白血病细胞株HL-60细胞为本室保存。RPMI 1640培养基为Gibco公司产品,小牛血清为Hyclone公司产品。RT-PCR试剂盒均购自华美生物工程公司,引物序列由上海生工生物技术公司合成纯化。兔抗人VEGF、Flt-1多克隆抗体购自美国Santa cruz公司。乳香提取物为中南大学湘雅医院药剂科制备。
1.2 细胞培养
将HL-60细胞悬浮培养于含10%胎牛血清的RPMI 1640 培养液中,于 37℃、5%CO2、饱和湿度的培养箱中培养。2~3 d传代一次。取对数生长期的细胞,细胞悬液终浓度调整为(4~6)×106/mL,分别以不同浓度药物作用不同时间,以不加药物的培养细胞为空白对照,并设溶剂对照(培养基)。收集各时相细胞5×106个,离心弃去上清,加入1 mL Trizol(Gibco公司产品)试剂悬浮细胞,移入1.5 mL EP管中,-40℃保存,待抽提总RNA。
1.3 MTT试验检测乳香提取物对白血病细胞体外增殖的影响
HL-60细胞以5×104/mL浓度接种在96孔培养板中,每孔 200 μL。 于 37℃,5%CO2、饱和湿度条件下常规培养过夜。每组设3个复孔,胎牛血清浓度2%,加入不同浓度乳香提取物,浓度梯度分别为2.5 mg/L、5 mg/L、10 mg/L、15.0 mg/L。 分别于 24、48、72 h 加入20 μL MTT 溶液(5 mg/mL),继续培养 4 h,终止培养。弃去上清后加入150 μL二甲亚砜,37℃避光摇动10 min使结晶物充分溶解,酶标仪570 nm处测各孔OD值,同时设调零孔(培养液,MTT,DMSO),对照孔(不加乳香提取物,细胞,培养液,MTT,DMSO)。细胞增殖率按(处理组D570/空白组D570)×100%公式计算。 根据OD值计算乳香提取物作用HL-60细胞的抑制率(CI,%)=(OD对照-OD实验)/(OD对照)×100%。
1.4 RT-PCR法检测HL-60细胞VEGF mRNA及受体Flt-1 mRNA的表达
1.4.1 细胞总RNA提取
取对数生长期细胞,细胞密度为5×106/瓶,设置对照组及实验组。根据MTT实验的结果,对照组不加乳香提取物,实验组选取乳香提取物的浓度分别为2.5 mg/L、5 mg/L、10 mg/L、15.0 mg/L 作用 48 h 后检测对VEGF-mRNA表达的影响,各组均重复3瓶。用Trizol提取细胞总RNA,加适量的DEPC水溶解。用1.5%琼脂糖电泳鉴定RNA的纯度并观察其降解情况,并用DNA/RNA紫外分光光度仪测定其含量。
1.4.2 逆转录反应
按M-MLV逆转录酶说明书[4]进行。取2 μg RNA溶于 11 μL DEPC 水中,加入 oligo(dT)181μL,70℃反应5 min后置冰中冷却,再加入5×RT Buffer 5 μL,10 mmol/L dNTPs 1.5 μL,RNasin 0.5 μL,M-MLV 逆转录酶 1 μL,DEPC 水补足 25 μL 体积,37℃反应 60 min,cDNA 置-20℃备用。
1.4.3 PCR
引物设计参考文献[4],VEGF引物序列上游为5'-TCG GGC CTC CGA AAC CAT GA-3',下游为5'-CCT GGT GAG AGA TCT GGT TC-3'。 VEGF引物可用来扩增所有的VEGF包括516 bp,588 bp,648 bp,720 bp大小的同型体。β-actin引物序列:上游引物:5'-CGC TGC GCT GGT CGT CGA CA-3',下游引物:5'-GTC ACG CAC GAT TTC CCG CT-3';扩增产物619 bp。引物由上海生工生物工程公司合成、纯化。VEGF的 PCR 体系 25 μL包括 10×Mg-Free Buffer 2.5 μL, 2 mmol/L 4×dNTP 2.5 μL,25 mmol/L MgCl22.5 μL, 10 pmmol/L 引物各 1.5 μL,Taq 酶 1.5 U,cDNA 2 μL。 置 PCR扩增仪 (GeneAmp PCR System 9700,Applied Biosystems)上扩增。VEGF的PCR条件为95℃预变性5 min,然后变性、退火、延伸分别为94℃ 1 min,60℃ 2 min,72℃ 3 min, 循环 35 次后,72℃延伸10 min。实验中分别设立空白对照(不加模板cDNA)及各样本的β-actin对照。半定量RT-PCR扩增产物的定量分析:取5 μL扩增产物以含0.5 mg/L溴化已锭(EB)的2%琼脂糖凝胶电泳,凝胶成像分析仪分析图像,读取各条产物带的光密度值,VEGF-mRNA表达相对值=VEGF光密度值/β-actin光密度值。
1.5 Western Blot检测乳香提取物对细胞VEGF及Flt-1蛋白表达
取对数生长期的细胞,细胞密度为5×106/瓶,分组同RT-PCR,各组均重复3瓶。常规收集细胞,离心后用IP裂解液提取蛋白。将提取的蛋白进行电泳、转膜、免疫反应、化学发光反应、显影和定影,最后将胶片进行扫描,用凝胶图像处理系统分析目的蛋白的分子量和净光密度值。
1.6 统计学分析
用SPSS13.0统计学软件进行数据处理。两组间差别显著性检验进行方差分析、t检验分析及Pearson相关分析,以P<0.05为差异有统计学意义。
2 结果
2.1 乳香提取物对HL-60细胞增殖的影响
乳香提取物在一定范围内能抑制HL-60细胞增殖,抑制率见图1。随着乳香提取物浓度的增加及作用时间的延长,对HL-60细胞抑制作用明显增强,表现为其抑制率逐渐增高,而以15.0 mg/L组作用48 h抑制率最高。不同浓度组作用48 h后对HL-60细胞抑制率各组比较差异具有统计学意义(P<0.05)。
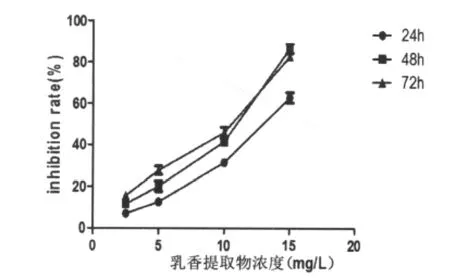
图1 不同浓度乳香提取物对HL-60细胞作用不同时间抑制率的比较
2.2 乳香提取物处理HL-60细胞前后VEGF-mRNA的表达
对HL-60细胞提取纯化的RNA用紫外分光光度仪检测,结果A260和A280的比值均在1.9~2.1范围,证明无蛋白质污染。半定量RT-PCR结果,如图2。乳香提取物15.0 mg/L组作用48 h对HL-60细胞VEGF-mRNA表达抑制显著,处理前后测得VEGF-mRNA相对值统计学分析均有差异(P<0.05)。
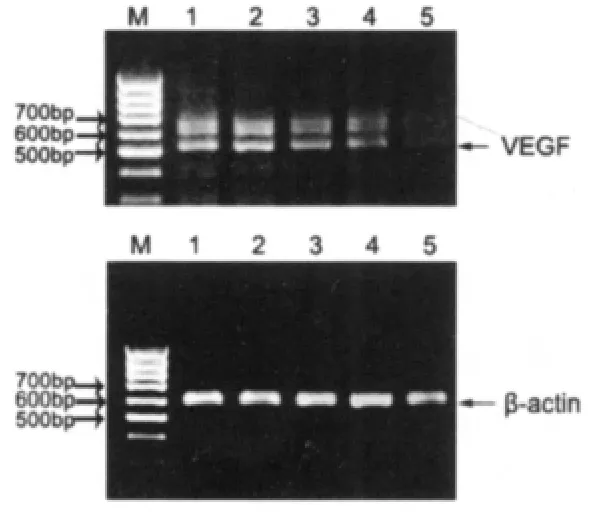
图2 RT-PCR分析VEGF-mRNA表达结果
2.3 乳香提取物处理HL-60细胞前后VEGF、flt-1蛋白的表达
Western Blot结果见表1,显示乳香提取物15.0 mg/L浓度组能抑制HL-60细胞VEGF及Flt-1蛋白表达,与处理前VEGF及受体FLT-1蛋白光密度值比较差异具有统计学意义(P<0.05)。HL-60细胞VEGF与Flt-1蛋白表达具有相关性(r=0.895,P=0.021)。
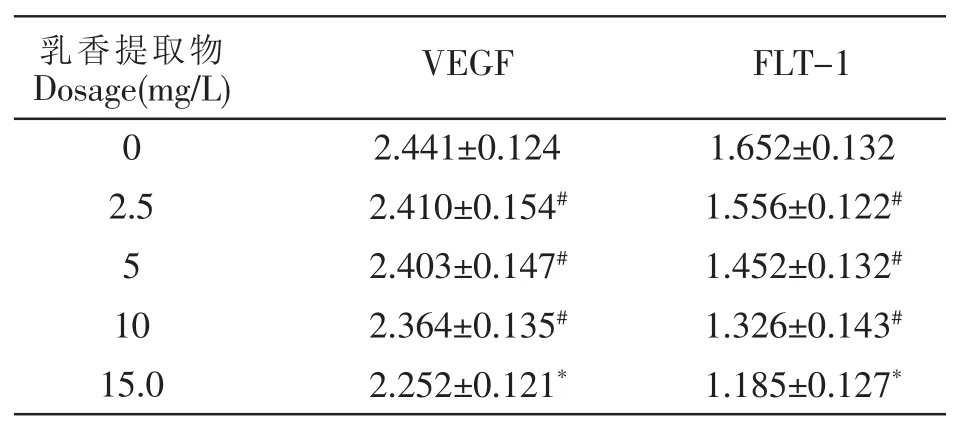
表1 乳香提取物对急性白血病细胞株HL-60细胞VEGF及FLt-1表达的影响(光密度值)
3 讨论
乳香作为一种传统中药,一直以来用于治疗关节疼痛等病症。近年来乳香抗肿瘤作用引起了较为广泛的关注,其作用已经在前列腺肿瘤、膀胱癌[5]等研究中得到证实。乳香提取物是一组天然化合物的混合物,其成分较为复杂,主要成分为α乳香酸和β乳香酸。在对乳香提取物抗白血病作用的研究中,我们的前期研究也证实了乳香具有诱导急性髓细胞性白血病细胞凋亡、抑制白血病细胞增殖的作用[6]。我们还发现低浓度的乳香提取物即可诱导急性髓系白血病HL-60细胞、NB4细胞和急性髓细胞性白血病原代细胞凋亡,其凋亡率远远高于同等干预条件下急性淋巴细胞白血病细胞(ALL),提示乳香抗白血病作用的特异性,其分子机制有待于进一步探讨研究[7]。
血管新生(angiogenesis)是指在已经存在的血管的基础上以出芽方式形成新的微血管的过程,可见于胚胎发育期及出生后,是胚胎发育和伤口愈合等生理过程中的一个基本因素,但在恶性转化过程中新生血管调控紊乱导致肿瘤相关毛细血管网的形成,进而刺激肿瘤细胞的存活和增殖。1971年Folkman[8]报导肿瘤在2 mm3大小时,为进一步生长启动新血管生成,因此抑制血管新生可以阻断肿瘤进展[9]。血管新生在实体瘤的发生、进展和转移过程中起重要作用,越来越多的证据显示,白血病也是一种血管新生依赖的肿瘤[10],抗血管新生已成为白血病治疗的第二靶点。
血管内皮生长因子 (vascular endothelial growth factor,VEGF)是主要的强有力的微血管新生诱导剂,是一种典型的外分泌蛋白,选择性直接作用于血管内皮细胞膜上的受体酪氨酸激酶,激活细胞信号通路,促进多种微血管新生所需事件[11]。Aguayo[12]等分析了99例急性髓细胞白血病(AML)患者骨髓血和白血病细胞胞浆中VEGF的含量,结果患者骨髓血VEGF含量显著升高,其水平与患者胞浆VEGF水平呈现正相关。VEGF经典的受体主要是两类结构类似的受体酪氨酸激酶(RTKs)即VEGFR-1(Flt-1)和VEGFR-2(KDR)。我们前期研究已经发现急性白血病患者体内VEGF受体KDR水平较正常人显著升高[13],血管内皮生长因子受体抑制剂是一种有前途的癌症治疗药物[14]。
本研究应用不同浓度乳香提取物作用于HL-60细胞,并且在实验中设立用DMSO作用的对照组,排除了DMSO细胞毒作用的影响,保证了实验的可比性。不同浓度乳香提取物作用于HL-60细胞后,细胞生长受到抑制(P<0.05),且乳香提取物浓度增加时,细胞的抑制率也随之增加。实验中同时检测培养细胞上清中VEGF浓度的变化,结果显示HL-60细胞培养上清中VEGF浓度随着乳香提取物浓度的增加而降低,随着作用时间延长亦降低,这提示乳香提取物可以抑制HL-60细胞分泌VEGF,呈浓度时间依赖性。RT-PCR检测结果亦发现细胞内VEGF-mRNA及VEGF受体1(FLt-1)-mRNA的表达降低亦与乳香提取物成剂量时间依赖关系。Western blot检测发现乳香提取物作用后HL-60内VEGF蛋白及受体FLT-1蛋白的表达与其mRNA表达一致。因此,我们推断乳香提取物可能通过抑制HL-60细胞表达VEGF及其受体Flt-1,发挥抗血管新生成作用。
综上所述,乳香提取物能抑制HL-60细胞VEGF及其受体Flt-1的表达,其作用呈一定的剂量和时间依赖性,在急性髓细胞性白血病治疗领域具有良好临床应用前景。我们的实验进一步了解乳香抗白血病的药理作用机制,为充分开发利用中药提出了新的研究思路,亦为白血病治疗的基础研究和临床应用提供了基础。
[1]Pardhy RS,Bhattacharyya SC.Tetracyclic triterpene acids from the resin of boswellia serrata Roxb[J].Indian J Chem,1978,16B(3):174-175.
[2]Sharma ML,Khajuria A,Kaul A,et al.Effect of salai guggal ex-Boswellia serrata on cellular and humoral immune responses and leucocyte migration [J].Agents Actions,1988,24(1-2):161-164.
[3]Wildfeuer A,Neu IS,Safayhi H,et al.Effects of boswellic acids extracted from a herbal medicine on the biosynthesis of leukotrienes and the course of experimental autoimmune encephalomyelitis [J].Arzneimittelforschung,1998,48(6):668-674.
[4]Fiedler W,Graeven U,Ergün S,et al.Vascular endothelial growth factor,a possible paracrine growth factor in human acute myeloid leukemia[J].Blood,1997,89(6):1870-1875.
[5]Frank MB,Yang Q,Osban J,et al.Frankincense oil derived from Boswellia carteri induces tumor cell specific cytotoxicity[J].BMC Complement Altern Med,2009,9:6.
[6]齐振华,张国平,赵谢兰,等.乳香诱导急性早幼粒细胞白血病细胞凋亡与周期改变[J].临床血液学杂志,2000,13(3):125-127.
[7]柳昕,齐振华.乳香提取物诱导Jurkat细胞凋亡的实验研究[J].湖南医科大学学报,2000,25(3):241-244.
[8]Folkman J.Tumor angiogenesis:therapeutic implications[J].N Engl J Med,1971,285(21):1182-1186.
[9]Ma WW,Adjei AA.Novel agents on the horizon for cancer therapy[J].CA Cancer J Clin,2009,59(2):111-137.
[10]Padró T,Ruiz S,Bieker R,et al.Increased angiogenesis in the bone marrow of patients with acute myeloid leukemia[J].Blood,2000,95(8):2637-2644.
[11]Ferrara N,Kerbel RS.Angiogenesis as a therapeutic target[J].Nature,2005,438(7070):967-974.
[12]Aguayo A,Kantarjian HM,Estey EH,et al.Plasma vascular endothelial growth factor levels have prognostic significance in patients with acute myeloid leukemia but not in patients with myelodysplastic syndromes[J].Cancer,2002,95(9):1923-1930.
[13]谢建民,齐振华.急性白血病VEGF及受体KDR的表达与其侵袭关系研究 [J].中华血液学杂志,2004,25(7):435-436.
[14]Kowanetz M,Ferrara N.Vascular endothelial growth factor signaling pathways:therapeutic perspective[J].Clin Cancer Res,2006,12(17):5018-2022.
