云芝多糖对小鼠免疫性肝损伤保护作用及机制的研究
2011-08-24王云甫
钟 萍 ,王云甫 ,李 萍
(湖北医药学院 1.医疗保健中心;2.第一临床学院,湖北 十堰 442000)
云芝多糖(Coriolus versciclor polysaccharides,CVP)具有多种生物活性,可提高抗氧化酶活性、清除自由基以及对氧化应激有抑制和拮抗作用[1-2];各种原因的肝损伤与氧化应激密切相关,但CVP对免疫性肝损伤保护作用及机制的研究尚无资料报道,本文以卡介苗(BCG)和脂多糖(LPS)制备免疫性肝损伤模型[3],研究CVP抗实验性肝损伤的作用及机制,为拓展CVP的临床应用提供实验依据。
1 材料和方法
1.1 物药品及试剂
4月龄昆明种小鼠50只,雌雄性各半分笼饲养,由本院动物中心提供。丙二醛(MDA)、丙氨酸转氨酶(ALT)、天冬氨酸转氨酶(AST)、谷胱甘肽(GSH)、超氧化物歧化酶(SOD)、肿瘤坏死因子(TNF-a)一氧化氮合酶(NOS)、一氧化氮(NO)购自南京建成生物工程研究所;云芝多糖(CVP)购自神华药业有限公司;脂多糖(LPS)美国Sigma公司产品;卡介苗(BCG),上海生物制品研究所。其余为国产分析纯生化试剂。
1.2 仪器设备
ZS83-1型内切式组织匀浆机(浙西机械厂),722S型分光光度计(上海第二光学仪器厂),酶标仪(热电上海仪器公司),RA-50半自动生化分析仪(美国Technicon公司)
1.3 方法
50只小鼠随机分为5组,每组10只,分空白对照组;病理模型组;云芝多糖保护组分高、中、低3组。造模第1天,除正常对照组外,其余各组小鼠经尾静脉注射2.5 mg BCG;云芝多糖低、中、高保护组每天分别按体重(100、200和300 mg/kg)云芝多糖灌胃1次,对照组和模型组用生理盐水同样处理,第12天用云芝多糖灌胃给药2 h后,模型组和云芝多糖各保护组从尾静脉注射7.5μg/只LPS。末次给药禁食不禁水16 h后,称取小鼠体重,眼球取血分离血清,测定ALT和AST。然后处死小鼠立即取出肝脏、胸腺称重,计算肝体指数(肝重/体重)、胸腺指数(胸腺重/体重×100%);肝脏称重剪碎,用冰PBS按1∶10稀释冰浴下匀浆,4 000 r/min离心5 min,取上清液用双缩脲法测肝匀浆中蛋白质含量,用PBS稀释成4 mg/mL蛋白,按试剂盒要求检测肝匀浆中 MDA、GSH、NO和 TNF-α 的含量和 SOD、GSH-Px和NOS的活性。
1.4 数据处理
2 结果
2.1 云芝多糖对免疫性肝损伤小鼠肝体指数和胸腺指数的影响
免疫性肝损伤模型组肝体指数、胸腺指数,与空白对照组和CVP各保护组比较,肝损伤模型组各脏器指数存在明显差异,说明建立模型是成功的。CVP各保护组可降低免疫性肝损伤小鼠肝体指数和胸腺指数,与模型组比较(P<0.05)。结果见表1。
表1 云芝多糖对免疫性肝损伤肝体指数及胸腺指数的影响 (±s)
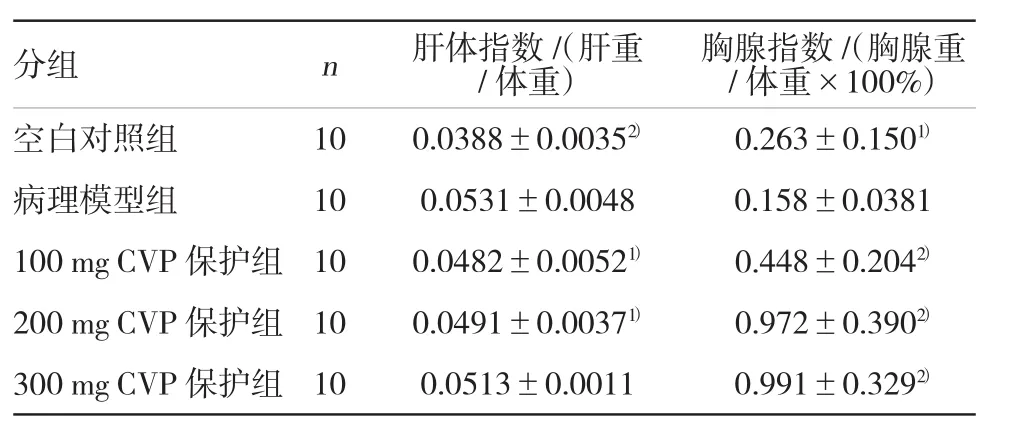
表1 云芝多糖对免疫性肝损伤肝体指数及胸腺指数的影响 (±s)
注:1)与模型组比较,P<0.05;2)与模型组比较,P<0.01
分组n肝体指数/(肝重/体重)胸腺指数/(胸腺重/体重×100%)空白对照组 10 0.0388±0.00352) 0.263±0.1501)病理模型组 10 0.0531±0.0048 0.158±0.0381 100 mg CVP保护组 10 0.0482±0.00521) 0.448±0.2042)200 mg CVP保护组 10 0.0491±0.00371) 0.972±0.3902)300 mg CVP保护组 10 0.0513±0.0011 0.991±0.3292)
2.2 云芝多糖对免疫性肝损伤小鼠血清ALT、AST活性和肝脏MDA含量的影响
免疫性肝损伤模型组小鼠血清ALT和AST活性和MDA的含量显著升高,与对照组比较(P<0.01),说明制备免疫性肝损伤模型是成功的。ALT和AST是分别反应肝细胞膜损伤和线粒体膜损伤的重要指标,CVP各保护组可降低小鼠血清中ALT和AST的活性,但保护作用与CVP浓度有关,与模型组比较(P<0.05)。CVP保护组MDA明显降低,与模型组比较(P<0.01)。结果见表2。
表2 云芝多糖对小鼠免疫性肝损伤血清ALT、AST活性和肝脏MDA含量的影响 (±s)
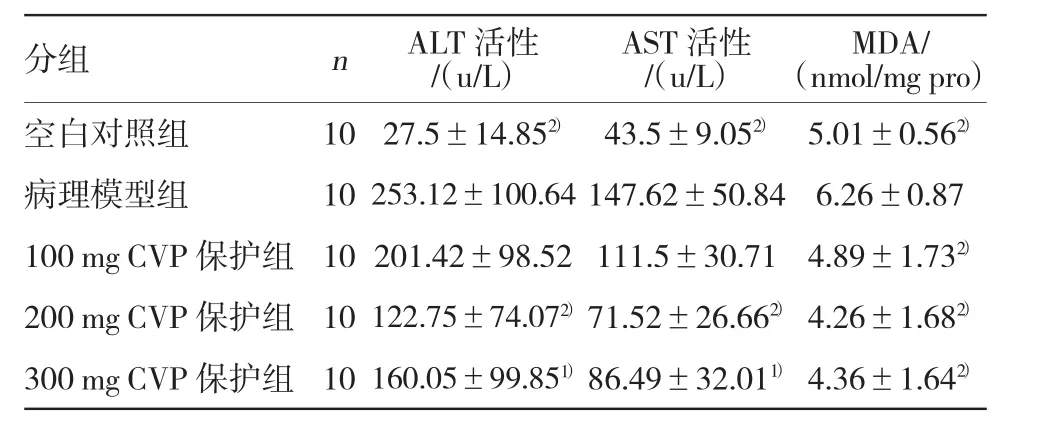
表2 云芝多糖对小鼠免疫性肝损伤血清ALT、AST活性和肝脏MDA含量的影响 (±s)
注:1)与模型组比较,P<0.05;2)与模型组比较,P<0.01
分组 n ALT活性/(u/L)AST活性/(u/L)MDA/(nmol/mg pro)空白对照组 10 27.5±14.852) 43.5±9.052) 5.01±0.562)病理模型组 10253.12±100.64147.62±50.84 6.26±0.87 100 mg CVP保护组 10 201.42±98.52 111.5±30.71 4.89±1.732)200 mg CVP 保护组 10122.75±74.072) 71.52±26.662) 4.26±1.682)300 mg CVP 保护组 10160.05±99.851) 86.49±32.011) 4.36±1.642)
2.3 云芝多糖对免疫性肝损伤小鼠SOD、GSH-Px活性及GSH含量的影响
免疫性肝损伤病理模型组SOD活性与空白对照组比较明显降低(P<0.05),与CVP各保护组比较无明显差异;CVP各保护组可提高GSH-Px活性,与病理模型组比较(P<0.01);免疫性肝损伤模型组GSH含量明显降低,不同浓度的CVP保护组可增加GSH的含量,与模型组比较有统计学意义(P<0.01),结果见表 3。
表3 云芝多糖免疫性肝损伤肝损伤SOD、GSH-Px活性及GSH含量的影响 (±s)
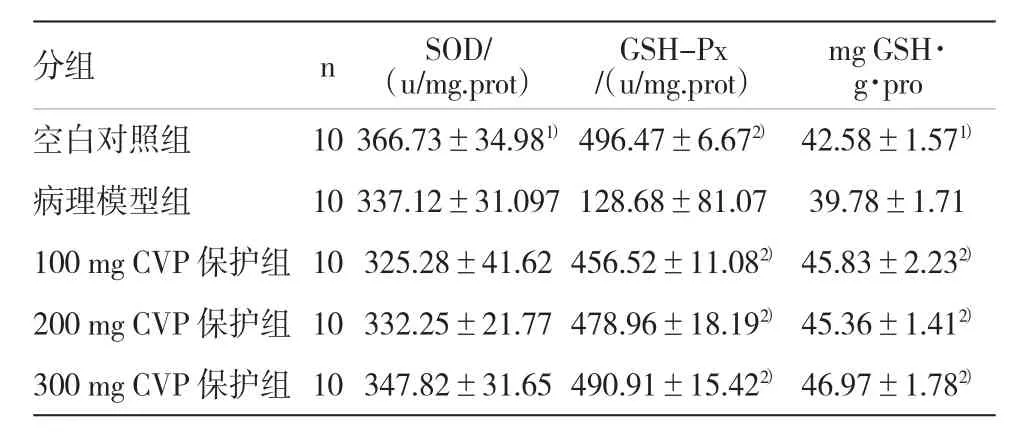
表3 云芝多糖免疫性肝损伤肝损伤SOD、GSH-Px活性及GSH含量的影响 (±s)
注:1)与模型组比较,P<0.05;2)与模型组比较,P<0.01
分组 n SOD/(u/mg.prot)mg GSH·g·pro空白对照组 10 366.73±34.981) 496.47±6.672) 42.58±1.571)病理模型组 10 337.12±31.097 128.68±81.07 39.78±1.71 100 mg CVP 保护组 10 325.28±41.62 456.52±11.082) 45.83±2.232)200 mg CVP 保护组 10 332.25±21.77 478.96±18.192) 45.36±1.412)300 mg CVP 保护组 10 347.82±31.65 490.91±15.422) 46.97±1.782)GSH-Px/(u/mg.prot)
2.4 云芝多糖对免疫性肝损伤小鼠NOS活性,NO及TNF-α含量的影响
免疫性肝损伤小鼠模型组NOS活性、NO和TNF-α含量与各组比较明显升高,对照组NOS活性与模型组比较降低,但无统计学意义,而NO及TNF-α含量明显降低与模型组比较(P<0.05)。CVP各保护组可降低NOS活性及NO和TNF-α含量,与模型组比较有统计学意义(P<0.05),结果见表4。
表4 云芝多糖对免疫性肝损伤小鼠NOS活性,NO及TNF-α含量的影响 (±s)
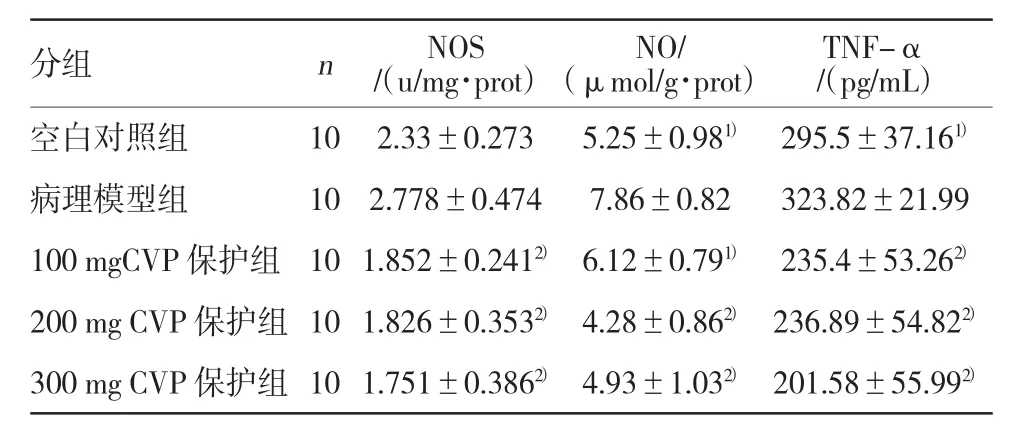
表4 云芝多糖对免疫性肝损伤小鼠NOS活性,NO及TNF-α含量的影响 (±s)
注:1)与模型组比较,P<0.05;2)与模型组比较,P<0.01
分组 n NOS/(u/mg·prot)TNF-α/(pg/mL)空白对照组 10 2.33±0.273 5.25±0.981) 295.5±37.161)病理模型组 10 2.778±0.474 7.86±0.82 323.82±21.99 100 mgCVP 保护组 10 1.852±0.2412) 6.12±0.791) 235.4±53.262)200 mg CVP 保护组 10 1.826±0.3532) 4.28±0.862) 236.89±54.822)300 mg CVP 保护组 10 1.751±0.3862) 4.93±1.032) 201.58±55.992)NO/(μmol/g·prot)
3 讨论
BCG与LPS被广泛应用于免疫性肝损伤的实验研究模型,BCG首先激活致敏T淋巴细胞,尤其是致敏肝内Kupffer细胞和巨噬细胞大量聚集于肝脏,当注射LPS攻击,使致敏状态的细胞释放大量炎性介质,如TNF-α、白细胞介素、NO和自由基等[4-5],其损伤机制类似于临床病毒性肝炎的病理生理过程,是筛选保肝药物的理想模型之一。本研究病理模型组肝体指数增大、胸腺指数变小,血清ALT、AST活性升高,肝脏MDA、NO、TNF-α含量和NOS活性增加;GSH含量及GSH-Px活性降低,证明BCG与LPS致小鼠免疫性肝损伤模型是成功的。其机制是BCG和LPS所致免疫性肝损伤分泌炎性因子使肝细胞出现炎性浸润,导致肝细胞肿胀引起肝体指数增大,胸腺指数变小,不同浓度的云芝多糖保护组能降低小鼠肝体指数、增加胸腺指数;与模型组比较(P<0.05),说明多糖云芝能抑制炎性介质的分泌。
免疫性肝损伤产生的自由基攻击膜磷脂中的不饱和脂肪酸而损伤肝细胞膜和线粒体膜,导致膜通透性增加致使ALT、AST逸出,引起血清ALT、AST升高;不同浓度的云芝多糖保护组能降低小鼠血清ALT、AST活性与模型组比较(P<0.05),但降低 ALT和AST活性与多糖浓度存在量效关系[6]。MDA是自由基代谢的终产物其含量可反映肝细胞损伤程度,不同浓度的云芝山药多糖保护组能降低小鼠肝脏MDA的含量,与模型组比较(P<0.01)。表明云芝多糖对小鼠免疫性肝损伤具有对抗和清除自由基作用。
GSH是生物体内重要的还原物质,可作为GSH-Px等的辅酶参与清除自由基,同时GSH也具有直接清自由基的作用[7]。免疫性肝损伤时加速模型组GSH的消耗,导致GSH明显降低,不同浓度的云芝多糖保护组能升高GSH的含量,与模型组比较(P<0.01),说明云芝多糖能直接清除自由基,或者是通过促进谷胱甘肽合成酶的合成,增加GSH的含量。SOD和GSH-Px是重要的抗氧化酶,其作用机制是SOD催化2分子氧自基生成O2和H2O2;GSH-Px的作用是由GSH提供原当量催化H2O2或过氧化物(ROOH)生成水,从而清除自由基。本研究病理模型组与云芝多糖保护组SOD活性无明显差异,与对照组比较明显降低(P<0.05),说明BCG+LPS所致免疫性肝损伤可加速SOD的消耗。但多糖云芝保护组能提高GSH-Px活性,与模型组比较(P<0.01),说明免疫性肝损伤可加速GSH-Px的消耗,云芝多糖可通过提高GSH-Px活性清除自由基。
而肝内一氧化氮合酶主要为内皮型(eNOS)和诱导型(iNOS),iNOS主要分布在肝Kupffer细胞及肝内皮细胞,正常情况下不表达,在内毒素和炎性因子刺激下iNOS可催化L-精氨酸生成NO。NO和TNF-α在免疫性肝损伤中起到重要作用;NO对肝细胞具有双重作用,既有保护功能又有杀伤毒性与促进炎症的双重作用,生理浓度的NO对肝脏有保护作用;高浓度的NO可抑制肝细胞蛋白质的合成和损伤DNA结构;直接抑制线粒体呼吸,使肝细胞内能量代谢障碍而引起肝细胞凋亡和坏死[8],TNF-α是引起急慢性肝损伤的重因素之一,TNF-α本身具有细胞毒性作用,能激活T、B淋巴细胞,增加自然杀伤细胞的杀伤能力,直接或间接引起肝细胞的免疫性肝损伤。还可诱导TNF-α本身、L-1和L-6等细胞因子的分泌,介导肝细胞功能受损而加重肝损伤[8-9]。免疫性肝损伤模型组NOS活性及NO和TNF-α的含量明显升高,不同浓度的云芝多糖保护组能降低NOS活性及NO、TNF-α的含量,与模型组比较P<0.01。实验表明,CVP可通过抑制免疫性肝损伤的炎性浸润,降低肝体指数及血清中ALT和AST的活性;提高GSH-Px活性和GSH的含量,降低NOS活性,降低MDA、NO和TNF-α的含量,对免疫性肝损伤有较强的保护作用。
[1]徐增莱,汪 琼,赵 猛,等.淮山药多糖的免疫调节作用研究[J].时珍国医国药,2007,18(5):1040-1041.
[1]XU ZL,WANG Q,ZHAO M,et al.Test on the Immunity-moderating Function of Dioscorea oppostita Thunb.Polysaccharide[J].Lishizhen Medicine and Materia Medica Research,2007,18(5):1040-1041.Chinese
[2]ZHAO GH,WANG Y,LI ZX,et al.The regulation of immunefunction by polysaccharide from Chinese yam[J].Acta Nutr Sin,2002,24(2):187-188.
[3]宋雨鸿,刘强,陈育尧,等.红背叶根对小鼠免疫性肝损伤的保护作用[J].南方医科大学学报,2008,28(3):494-496.
[3]SONG YH,LIU Q,CHEN YY,et al.Protective effects of Hongbeiyegen against immunological liver injury in mice[J].Journal of Southern Medical University,2008,28(3):494-496.Chinese
[4]吴春明,曹家麟,朱小区,等.二草清肝汤治疗免疫性肝损伤大鼠的作用机制[J].山东医药,2008,48(27):38-40.
[4]WU CM,CAO JL,ZHU XQ,et al.Effects of Ercao Qinggan Soup against immunological liver injury in rats[J].Shandong Medical Journal,2008,48(27):38-40.Chinese
[5]毕明刚,周 娟,许 扬,等.岩黄连总碱提取物对小鼠免疫性肝损伤的改善作用[J].中国药理学与毒理学杂志,2009,23(1):39-44.
[5]BI MG,ZHOU J,XU Y,et al.Improving effect of total alkaloids extract from Corydalis thalictrifolia Franch.on immune hepatic injury in mice[J].Chinese Journal of Pharmacology and Toxicology,2009,23(1):39-44.Chinese
[6]孙设宗,唐 微,张红梅,等.山药多糖对小鼠CCL4肝损伤保护作用[J].郧阳医学院学报,2008,27(6):502-504.
[6]SUN SZ,TANG W,ZHANG HM,et al.Protective Effect of Yam Polysaccharide on CCL-4 induced Liver Injury in Mice[J].Journal of Yunyang Medical College,2008,27(6):502-504.Chinese
[7]舒 红.还原型谷胱甘肽的临床应用[J].黑龙江医学,2007,31(11):840-841.
[7]SU H.Clinical applications of reduced glutathione[J].Heilongjiang Medical Journal,2007,31(11):840-841.Chinese
[8]胡成穆,姜 辉,刘洪峰,等.金银花总黄酮对免疫性肝损伤小鼠的影响[J].安微医药,2008,12(4):295-297.
[8]HU CM,JIANG H,LIU HF,et al.Effects of LJTF on immunological liver injury in mice[J].Anhui Medical and Pharmaceutical Journal,2008,12(4):295-297.Chinese
[9]LIU DF,WEI W,SONG LH,et al.Upregulation of TNF-alpha and L-6 mRNA in mouseliverinduced by bacille Calmette-Guerin plus lipopolysaccharide[J].Acta Phatmacol Sin,2006,27(4):460-468.
