非酒精性脂肪肝与胰岛素抵抗的关系
2011-07-28李利阳
李利阳,杨 蕾
(陕西省宝鸡市第二人民医院内分泌科,陕西宝鸡721000)
随着肥胖症和代谢综合征在世界范围的流行,非酒精性脂肪肝(nonalcoholic fatty liver diseases,NAFLD)增长迅速且呈低龄化发病趋势,已成为21世纪全球重要的公共健康问题之一,亦是我国愈来愈重视的慢性肝病问题[1]。NAFLD 能较直观地反映体内脂肪沉积的各种危险因素,本文通过观察非糖尿病患者不同程度脂肪肝相关因素的分析,探讨其与胰岛素抵抗的关系。
1 对象与方法
1.1 对象 选择我院2009年9月至2011年3月门诊体检以及住院非糖尿病非酒精性脂肪肝患者238例(依照2010年非酒精性脂肪肝诊断标准[5];空腹血糖 <7.0 mmol/L,餐后 2 h 血糖<11.0 mmol/L),其中男152例,女86例。年龄36~81岁,平均(57.4±13.9)岁。体检正常者64例作为对照组,年龄性别构成无明显差异,有可比性。剔除条件:①长期大量饮酒史;②病毒性肝炎、药物性肝病、自身免疫性肝病、肝豆状核变性;③胆道梗阻全胃肠外营养、炎症性肠病、甲状腺功能减退症、恶性肿瘤;④严重感染或发热患者;⑤心力衰竭、呼吸衰竭;⑥长期服用导致脂肪肝的药物(如胺碘酮、甲氨蝶呤、糖皮质激素等)。
1.2 方法
1.2.1 测量指标 所有观察对象均测量身高、体质量,计算体质量指数(body mass index,BMI=体质量/身高2);腰围、臀围,计算腰臀比值(waist-hip ratio,WHR=腰围/臀围);禁食12 h后,次晨采静脉血,测定丙氨酸氨基转移酶(alanine aminotransferase,ALT)、C 反应蛋白(C-reactive protein,CRP)、血尿酸(uric acid,UA)、纤维蛋白原(fibrinogen,FIB)、空腹血糖(fasting blood-glucose,FBG)、空腹胰岛素(fasting insulin,FINS);留取小便行尿微量白蛋白(urine albumin trace,uAlb)、尿肌酐(creatinine,Cr)测定;进食100 g馒头标准餐后 0.5、1、2、3 h 采静脉血行血糖、胰岛素的测定;测定踝臂指数(ankle-brachial index,ABI=踝部收缩压/臂部收缩压);行颈部血管彩超观察颈动脉内膜厚度(intima-media thickness,IMT),由专门医师检测。
1.2.2 脂肪肝的B超诊断标准 ①肝区近场回声弥漫性增强(强于肾脏和脾脏),远场回声逐渐衰减。②肝内管道结构显示不清。③肝脏轻至中度肿大,边缘角圆钝。④彩色多普勒血流显像提示肝内彩色血流信号减少或不易显示,但肝内血管走向正常。⑤肝右叶包膜及横膈回声显示不清或不完整。具备上述第1项及第2~4项中一项者为轻度脂肪肝;具备上述第1项及第2~4项中两项者为中度脂肪肝;具备上述第1项及第2~4项中两项和第5项者为重度脂肪肝。CT标准:肝脏密度普遍降低,肝/脾CT值比较,0.7 < 轻度 <10,0.5 < 中度 ≤0.7,重度≤0.5[11]。
1.2.3 胰岛素抵抗的评估 胰岛素抵抗的评价方法采用稳态模式评估法的胰岛素抵抗指数(homeostasis model assessment-insulin resistance index,HOMA-IR)=FBG×FINS/22.5;β细胞功能指数(HOMA B-cell function index,HBCI);早相胰岛素分泌指数ΔI30/ΔG30;晚相胰岛素分泌指数I30~120AUC/G30~120AUC。
1.2.4 胰岛素抵抗标准 选取本次研究中HOMA-IR的均值2.57为标准,大于此值为阳性;HBCI的均值79.54 为标准,小于此值为阳性;ΔI30/ΔG30的均值2.55为标准,小于此值为阳性;I30~120AUC/G30~120AUC的均值2.20为标准,小于此值为阳性。
1.3 统计学方法 采用NOSA软件统计分析,计量资料以均数±标准差(±s)表示,采用t检验;计数资料用率表示,采用率的u检验。P<0.05示差异有统计学意义。
2 结果
2.1 脂肪肝组患者与非脂肪肝组体检者相关因素的比较 脂肪肝患者在 ALT、UA、IMT、ABI、FIB、uAlb/Cr、CRP、BMI、WHR 等方面与非脂肪肝者相比较,差异有统计学意义(P<0.05)(表1)。

表1 脂肪肝组患者与非脂肪肝组体检者相关因素
2.2 不同程度脂肪肝组患者、非脂肪肝组体检者胰岛素抵抗比较 不同程度的脂肪肝患者,其胰岛素抵抗指数、β细胞功能指数、早相胰岛素分泌指数相比较,之间存在着差异性(P<0.05),有统计学意义;而晚相胰岛素分泌指数比较,无显著性差异(P>0.05)。提示随着脂肪肝程度的加重,患者胰岛素抵抗加重,β细胞功能减退程度以及早相胰岛素分泌减低亦随之加重;而晚相胰岛素分泌尚无明显差异(表2)。
2.3 非酒精性脂肪肝患者与对照组患者胰岛素抵抗发生率的比较 脂肪肝组患者胰岛素抵抗指数、β细胞功能指数、早相胰岛素分泌指数的阳性率高于非脂肪肝组,有统计学意义(P<0.05);而两组晚相胰岛素分泌指数阳性率比较则无显著性差异(P>0.05)。说明脂肪肝患者胰岛素抵抗增高,而β细胞功能、早相胰岛素分泌则减退(表3)。
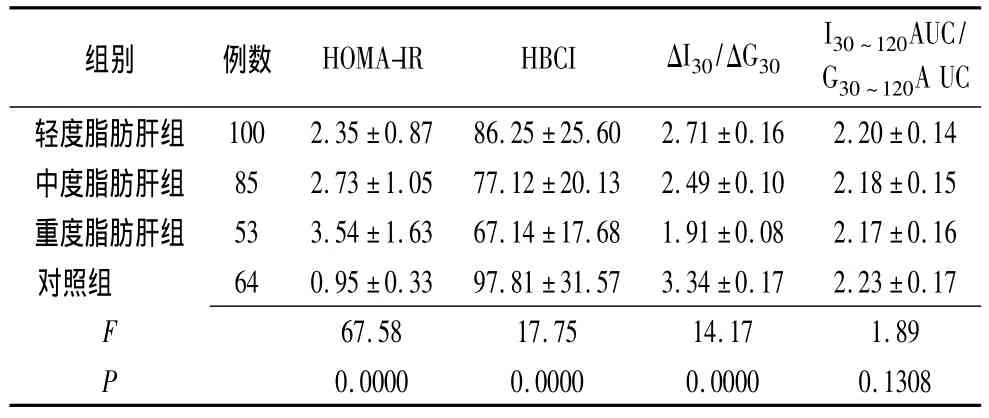
表2 不同程度脂肪肝组患者、非脂肪肝组体检者胰岛素抵抗比较 (%)
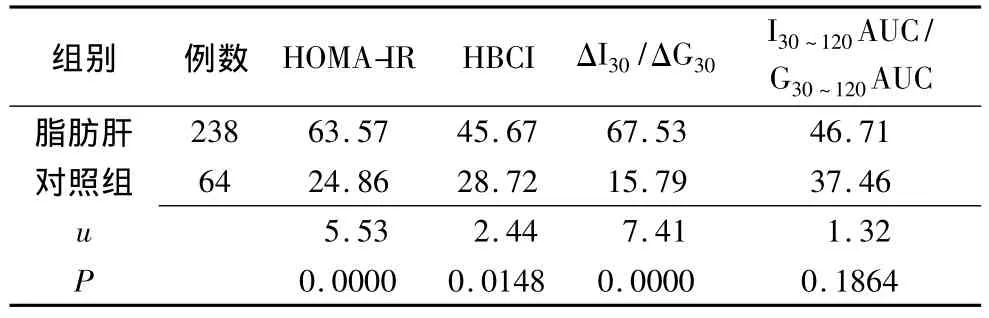
表3 非酒精性脂肪肝患者与对照组患者胰岛素抵抗发生率的比较 (%)
3 讨论
非酒精性脂肪肝是代谢紊乱在肝脏的临床表现,胰岛素抵抗是发病的关键[2]。由于腹部肥胖的真正风险在于内脏脂肪堆积[3]。研究显示,NAFLD比BMI所反应的总体肥胖和腰围所提示的内脏性肥胖更能预测危险因素的聚集[1]。而中心性肥胖又以内脏型肥胖为主,表现为脂肪肝。因此,本次研究旨在探讨IR和脂肪肝两者的相互关系。
研究发现,与胰岛素抵抗密切相关的指标,如BMI、WHR、UA、CRP、uAlb/Ucr值、FIB、HOMA-IR在非酒精性脂肪肝组显著升高,有研究显示胰岛素抵抗是NAFLD最强的预测因子[4];而且提示血管硬化的指标IMT、ABI指数等在非酒精性脂肪肝组亦是明显升高。有研究对NAFLD患者随访6~15年,代谢综合征、2型糖尿病和冠心病发病率显著增高[5]。
有研究显示,NAFLD患者都存在周围组织和肝脏的胰岛素抵抗,而且其严重程度与NAFLD病情进展相关[6],这与本研究所得结果是一致的。重度脂肪肝的胰岛素抵抗指数明显高于轻度脂肪肝,提示其抵抗程度是增加的。而重度脂肪肝的早相胰岛素分泌指数明显低于轻度脂肪肝,说明其早相胰岛素分泌是减退的。研究[7]认为胰岛素抵抗参与了非酒精性脂肪肝的发生和发展。胰岛素抵抗主要通过两个途径导致脂肪在肝细胞内储积:加强周围组织脂肪分解和高胰岛素血症。胰岛素抵抗可减弱和(或)破坏胰岛素对脂肪代谢的调节作用,增加脂质溶解,提高循环中血游离脂肪酸浓度,血清中游离脂肪酸增多,而肝细胞对脂肪酸的高摄入导致线粒体氧化超载,加重肝细胞内脂肪酸的储积。同时,增多的血游离脂肪酸也可直接经门静脉排至肝脏,造成肝细胞内血游离脂肪酸蓄积;高胰岛素血症时糖降解增加,从而增加脂肪酸的合成,使三酰甘油储积增加,聚集在肝细胞质中,形成脂肪肝。
大多数学者认为胰岛素抵抗和肝脏脂肪累积起关键作用;而肝脏脂肪变性又加重了胰岛素抵抗[8]。Roland等[9]提出非酒精性脂肪肝不但与胰岛素抵抗伴随,还是胰岛素抵抗的早期标志。游离脂肪酸增多,可以通过抑制胰岛素释放、干扰胰岛素对血糖的正常作用来加重胰岛素抵抗;增多的游离脂肪酸还可阻断酪氨酸磷酸化的细胞信号。出现异常丝氨酸和苏氨酸磷酸化非信号转导[10],从而加重胰岛素抵抗。肝脏B超作为一种简便、费用低、无创、脂肪肝检出率高的一项常规检查,及早进行肝脏B超筛查,对于早期发现代谢紊乱具有重要的临床意义。治疗NAFLD的首要目标为改善胰岛素抵抗,防治代谢综合征及其相关终末期器官病变,对其发生糖尿病、心血管疾病等危险性进行全面评估,对处于不同危险等级的人群进行不同力度的干预,从而改善患者生活质量和延长存活时间。
[1]Fan JG,Farrell GC.Epidemiology of non-alcoholic fatty liver disease in China[J].Hepatol,2009,50(1):204-210.
[2]范建高,曾民德.脂肪性肝病[M].北京:人民卫生出版社,2005:200-229.
[3]Te Sligte K,Bourass I,Sels JP,et al.Non-alcoholic steatohepatitis:review of a growing medical problem[J].Eur J Intern Med,2004,15(1):10-21.
[4]Cave M,Deaciuc I,Mendez C,et al.Nonalcoholic fatty liver disease:predisposing factors and the role of nutrition[J].Nutr Biochem,2007,18(3):184-195.
[5]Vuppalanchi R,Chalasani N.Non-alcoholic fatty liver disease and non-alcoholic steatohepatitis:selected practical issues in their evaluation and management[J].Hepatology,2009,49(3):306-317.
[6]Marchesini G,Brizi M,Bianchi G,et al.Nonalcoholic fatty liver disease:a feature of the metabolic syndrome[J].Diabetes,2001,50(8):1844-1850.
[7]Pirgon O,Bilgin H,Tolu I,et al.Correlation of insulin sensitivity with bone mineral status in obese adolescents with non-alcoholic fatty liver disease[J],Clin Endocrinol(Oxf),2011,3(8):1365.
[8]Lindh M,Hannoun C,Dhillon AP,et al.Core promoter mutations and genotypes in relation to virus replicatio and liver damage in East Asian hepatitis B virus carriers[J].J Infect Dis,1999,179(4):775-782.
[9]Roland M,Fairbank J.The Roland-Morris disability questionnaire and the oswestry disability questionnaire[J].Spine,2000,25(24):3115-3124.
[10]Liu YF,Hersehkovitz A,Bouraz-Halfon S,et al.Serine phosphorylaien roximal to its phosphorosine binding domain inhibits insulin receptor substrate 1 function and Promotes insulin resistance[J].Mol Cell Biol,2004,24(21):960-966.
