雷帕霉素对胰腺癌PC-2细胞增殖和凋亡的影响
2011-07-28刘小旭刘梦洁代志军王西京康华峰
刘小旭,刘梦洁,代志军※,王西京,康华峰
(1.西安交通大学医学院第二附属医院肿瘤科,西安710004;2.西安交通大学医学院,西安710061)
胰腺癌的发病在世界范围内迅速增加,其恶性程度高、转移早、治疗困难、预后差,是肿瘤学界的一大难题。近年来,靶向治疗因其特异性强、靶向抑制作用和不良反应轻微,在肿瘤治疗中占有重要地位。分子靶向药物可通过阻断肿瘤细胞的信号转导,从而控制细胞基因表达的改变,产生抑制肿瘤细胞生长的效应。磷脂酰肌醇3激酶/蛋白激酶B/哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)通路是与细胞增殖和细胞凋亡关系最为密切的信号转导通路之一[1]。作为mTOR抑制剂,雷帕霉素(rapamycin,RPM)在肿瘤分子靶向治疗中受到了越来越多的关注。本研究以体外培养的人胰腺癌PC-2细胞为对象,探讨RPM对胰腺癌细胞增殖和细胞凋亡的影响及其机制。
1 材料和方法
1.1 材料 胰腺癌PC-2细胞株由西安交通大学管海涛博士惠赠。新生牛血清(Gibco,USA);RPMI1640 培养基(Gibco,USA);碘化丙啶 (propidiumiodide,PI)(Sigma,USA);四甲基偶氮唑盐(Sigma,USA);荧光探针罗丹明123(Rhodamine 123)(Sigma,USA);RPM(Sigma,USA);其他试剂均为国产分析纯。流式细胞仪(Becon Dickinson Facsalibur公司,USA)。
1.2 细胞培养和传代PC-2细胞于37℃、5%CO2混合气体和饱和湿度的培养箱中进行培养,生长培养基为RPMI 1640完全培养基,含10%热灭活(56℃,30 min)的小牛血清、青霉素100 U/mL、链霉素100 U/mL,待细胞生长呈单层铺满瓶底时,用0.25%的胰蛋白酶∶0.02%乙二胺四乙酸=1∶1的混合消化液消化传代。细胞换液时间为2 d,传代5 d。
1.3 细胞增殖能力检测 选取对数生长期的PC-2细胞,经胰酶消化、台盼蓝染色后在红细胞计数板上计数,确保活细胞在97%以上。调整细胞浓度为每孔5×103个(每孔100 μL),加到96孔培养板中。将培养板放入37℃、5%CO2孵箱中培养。另设对照组。待细胞贴壁后取出培养板,分别加入适量RPM,使终浓度分别为 10、20、30、40 和50 nmol/L,每个浓度设5个复孔;同时设置未加RPM者为空白对照组和调零孔。培养板放回孵箱继续培养6 h,取出培养板,每孔加入四甲基偶氮唑盐5 μg/μL,培养板再放回孵箱孵育4 h。吸出上清液,加入200 μL二甲基亚砜。在平板摇床摇10 min,用酶标仪测490 nm波长处每孔的吸光度(A值)。细胞生长抑制率(IR%)=[(对照组 A值 -处理组 A值)/对照组 A值]×100%
1.4 细胞凋亡检测 取处于对数生长期的细胞,常规消化,制成单细胞悬液。计数并均以105个/mL浓度接种于6个50 cm培养瓶中,分别加入适量RPM,使终浓度分别为10、20、30、40 和 50 nmol/L,常规培养48 h后,消化并收集细胞,制成单细胞悬液,将细胞悬液加入离心管中,800 r/min离心5 min,弃掉离心管中上清;以冰PBS缓冲液漂洗两遍,沿管壁缓慢加入75%的4℃乙醇固定,4℃过夜;测试前用PBS液洗去乙醇,离心除去上清,每管加入100 μg/mL RNA酶1 mL,置于37℃孵箱中30 min;然后每管中加入125 μg/mL碘化丙啶1 mL标记,低温(2~8℃)避光静置30 min,上流式细胞仪进行检测分析。
1.5 mTOR mRNA表达检测 PC-2细胞按1×106个/瓶接种于100 mL培养瓶中,孵育24 h待细胞贴壁后加 RPM。RPM 按 0、10、20、30、40 和 50 nmol/L浓度梯度分别处理12 h,收集细胞,用Trizol提取总RNA。取1 μg RNA经反转录酶在下列条件下合成cDNA:70℃ 5 min,42℃ 延伸 60 min,95℃ 酶灭活3 min,4℃终止反应。然后用该cDNA作为模板进行聚合酶链反应(polymerase chain reaction,PCR),PCR引物由 Invitrogen公司合成。mTOR引物序列:5'-CGCTGTCATCCCTTTATCG-3'(sense)和5'-ATGCTCAAACACCTCCACC-3'(anti-sense),扩增片段为218 bp,退火温度为55℃(35个循环)。内对照β肌动蛋白(β-actin)引物序列:5'-GTTGCGTTACACCCTTTCTTG-3'(sense),5'-TGCTGTCACCTTCACCGTTC-3'(anti-sense),扩增片段为136 bp,退火温度为55℃(40个循环)。扩增条件如下:95℃预变性3 min,95℃变性30 s、55 ℃退火30 s、72 ℃延伸30 s,进行相应循环次数。PCR产物于1.5%琼脂糖凝胶电泳,50 mL琼脂糖中加溴乙锭2.0 μL凝胶成像系统作密度指数分析。β-actin扩增产物为内参照。mTOR mRNA相对表达量的判定:以各mTOR mRNA电泳条带密度指数与相对的内参照β-actin密度指数之比来表示。
1.6 统计学方法 应用SPSS 11.0统计软件进行处理,计量数据以均数±标准差(±s)表示,多组间比较采用方差分析法,相关性分析采用Spearman法,显著性检验水平为α=0.05。
2 结果
2.1 RPM对PC-2细胞增殖的影响 不同浓度的RPM作用于 PC-2细胞0、24、48和72 h后,对 PC-2细胞的生长有明显的抑制作用,呈时间和浓度的依赖性,随药物作用时间延长和浓度增加,细胞生长抑制率逐渐升高,50 nmol/L的RPM作用96 h引起的生长抑制率明显高于其他浓度组的抑制率(P <0.05),高达(82.5 ±5.4)%(图1)。

图1 RPM对PC-2细胞增殖的抑制作用
2.2 RPM对PC-2细胞凋亡的影响 正常对照组PC-2细胞凋亡率为(3.27 ±1.43)%;10~50 nmol/L RPM组作用24 h后PC-2细胞凋亡率分别为(8.53±2.14)%、(17.58 ± 4.10)%、(39.24 ±5.66)%、(51.30 ±4.12)% 和(64.81 ±7.52)%,结果显示10~50 nmol/L RPM均能诱导不同程度的细胞凋亡(P <0.05或P <0.01);且10~30 nmol/L RPM 组以早期凋亡细胞为主,随着RPM浓度的增高,晚期凋亡细胞明显增多(图2)。

图2 RPM诱导PC-2细胞凋亡的AnnexinV-FITC/PI双标染色及流式细胞术分析
2.3 RPM对胰腺癌PC-2细胞mTOR mRNA表达的影响 反转录-PCR结果显示,未经RPM处理的PC-2细胞中mTOR mRNA水平较高,其中空白对照组、10~50 nmol/L RPM组mTOR mRNA相对表达量分别为:127.35 ± 7.52、104.31 ± 6.31、96.52 ± 4.24、53.60 ±5.13、50.09 ±4.12、21.43 ±2.42。与空白对照组相比,药物处理组mRNA相对表达量均有不同程度的抑制效应;而且随着RPM浓度增高,mTOR mRNA水平表达逐渐降低(图3A,图3B)。RPM与mTOR mRNA表达间呈现较好的剂量依赖性关系(P <0.05)。
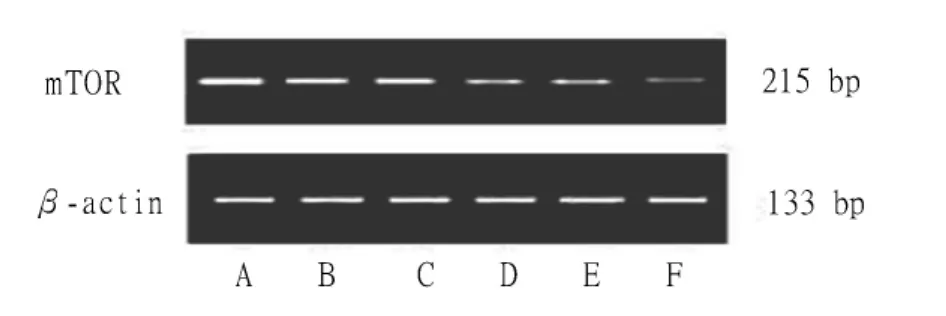
图3A 不同浓度的RPM处理12 h后PC-2细胞中mTOR mRNA的表达
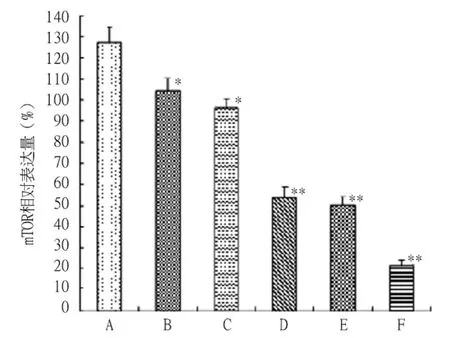
图3B 不同浓度的RPM处理12 h后PC-2细胞中mTOR mRNA的表达
3 讨论
mTOR是一种进化非常保守的蛋白激酶,广泛地存在于多种生物细胞中。近年来的进一步研究发现,mTOR在细胞蛋白质合成、能量平衡中起关键作用,从而影响细胞生长和增殖的很多方面,包括细胞分化、细胞周期进程、新生血管生成、蛋白降解和细胞凋亡等。mTOR可被许多致瘤信号所激活,例如,表皮生长因子、胰岛素样生长因子和血管内皮生长因子等生长因子受体的活化或突变、PTEN抑癌基因的沉默、磷脂酰肌醇3激酶催化亚型的激活、Akt基因的扩增以及Ras-Raf-MEK通路的激活[1]。
RPM是一种亲脂性三烯含氮大环内酯抗生素类免疫抑制药,是最早被发现的mTOR抑制剂。RPM通过调节mTOR通路从而抑制乳腺癌细胞增殖,同时也可以抑制宿主免疫应答[2]。现主要用于防治肾、肝等器官移植的排斥反应[3]。其主要不良反应为高血脂和骨髓抑制作用,长期应用耐受良好。以往的研究证实,RPM具有浓度依赖性地抑制肿瘤细胞生长的活性,例如肉瘤、膀胱癌、肝癌等[4-6]。本实验中不同浓度的RPM作用于PC-2细胞0~96 h后,对PC-2细胞的生长有明显的抑制作用,表现为呈时间和浓度的依赖性,随药物作用时间延长和浓度增加,细胞生长抑制效应逐渐增强。
mTOR抑制剂是否能诱导肿瘤细胞凋亡,目前尚有争议。在胰腺癌中,mTOR抑制剂可抑制几乎所有p53缺陷的癌细胞株的生长[7]。研究发现,RPM诱导凋亡的能力可能依赖于细胞内p53的水平[8]。在缺乏功能性p53的横纹肌肉瘤中,RPM抑制细胞生长,诱导大量细胞凋亡;但功能性p53的表达则保护肉瘤细胞逃逸RPM诱导的凋亡。对于高表达Akt的淋巴瘤,mTOR抑制剂能显著增加化疗诱导的凋亡[9]。Huang 等[10]的研究揭示,RPM 不仅能引起肿瘤细胞周期阻滞,还可诱导p53功能缺失所致的细胞凋亡。其可能机制为RPM能够诱导凋亡信号调节酶1激活,并可延迟其激活时间,同时也能够激活C-Jun N端酶的活性,提高磷酸化的C-Jun的含量,凋亡信号调节酶1和磷酸化的C-Jun都能够促进肿瘤细胞的凋亡,从而抑制肿瘤的生长[11]。Fechner等[12]的研究中可抑制人膀胱癌细胞的增殖但不能有效地诱导细胞凋亡,同时发现RPM可减少缺氧导致的血管内皮生长因子合成。本研究中流式细胞术分析结果发现RPM具有诱导PC-2细胞凋亡的作用,且随着药物浓度的提高,凋亡率增高,存在一定的剂量依赖关系。流式细胞术检测结果显示:正常对照组、10~50 nmol/L RPM组PC-2细胞凋亡率分别为(3.27 ± 1.43)%、(8.53 ± 2.14)%、(17.58 ±4.10)%、(39.24 ±5.66)%、(51.30 ±4.12)% 和(64.81 ±7.52)%,提示10~50 nmol/L RPM 均能诱导不同程度的细胞凋亡(P<0.05或 P<0.01);且10~30 nmol/L RPM组以早期凋亡细胞为主,随着RPM浓度的增高,晚期凋亡细胞明显增多。
RT-PCR结果显示,与空白对照组相比,RPM处理组mRNA相对表达量均有不同程度的抑制效应;而且随着RPM浓度增高,mTOR mRNA水平表达逐渐降低(图3A、3B)。RPM与mTOR mRNA表达间表现出较好的剂量依赖性关系(P<0.05)。
综上所述,RPM可有效抑制胰腺癌PC-2细胞增殖,并诱导细胞凋亡,其作用机制可能与下调mTOR基因表达有关。
[1]Mahalingam D,Sankhala K,Mita A,et al.Targeting the mTOR pathway using deforolimus in cancer therapy[J].Future Oncol,2009,5(3):291-303.
[2]Zheng J,Hudder A,Zukowski K,et al.Rapamycin sensitizes Akt inhibition in malignant human breast epithelial cells[J].Cancer Lett,2010,296(1):74-87.
[3]Castroagudín JF,Molina-Pérez E,Ferreiro-Iglesias R,et al.Strategies of immunosuppression for liver transplant recipients with hepatocellular carcinoma[J].Transplant Proc,2011,43(3):711-713.
[4]Vemulapalli S,Mita A,Alvarado Y,et al.The emerging role of mammalian target of rapamycin inhibitors in the treatment of sarcomas[J].Target Oncol,2011,6(1):29-39.
[5]Mansure JJ,Nassim R,Chevalier S,et al.Inhibition of mammalian target of rapamycin as a therapeutic strategy in the management of bladder cancer[J].Cancer Biol Ther,2009,8(24):2339-2347.
[6]Guo Y,Liang X,Lu M,et al.Mammalian target of rapamycin as a novel target in the treatment of hepatocellular carcinoma[J].Hepatogastroenterology,2010,57(101):913-918.
[7]Garrido-Laguna I,Tan AC,Uson M,et al.Integrated preclinical and clinical development of mTOR inhibitors in pancreatic cancer[J].Br J Cancer,2010,103(5):649-655.
[8]Nagata Y,Takahashi A,Ohnishi K,et al.Effect of rapamycin,an mTOR inhibitor,on radiation sensitivity of lung cancer cells having different p53 gene status[J].Int J Oncol,2010,37(4):1001-1010.
[9]Barger JF,Gallo CA,Torni KA,et al.Identification of Akt-selective cytotoxic compounds that enhance cytotoxic responses to rapamycin[J].Cancer Biol Ther,2011,10(12):1256-1261.
[10]Huang S,Shu L,Dilling MB,et al.Sustained activation of the JNK cascade and rapamycin-induced apoptosis are suppressed by p53/p21(Cip1)[J].J Mol Cell,2003,11(6):1491-1501.
[11]Huang S,Shu L,Easton J,et al.Inhibition of mammalian target of rapamycin activates apoptosis signal-regulating kinase 1 signaling by suppressing protein phosphatase 5 activity[J].J Biol Chem,2004,279(35):36490-36496.
[12]Fechner G,Classen K,Schmidt D,et al.Rapamycin inhibits in vitro growth and release of angiogenetic factors in human bladder cancer[J].Urology,2009,73(3):665-669.
