慢性阻塞性肺疾病患者的全身炎症反应与气道炎症反应的变化及相互关系①
2011-06-21穆林刘绍坤向旭东
穆林 刘绍坤 向旭东
(1.长治医学院附属和平医院呼吸科 山西长治 150040; 2.中南大学湘雅医院二院呼吸科 长沙 410001)
目前对COPD发病的原因和机制还未完全阐明,其发病机制主要有:细胞因子炎症学说;氧化应激;蛋白酶-抗蛋白酶失衡学说等[1]。本文通过检测COPD急性加重期和治疗缓解后患者外周血、诱导痰液中IL-8、TNF-α、CRP的变化并进行肺功能测定,以探讨COPD患者不同分期全身炎症反应以及其与局部气道炎症的关系。
1 临床资料
1.1 一般资料
收集2007年11月至2008年6月附属医院呼吸内科住院的62例COPD患者,其入院时为急性发作。男51例,女11例,年龄(51±9.7)岁(46~71岁)。所有患者均行肺功能检查,加重期组经正规治疗1周以上临床症状缓解者为缓解期组。入院后第1天同时采取外周血和进行诱导痰检查,并做肺功能检查。之后给予常规祛痰、抗感染、平喘等治疗10~14d,待病情缓解后、等待出院的患者重复上述检查。COPD诊断均符合慢性阻塞性肺疾病诊治指南[1]的诊断标准。
排除标准:入院前4周及住院期间局部或全身应用糖皮质激素治疗的COPD患者;合并哮喘、支气管扩张、肿瘤、结缔组织病、糖尿病、甲状腺功能亢进、高血压病、严重左右心功能衰竭(心功能Ⅲ、Ⅳ级)者。
1.2 标本采集与保存
1.2.1 诱导痰的采集、处理和质量控制 参照文献[2]的方法进行。
1.2.2 血标本的采集与保存 入院后空腹抽取静脉血6mL,注入试管中,离心25oorpm,15~20℃,10~20min,吸取血清放入即Ependoff管中,-70℃低温保存以备统一检测。COPD缓解期再予空腹抽取静脉血6mL,立即同上述方法离心血清,放于-70℃冰箱保存,以待检测IL-8,TNF-α,CRP。
1.3 主要试剂,仪器
1.3.1 主要试剂 IL-8,TNF-αELISA试剂盒购于上海森雄科技实业有限公司0.1%二硫苏糖醇(DTT)(长治医学院中心实验室提供)。
1.3.2 主要仪器 日本产OLYMPUSAU2700全自动生化分析仪,肺功能仪(SensorMedicsLtd,USA),BX41TF光学显微镜(日本OLYMPUS公司),AG245电子天平(瑞士Metler-Toledo公司),20-200uL的微量移液器,血球计数板(上海医学光学仪器厂制),美国产BIO-RAD680酶联免疫检测仪,日本产SANYO超低温冰箱,德国产Heraeus离心机,上海跃进医疗器械厂产PYX-DHS-35XYO-B孵育箱等。
1.4 IL-8和TNF-α的测定
痰液及血清IL-8和TNF-α测定应用双抗体夹心ABCELISA法,试剂盒购于上海森雄科技实业有限公司。
1.5 CRP的测定
CRP用散射比浊法测定,仪器:贝克曼免疫生化系统(Beckman immuno-chemis-systems)。
1.6 肺功能检测
所有患者入院第1天和第14天均使用肺功能仪测定FEV1.0,并计算出FEV1.0占预计值百分数(FEV1.0pre)等。
1.7 统计学处理
2 结果
2.1 一般资料COPD患者的临床特征(表1)
本研究是COPD患者的前后对照研究,62例患者均符合COPD标准。62例AECOPD患者入院当天和经治疗10~14d临床症状缓解后分别进行诱导痰检查,10例不能耐受痰诱导过程,7例痰标本质量不合格而退出研究,最终顺利完成痰诱导且痰标本合格患者有45例,均有吸烟史,6例仍吸烟,39例已戒烟。
表1 COPD患者的临床特征(±s)
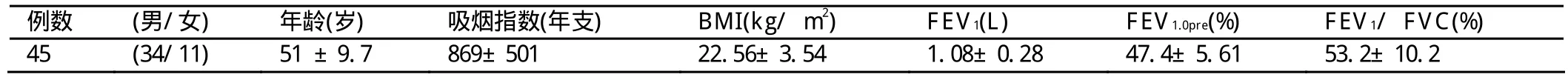
表1 COPD患者的临床特征(±s)
例数 (男/女)年龄(岁)吸烟指数(年支)BMI(kg/ m2)FEV1(L)FEV1.0pre(%)FEV1/ FVC(%)45 (34/11)51 ±9.7 869±501 22.56±3.54 1.08±0.28 47.4±5.61 53.2±10.2
表2 治疗前后痰液IL-8,TNF-α,CRP水平以及FEV1.0pre结果(±s)

表2 治疗前后痰液IL-8,TNF-α,CRP水平以及FEV1.0pre结果(±s)
IL-8 (pg/mL)TNF-α(pg/mL)CRP(mg/L)FEV1.0pre(%)治疗前 1430.00±932.56 254.75±243.32 31.30±18.64 47.40±5.61治疗后 751.63±431.29 124.36±113.38 4.34±1.43 61.70±4.29 P值 P<0.01 P<0.01 P<0.01 P<0.01
表3 治疗前后血清IL-8,TNF-α,CRP水平(±s)

表3 治疗前后血清IL-8,TNF-α,CRP水平(±s)
IL-8(pg/mL)TNF-α(pg/mL)CRP(mg/L)治疗前 236.58±68.74 98.68±70.87 18.73±14.45治疗后 105.24±34.52 54.73±28.32 4.97±1.75

表4 痰液IL-8,TNF-α,CRP水平与FEV1.0pre的相关性分析

表5 血清IL-8,TNF-α,CRP水平与FEV1.0pre的相关性分析

表6 痰液与血清IL-8,TNF-α,CRP水平的相关性分析
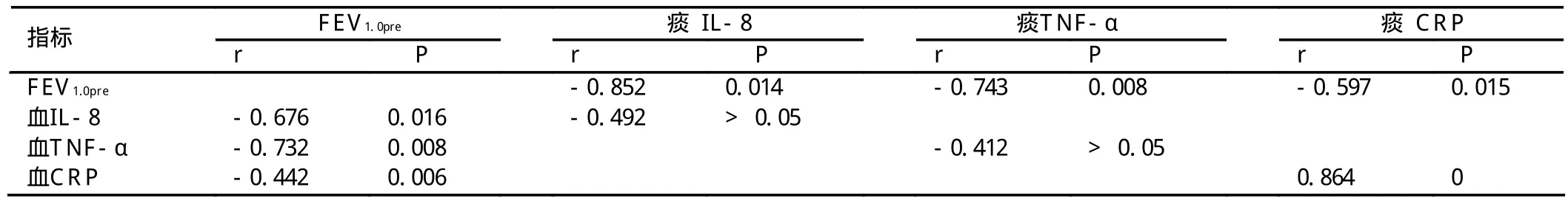
表7 相关性分析结果
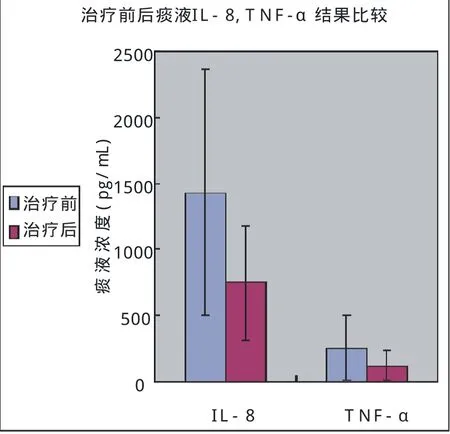
图1 治疗前后痰液IL-8,TNF-α比较(P<0.01)

图2 治疗前后痰液CRP比较(P<0.01)
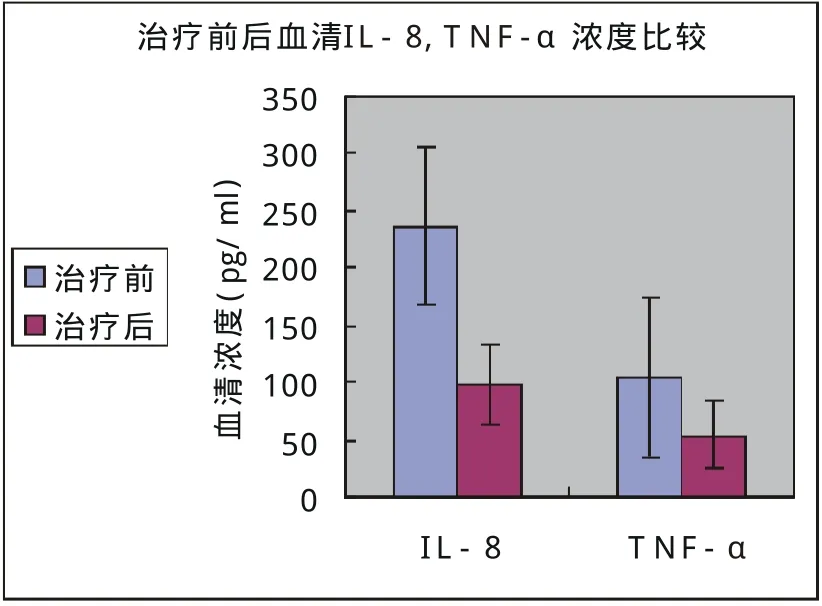
图3 治疗前后血清IL-8,TNF-α比较(P<0.01)
2.2 治疗前后痰液IL-8,TNF-α,CRP水平的变化以及FEV1.0pre结果(表2,图1、2、5)
经治疗后FEV1.0pre明显改善(P<0.01),痰液IL-8,TNF-α和CRP水平显著降低(P<0.01,P<0.01,P<0.01)。
2.3 治疗前后血清IL-8,TNF-α和CRP水平的变化(表3,图3、4)
经治疗后血清IL-8,TNF-α和CRP水平显著降低(P<0.01,P<0.01,P<0.01)。

图4 治疗前后血清CRP比较(P<0.01)
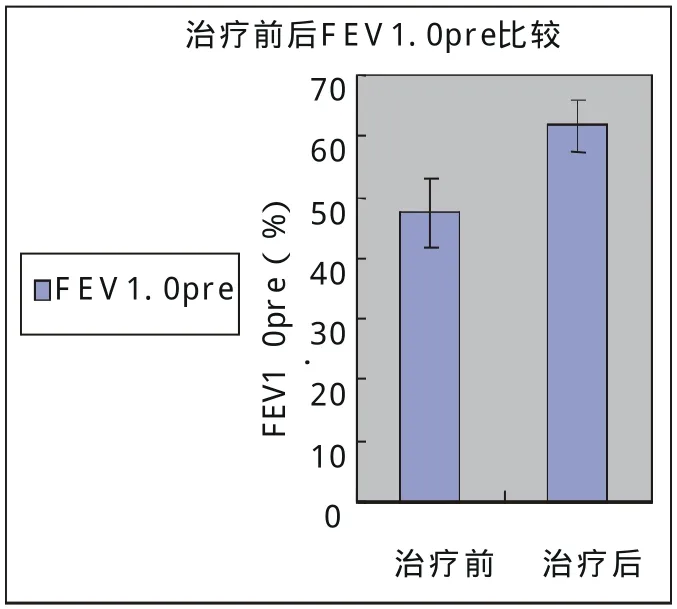
图5 治疗前后FEV1.0pre比较(P<0.01)
2.4 IL-8,TNF-α和CRP与肺功能的相关性
2.4.1 痰液IL-8,TNF-α和CRP与肺功能的相关性 痰液IL-8,TNF-α和CRP与FEV1.0pre呈显著负相关(表4)。
2.4.2 外周血清IL-8,TNF-α,CRP与肺功能的相关性 外周血清IL-8,TNF-α,CRP与FEV1.0pre呈明显负相关(表5)。
2.5 痰液与血清IL-8,TNF-α,CRP水平的相关性
比较痰液IL-8和TNF-α与血清TNF-α水平,显示无明显相关(分别为r=0.492,P>0.05;r=0.412,P>0.05),痰液CRP与血清水平呈显著正相关,见表6。
3 讨论
IL-8是细胞趋化因子家族中的主要组成成分,作用是参与炎症过程中性粒细胞和T淋巴细胞的聚集和活化,从而参与炎症反应和调节免疫[3],结果使COPD患者气道黏膜中大量的中性粒细胞及T淋巴细胞浸润。本实验结果证实COPD急性发作时外周血清及诱导痰上清液中IL-8均明显高于缓解期水平(均P<0.01)与FEV1.0pre呈负相关,可见IL-8是肺功能下降的重要影响因素之一,可能起着维持,甚至加重气道和全身炎症的重要作用,并在一定程度上反映气道和全身炎症的严重程度。
国内外有许多资料均已证实TNF-α对气道炎症具有促进作用:COPD大鼠血清、BALF中的TNF-α浓度较正常对照组增高,且后者还与白介素-8(IL-8)相互作用,通过激化中性粒细胞等炎症细胞共同参与COPD发病,在COPD气道炎症的持续和放大中起到重要作用,说明其在COPD发病中具有重要意义[4~6]。
本实验结果证实COPD急性发作时外周血清及诱导痰上清液中TNF-α均明显高于缓解期水平(均P<0.01)并与FEV1.0pre呈负相关,提示TNF-α在COPD气道和全身炎症的持续中起到重要作用,在COPD发病中具有促进作用。
CRP是一种急性时相蛋白,当组织发生急性炎症时,由巨噬细胞释放的IL-6可刺激肝脏合成大量CRP,使血清CRP浓度升高,是最为敏感的炎症蛋白[7]。本研究通过检测急性发作与治疗缓解后COPD患者血、痰CRP水平,发现血、痰CRP水平与肺功能指标呈负相关(均P<0.05),且与病情变化、严重程度具有一致性,反过来提示血CRP对COPD气道炎症、急性发作及病情严重性判断也具有一定价值。
有作者提出COPD患者除局部气道炎症外,同时存在全身炎症[7~8],且与患者心功能不全、呼吸肌无力、营养不良及其他脏器损害[9]等有关。但是,COPD全身炎症是否由于局部气道炎症泛滥,导致炎性因子进入血液循环,对此研究甚少。本研究结果显示,COPD患者外周血TNF-α、IL-8水平在急性发作期明显升高(均P<0.01),但是与痰液中相应细胞因子水平无显著相关(P>0.05),表明COPD患者急性加重时全身炎症反应与局部气道炎症反应增强,但是二者不相一致,可能因二者具有不同的产生和调节途径。最初认为导致全身炎症反应的原因是肺部炎症细胞溢出至体循环所致,而近年的研究结果表明,骨骼肌来源的炎症均可成为COPD全身炎症的潜在原因,老龄和吸烟本身也可能导致全身炎症反应[10]。
同时本研究结果还显示,痰液与外周血CRP水平显著相关(P<0.01),血、痰CRP水平与肺功能指标呈负相关(均P<0.01),这一结果似乎提示全身炎症反应与局部气道炎症有相关性,除考虑结果的客观存在以外,还可能和以下因素有关:(1)TNF-α、IL-8均由炎症细胞分泌,而CRP由巨噬细胞释放的IL-6刺激肝脏合成;(2)白细胞介素-1b(IL-1b)和肿瘤坏死因子-α(TNF-α)也是CRP合成的重要调节因子[11~13]。炎症时,活化的巨噬细胞分泌IL-6诱导肝细胞产生CRP,而TNF-α是IL-6的强诱导剂;(3)近来有文献报道,呼吸道自身也存在CRP自分泌现象[14]。综上所述,可能TNF-α、IL-8的产生机制与CRP存在差异,CRP存在两种分泌机制,也可能是由于TNF-α促进CRP分泌的后效应的影响,由于观测时间较短,确切原因有待于进一步研究证实(图1、2、3、4、5、表7)。
[1]中华医学会呼吸病学分会慢性阻塞性肺疾病学组.慢性阻塞性肺疾病诊治指南[J].中华结核和呼吸杂志,2007,15(7):453~460.
[2]曾勉,吴健锋,谢灿茂,等.慢性阻塞性肺疾病急性加重期患者规范化痰诱导安全性的初步研究[J].中华结核和呼吸杂志,2005,28:238~241.
[3]Smith WB,Gamble JR,Clark Lewisi,et al.Interleukin-8 induces neutrophil transendothelial migration[J].Immunology,1991:65~72.
[4]张永,程德云,王慧,等.慢性阻塞效肺疾病大鼠白细胞介素-8和肿瘤坏死因子-α与气道炎症的关系研究[J].中国呼吸与危重监护杂志,2003,2(6):355~359.
[5]林挺岩,李玉珠,李志鹰,等.慢性阻塞效肺疾病血白细胞介素-8、肿瘤坏死因子-α、内皮素与肺功能的关系[J].福建医科大学学报,2000,34(4):347~399.
[6]董平,孔令敏,陈文靖,等.COPD急性发作期白细胞介素-8、肿瘤坏死因子-α的表达与预后分析[J].中国厂矿医学,2002(2):99~100.
[7]Malo O,Sauleda J,Busquets X,et al.Systemic inflammation during exacerbations of chronic obstructive pulmonary disease[J].Arch Broncopneumol,2002,38:172~176.
[8]Vernooy J H,Kucukaycan M,Jacobs JA,et al.Local and systemic inflammation in patients with chronic obstructive pulmonary disease:Soluble tumor necrosis factor receptors are increased in sputum[J].Am J Respir Crit Care Med,2002,166(9):1218~1224.
[9]Agusti AG,Noguera A,Sauleda J,et al.Systemic effects of chronic obstructive pulmonary disease[J].Eur Respir J,2003,21(2):347~360.
[10]Agusti A.Systemic effects of chronic obstructive pulmonary disease:what we know and what we don,t know(but should)[J].Proc Am Thorac Soc,2007,4:522~525.
[11]Jialal I,Stein D,Balis D,et al.Effects of hydroxymethyl glutaryl coenzyme A reductase inhibitor therapy on high senstitve C-reactive protein levels[J].Circulation,2001,103:1933.
[12]Steel D M,Whitehead A S.The major acute phase reactants:C-reative protain,serum amyloid P component and serumamyloid A protein[J].Immunol Today,1994,15:81.
[13]Buck C,Bundschu J,Gallati H,et al.Interleukin-6:a sensitive parameter for the early diagnosis of neonatal bacterial infection[J].Pediatrics,1994,93:54.
[14]Anderson GP.COPD,asthma and C-reactive protein[J].Eur Resp ir J,2006,27(5):874~876.
