NMDA受体2A亚单位mRNA和蛋白质在大鼠海马前脑缺血再灌注损伤中的变化
2011-06-09张旭滕大才徐铁军高伟
张旭 滕大才 徐铁军 高伟
迄今为止,国内外研究已证实NMDA受体在脑缺血中介导的兴奋毒作用的危害,兴奋毒性可导致急性细胞死亡(坏死),也可激起延迟类型的细胞死亡 (凋亡)[1-3]。现发现NMDAR至少存在7个亚单位[4,5]。其中,NR1亚单位是必需亚单位,2A和2B是主要的调节亚单位。因此把在缺血中起正性作用的亚单位作为靶目标,发展针对缺血性脑血管病的理想药物,而不干扰这些通道的正常生理功能,是目前和未来发展的趋势[6]。本研究针对缺血后大鼠海马NR2A mRNA的表达及蛋白变化情况,探讨其可能存在的关系,为进一步研究缺血性脑损伤的分子机制及研制和开发针对NR2A亚单位的特异性新药提供理论基础和形态学依据。
1 材料与方法
1.1 主要试剂、仪器及实验动物 寡核苷酸探针杂交试剂盒(博士德生物工程有限公司);2A免疫组化一抗(Santa Cruze),DEPC和DAB(Sigma)公司;实验动物为健康雄性SD大鼠30只,体重250~300 g,由徐州医学院实验动物中心提供。
1.2 动物分组及模型制作 实验动物随机分为3组:正常对照组(NC组,n=6)、假手术对照组(SC组,n=12)、缺血再灌组(IR组,n=12)。采用改良的四动脉阻断法(4 AO)建立短暂性前脑缺血(15 min)再灌注动物模型[7],再灌时间为24 h和48 h。在确定的时间点进行灌注固定,满足以下条件的大鼠进入后续实验:(1)第1次手术后24 h动物清醒;(2)夹闭双侧颈总动脉后大鼠应:①挣扎<50 s;②翻正反射消失;③呼吸频率先快速上升,后下降并稳定在正常范围;④双侧瞳孔由小变大,由红变白;⑤角膜反射消失。SC组大鼠除不电凝椎动脉和不夹闭颈总动脉外,其他手术过程同IR组。
1.3 灌注固定及切片制备 IR组在复灌后24和48 h与对应的NC组和IR组大鼠用20%水合氯醛(300~350 mg/kg)腹腔注射麻醉,经心-升主动脉插管灌注固定。在立体定位仪上将鼠脑冠状位分为前、中、后3段,取包含海马的中段入0.1 mol/L PBS(4℃,过夜)、入70%乙醇(4℃,过夜)。脱水:80%乙醇(1 h),95%乙醇(1 h×2),100%乙醇(1 h×2),透明:二甲苯(0.5 h×2);浸蜡:62℃(1 h×2);石蜡包埋。将包埋的脑块作连续冠状切片,片厚8 μm,以45℃展片,70℃烤片3 h。切片分8套,分别进行焦油紫染色、NR2A原位杂交和免疫组化染色,TUNEL染色及阴性对照染色。
1.4 IHC和ISH反应 IHC按ABC试剂盒说明书和本实验室方法进行[7]。ISH反应按试剂盒说明书和本实验室方法进行[8]。
1.5 图像分析 原位杂交和免疫组化的切片用LE2ICA QWin图像分析仪对CA1区、CA3区锥体细胞和齿状回颗粒细胞的染色强度进行灰度测量,以相应背景灰度值减去各测量点灰度值后的平均值作为海马各区的最终灰度值;TUNEL染色的切片在光镜下计数CA1区的凋亡细胞数,求出凋亡细胞百分率。
2 结果
2.1 IR组24 h,焦油紫染色结果显示CA1区细胞形态及数量均无明显变化;CA3区和齿状回的细胞未见明显改变。缺血后48 h,CA1区细胞胞体开始缩小,细胞间隙扩大,细胞淡染,并出现了坏死细胞,表现为细胞体积明显缩小,细胞固缩,并有破裂。CA3区可见少量的细胞胞体缩小,齿状回细胞形态和数量未见明显改变。见图1、2。

图1 假手术组(焦油紫×40)

图2 缺血48 h(焦油紫×40)
2.2 在CA1区,NR2A mRNA的表达于IR组24 h升至SC组的141.5%(P<0.01)。IR组24 h在CA3区和齿状回,缺血后NR2A mRNA的表达无明显变化。见表1,图3、4。
表1 3组大鼠海马CA1区NR2A原位杂交强度比较

表1 3组大鼠海马CA1区NR2A原位杂交强度比较
注:与IR组比较,*P<0.01
25.6±2.5 24.3±3.2 SC 组(n=12) 27.5±1.2* 23.9±2.8 26.4±3.5 IR组(n=12)CA1 CA3 DG NC 组(n=6) 26.3±3.6*组别38.9±2.4 26.5±3.1 27.1±2.6
2.3 在CA1区,NR2Am RNA的表达于IR组48 h降至SC组的59.3%(P<0.01)。IR组48 h在CA3区和齿状回缺血后NR2A mRNA的表达无明显变化。见表2,图5、6。
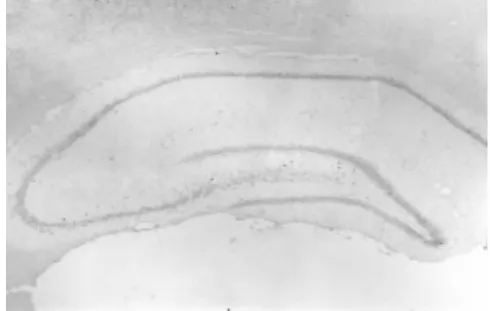
图3 假手术组(原位杂交×40)
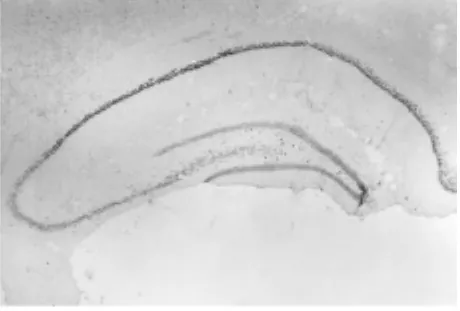
图4 缺血24 h(原位杂交×40)
表2 3组大鼠海马CA1区NR2A免疫组化强度比较

表2 3组大鼠海马CA1区NR2A免疫组化强度比较
注:与IR组比较,*P<0.01
CA1 CA3 DG NC 组(n=6) 39.4±3.4*组别37.3±3.2 38.5±2.3 SC 组(n=12) 35.9±2.1* 36.9±2.8 37.8± 3.1 IR组(n=12)21.3±2.2 35.2±3.1 35.6±2.4
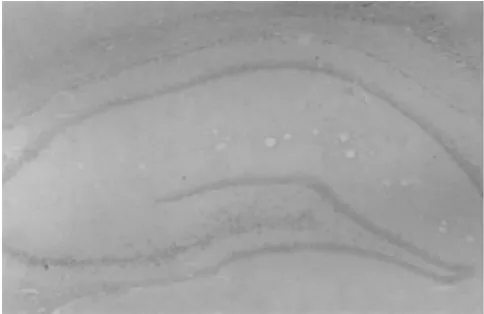
图5 假手术组(免疫组化×40)

图6 缺血48 h(免疫组化×40)
2.4 TUNEL染色显示IR组24 h海马CA1区出现了凋亡阳性细胞,而CA3和齿状回却没有出现。IR组48 h细胞凋亡为42.1±2.8,复灌24 h 为 35.2±3.0,差异有统计学意义(P<0.01),而CA3和齿状回却没有出现。见图7、8。
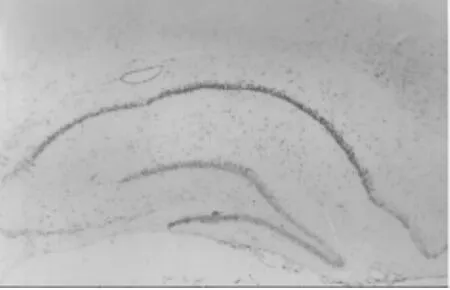
图7 缺血24 h(TUNEL×40)
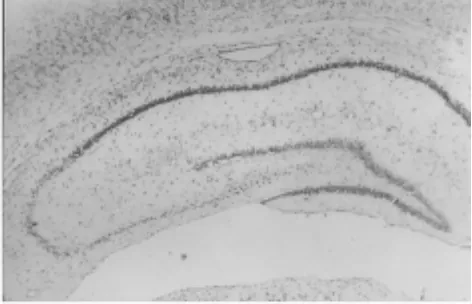
图8 缺血48 h(TUNEL×40)
3 讨论
本课题组既往实验表明,在脑缺血复灌后24、48、72 h,在海马CA1区NR2A mRNA水平升高[8],而NR2A蛋白水平降低[7],但在复灌后6 h~7 d的其他时间点,两者都呈现一致变化,既都是表达降低[7,8],为证明此3个时间点的不一致是由不同实验者、不同批动物所导致还是由于脑缺血早期时2A亚单位确实存在不一致变化这一现象,本实验研究了同一批大鼠在在脑缺血复灌后24和48 h的mRNA和蛋白的变化情况,以期揭示这一现象的原因所在。
目前已有实验报道在脑缺血中存在mRNA和蛋白不一致变化的现象,这一现象归因于在脑缺血时,蛋白的合成,而非转录,经常减弱,尽管mRNA的表达总的认为反映了蛋白水平的变化。本实验结果表明在脑缺血早期NR2A mRNA水平和蛋白水平确实存在着不一致变化。而这一现象在形态学方面并没有相关报道。
研究表明脑部是唯一依靠氧化磷酸化来产生能量代谢的。全脑缺血导致细胞功能所受影响之一就是蛋白质的合成。在啮齿类,在脑血流只有正常的70% ~80%时,脑蛋白质的合成是下调的。这一数值超过了维持ATP生产的灌注率。这一结果表明并非只有能量因素参与了翻译的下调过程。在复灌中,蛋白的合成被强烈抑制,它的恢复也比能量代谢的恢复慢的多。有趣的是,在易损性的神经元坏死之前,观察到持续的翻译抑制[9]。在易损性神经元中阻止翻译的恢复这一确切的机制尚不明确,但在翻译的下调和神经元的易损性之间这一惊人的联系中,表明前者在导致缺血细胞死亡这一发病机制的级联反应中起了关键性的作用[9,10]。因此本实验表明NR2A亚单位在海马CA1区神经元的死亡中起了重要作用。
多项研究已经证明了这一结论即mRNA的水平并不绝对预示着相应的蛋白水平[11]。脑缺血中,翻译和转录并不相伴这一现象不仅是时间依赖性的,而且在全脑缺血中,很可能是细胞特异性的[12]。因此,在确定一个特殊的蛋白是否在脑缺血过程中起了重要作用,证实蛋白的表达和/或蛋白的功能绝对必要的。因而,它为未来研究神经保护这一治疗目标提供了一个方向。
被缺血诱导的翻译抑制在抵抗区在最初的12~24 h即恢复,而在易损区则持续收到抑制[13]。本研究发现相对于CA3区和齿状回,海马CA1区在24 h即出现了凋亡细胞,在48 h出现了细胞坏死。这与文献报导的再灌注的2~3 d到第7天迟发性神经元坏死这一过程即开始了相一致[14]。而在缺血后早期2A亚单位的mRNA和蛋白水平既发生了变化,蛋白降低,下调的此蛋白很可能导致了CA1区神经元的功能丧失。因此,这一变化也许参与导致了CA1区在脑缺血中的易损性这一现象和脑缺血的坏死、凋亡过程,表明它在未来的研究中更具有潜在的价值。结合本课题组其他实验结果表明,在缺血再灌注24 h前,NMDA受体2A亚单位的mRNA和蛋白水平是呈现一致变化的[7,8]。另有实验证明,缺血再灌注24 h时,海马区神经元受到的损伤是可逆的,功能状态受到抑制,在某些条件下如强刺激可被重新激活。可以推测,这时神经元的生存可通过某些条件挽救。这与缺血早期,某些因素的干预可扭转凋亡方向,阻止细胞的凋亡是一致的[15]。因此,把2A亚单位作为耙目标,观察阻断2A亚单位后缺血性脑损伤的变化,也许能揭示2A亚单位在脑缺血中的作用。
1 Zhang FX,Rubin R,Rooney TA.N-Methyl-D-aspartate inhibits apoptosis through activation of phosphatidylinositol 3-kinase in cerebellar granule neurons.A role for insulin receptor substrate-1 in the neurotrophic actionof N-methyl-Daspartate and its inhibition by ethanol.J Biol Chem,1998,273:26596-26602.
2 Bonfoco E,Krainc D,Ankarcrona M,et al.Apoptosis and necrosis:two distinct events induced,respectively,by mild and intense insults with N-methyl-D-aspartate or nitric oxide/superoxide in cortical cell cultures.Proc Natl Acad Sci USA,1995,92:7162-7166.
3 A Villringer,U Dirnagl.Pathophysiology of cerebral ischemia.Z Arztl Fortbild Qualitatssich,1999,93:164-168.
4 Goebel DJ,Poosch MS.NMDA receptor subunit gene expression in the rat brain:a quantitative analysis of endogenous mRNA levels of NR1,NR2A,NR2B,NR2C,NR2D and NR3A.Brain Res Mol Brain Res,1999,69:164-170.
5 Wenzel A,Scheurer L,Kunzi R,et al.Distribution of NMDA receptor subunit proteins NR2A,2B,2C and 2D in rat brain.Neuroreport,1995,7:45-48.
6 A Villringer,Dirnagl U.Pathophysiology of cerebral ischemia.Z Arztl Fortbild Qualitatssich,1999,93:164-168.
7 徐铁军,樊红彬,张凤真,等.前脑缺血再灌流后大鼠海马NMDA受体亚单位NR2A和NR2B蛋白质表达的变化.神经解剖学杂志,2002,18:110-116.
8 刘志安,徐铁军,张凤真,等.短暂性前脑缺血后大鼠海马各区NMDA受体亚单位NR 2A和NR 2B mRNA的表达变化.神经解剖学杂志,2004,20:153-157
9 Hossmann KA.Disturbances of cerebral protein synthesis and ischemic cell death.Prog Brain Res,1993,96:161-177.
10 Jamison JT,Kayali F,Rudolph J,et al.Persistent redistribution of poly-adenylated mRNAs correlates with translation arrest and cell death following global brain ischemia and reperfusion.Neuroscience,2008,154:504-520.
11 Wolf-Yadlin A,Sevecka M ,Macbeath G.Dissecting protein function and signaling using protein microarrays.Curr Opin Chem Biol,2009,72:679-683.
12 Hou ST,MacManus JP.Molecular mechanisms of cerebral ischemia-induced neuronal death.Int Rev Cytol,2002,221:93-148.
13 Jamison JT,Kayali F,Rudolph J,et al.Persistent redistribution of polyadenylated mRNAs correlates with translation arrest and cell death following global brain ischemia and reperfusion.Neuroscience ,2008,154:504-520.
14 Burda J,Hrehorovska M,Bonilla LG,et al.Role of protein synthesis in the ischemic tolerance acquisition induced by transient forebrain ischemia in the rat.Neurochem Res,2003,28:1213-1219.
15 Schwaninger M,Inta I,Herrmann O.NF-kappaB signaling in cerebral ischaemia.Biochem Soc Trans,2006,34:1291-1294.
